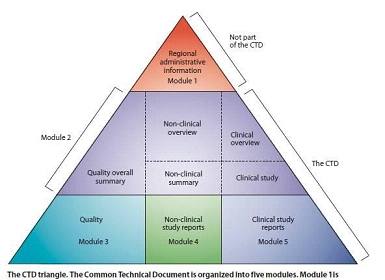
关于公开征求《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征求意见稿)》意见的通知
为鼓励创新,提高申请人和监管机构沟通交流的质量与效率,加快新药研发,我中心组织制订了《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征
国家药品监督管理局药品审评中心 - 化学药品创新药Ⅲ期临床试验 - 2022-08-06
CFDA全面接轨FDA,年底试行药品电子通用技术文档系统(eCTD)
2017年5月30日,CFDA药品审评中心的工作人员却并未休息,两部关于eCTD(药品电子技术通用技术文档)的征求意见稿选择在这一天发布,分别是《药品电子通用技术文档机构(征求意见稿)》以及《化学仿制药电子通用技术文档申报指导原则这也是既毕井泉局长在2月27日国务院新闻发布会上透露将建立eCTD系统并争取2017年底能够实现按新系统实行电子申报和审评以来,在推行eCTD进程方
MedSci - CFDA,eCTD,FDA - 2017-07-30
药品从申报到实验,最多60天
临床试验申请默许制正式落地!在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(以下简称药审中心)否定或质疑意见的,可按照提交的方案开展药物临床试验。
国家药监局 - 药品,申报,实验 - 2018-07-28
国外上市急需药品可以直接在CDE申请上市,免做临床
8月8日,药品审评中心(CDE)发布了《关于征求境外已上市临床急需新药名单意见的通知》,其对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride 等48个境外已上市临床急需新药名单,可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请。
生物探索整理自CDE - 急需药品,药品管理,CDE,境外 - 2018-08-09
临床急需境外新药标准复核检验用资料及样品有哪些要求?
6月25日,国家药品监督管理局发布《关于发布临床急需境外新药标准复核检验用资料及样品要求的通告(2019年第35号)》(以下简称通知)。
国家药品监督管理局 - 临床急需,境外新药 - 2019-06-27
《药品注册管理办法》9年后最重大修改(附修订稿 VS 2007版)
关于此修改稿的意见可于8月26日之前反馈给CFDA。时隔九年,与上一版2007年《药品注册管理办法》相比较,中国医药行业的情况发生了巨大的变化,药品注册管理工作的流程和范围需要进行与时俱进的重新调整:两万件药品注册申请积压待审,运动式的削峰药审无法真正改变这种积压的现状
E药经理人 - 药品,注册管理 - 2016-07-26
CFDA将对临床试验审评审批程序与方式作调整
12月14日,食品药品监管总局办公厅发布公告称,为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的要求,食品药品监管总局组织起草了《关于调整药物临床试验审评审批的公告(征求意见稿)》,现公开征求意见和建议。
CFDA - CFDA,临床试验审评审批程序 - 2017-12-15
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求
发布信息2003年5月美国FDA发布 翻译日期2009年6月分类 临床研究进程中相关的指导原则 标题新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求 附件1:http://www.cde.org.cn
MedSci原创 - 临床试验,申报 - 2014-03-13
《化学药品创新药I期临床试验申请药学共性问题相关技术要求》和《化学药品I期临床试验申请药学研究信息汇总表(修订版)》
为指导化学药品创新药研发,在国家药品监督管理局的部署下,药审中心组织制定了《化学药品创新药I期临床试验申请药学共性问题相关技术要求》,同时对原食品药品监管总局《关于发布〈新药I期临床试验申请技术指南〉
CDE - 2020-12-07
古代经典名方中药复方制剂说明书撰写指导原则(试行)
为加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,规范中医药理论申报资料和古代经典名方中药复方制剂说明书相关内容的撰写,在国家药品监督管理局的部署下,药审中心组织制定了《中药新药复
CDE - 经典名方 - 2021-10-15
中药新药复方制剂中医药理论申报资料撰写指导原则(试行)
为加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,规范中医药理论申报资料和古代经典名方中药复方制剂说明书相关内容的撰写,在国家药品监督管理局的部署下,药审中心组织制定了《中药新药复
CDE - 中药新药研究,中药新药 - 2021-10-15
31条修改,《药品注册管理办法》再次发布征求意见稿
10月15日,中国政府法制信息网公布:国家市场监督管理总局关于《药品注册管理办法(征求意见稿)》(以下简称新版)《药品生产监督管理办法(征求意见稿)》《药品经营监督管理办法(征求意见稿)》公开征求意见的通知为建立科学、严格的药品监督管理制度,
医谷 - 药品注册管理办法,征求意见 - 2019-10-18
抗肿瘤新药首次人体临床试验申请临床相关资料准备建议
一、背景为落实中办、国办联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(后简称《意见》),药审中心正在积极贯彻落实两办《意见》推出系列举措。优化临床试验审评审批制度是当前改革重点之一,临床试验方案将成为临床审评重点,内容结构完整的、高质量、可评价的临床试验方案是高效完成审评的保障。抗肿瘤新药是全球创新药研发热点,在当前创新药临床试验申请中大约占40%。然而,现阶段抗肿瘤药物首次
NMPA - 抗肿瘤,新药 - 2018-12-12
为您找到相关结果约500个