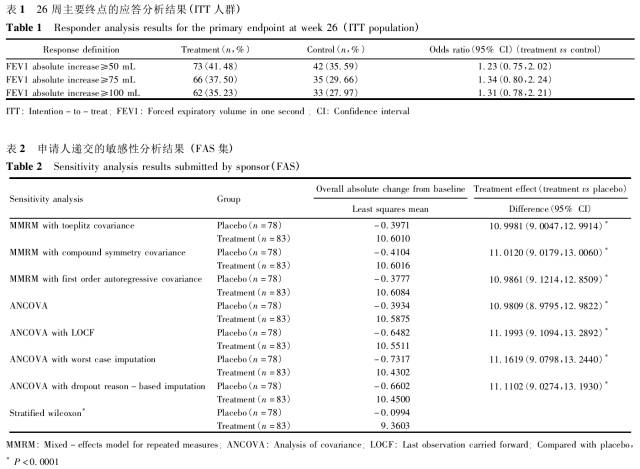
单组目标值(OPC)临床试验的统计学考虑
作者:中国临床试验生物统计学组(CCTS) 李卫,赵耐青(执笔) 来源:中国卫生统计 2017年6月 第34卷第3期 随机对照临床试验(randomized controlled trial,RCT)是临床研究的金标准,药物/医疗器械临床研究中,尤其是提供关键证据的临床研究中一般均采用RCT。在极少数的医疗器械临床试验中,如采用随机对照试验,会存在伦理学风险,致使临
中国卫生统计 - 单组目标值 - 2019-01-29
药审中心:临床试验缺失数据的统计学考量
缺失数据是临床试验中常见的重要问题,可能引起试验结果难于解释,甚至影响整个试验的推断和结论,但目前在国内临床研究中尚未引起足够的重视。实际应用中,申请人对待缺失数据的处理存在盲口应用统计学方法的现象,给新药安全有效性的评价和确证带来诸多困难。本文针对三个实际案例进行深入地阐述和分析,探讨对缺失数据的预防、估训一量的选择、缺失数据的统训一分析方法以及敏感性分析等,以期有助于申请人在临床试验中加强
中国临床药理学杂志 - 临床试验,缺失数据 - 2016-06-18
关于公开征求《疫苗临床试验的统计学指导原则(征求意见稿)》意见的通知
鉴于疫苗临床试验的特点,在药物研发过程中,需要选择合适的设计和分析方法以确保研究质量和结果的可靠性。我中心组织起草了《疫苗临床试验的统计学指导原则(征求意见稿)》,现公开征求意见。
国家药品监督管理局药品审评中心 - 疫苗临床试验 - 2023-11-07
免于进行临床试验的体外诊断试剂临床评价资料基本要求发布
为进一步做好体外诊断试剂注册管理,规范免于进行临床试验的体外诊断试剂临床评价工作,根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号),8日国家食品药品监督管理总局发布了《免于进行临床试验的体外诊断试剂临床评价资料基本要求
新浪医药新闻 - 体外诊断试剂,免于进行临床试验 - 2017-11-09
总局明确豁免临床试验IVD试剂临床评价资料要求
继10月30日,国家食品药品监管总局发布第三批免于进行临床试验的医疗器械目录(以下简称“目录”),对37种第二类医疗器械、11种第三类医疗器械和116种体外诊断(IVD)试剂豁免进行临床试验后,日前,总局又发布《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》(以下简称《基本要求》),并于发布之日起施行。《基本要求》配合目录使用,用于指导注册申请人进行体外诊断试剂临床评价工作。这是总局
中国医药报 - 临床试验,IVD试剂 - 2017-11-10
CDME:《2019新型冠状病毒核酸检测试剂注册技术审评要点》发布
为应对新型冠状病毒感染的肺炎疫情,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,我中心制定了《2019新型冠状病毒核酸检测试剂注册技术审评要点》,现予以发布。
CDME - 新型冠状病毒,核酸检测试剂,注册 - 2020-02-12
CCTS共识:临床试验中样本量确定的统计学考虑 2015
样本量 确定 (samplesizedetermination),又称样 本量估计 (samplesizeestimation),是指为满足统计 的 准确性和可靠性(I类错误 的控制和检验效能的保证) 计算 出所需的样本量 ,它是 临床试验设计 中一个极为 重要 的环节 ,直接关系到研究结论 的可靠性 、可重复 性 ,以及研究效率的高低。样本量估计也是一个成本. 效果和检验效能 的权
CCTS,样本量 - 2016-06-17
CCTS 专家共识:非劣效临床试验的统计学考虑 2012
鉴于非劣效临床试验在 国内开展地 比较广泛,但 在研究设计和评价方面尚未形成相对统一 的认识 ,为 此中国临床试 验生 物统计学工作 小组 (CCTS),经充 分讨论 ,于 2011年 10月 30
统计,非劣效 - 2012-04-01
CCTS 专家共识:临床试验中多重性问题的统计学考虑 2012
临床试验根据研究目的不同可分为“探索性临床 试验”和“确证性临床试验”,而临床研究结论通常需 要根据确证性临床试验的统计推断结果得到。如果某 一确证性临床试验需要对多个检验假设做出统计学推 断,例如多个主要疗效指标的多重检验、多组间多重比 较、多个时间点的期中分析( interim analysis) 等情况 下,便会涉及多重性无须考虑多 重性
CCTS,专家,统计 - 2012-06-17
ICH E9临床试验的统计学指导原则解析
ICH E9 Statistical principles for clinical trials (临床试验的统计学指导原则)可谓生物统计师的bible,目的在于协调欧洲、日本和美国在进行药品上市申请的临床试验时所应用的统计学方法的指导原则虽说中国是协调三方之外的国家,SFDA还为此另外制定了自己的《化学药物和生物制品临床试验的生物统计学技术指导原则》,但其内容基本还是照抄翻译了ICH E9的
MedSci原创 - ICH,E9,临床试验,统计 - 2012-05-28
多中心临床试验中中心校正的统计学实现(SPSS)
多中心临床试验可以在较短的时间内招募到足够多的病例数,同时,来自多中心的病例比来自单中心的病例更具有代表性,可以使所得结论的应用面更广泛。但由于各中心的试验条件不完全相同,所得结论也不尽相同。因此, 在评价疗效时, 必须考虑中心间效应的差别。当中心间差距较大时,如果直接合并各中心资料,可能会对总的结论有一定影响。这里涉及到两个问题,其一是评价中心效应是否存在,其二是如何扣除中心效应的影响对疗效进行
MedSci原创 - 中心校正,SPSS - 2013-11-19
医疗器械临床试验85个常见问题解答
01、关于临床试验用医疗器械注册检验报告一年有效期问题答:《医疗器械临床试验质量管理规范》第七条规定:“质量检验结果包括自检报告和具有资质的检验机构出具的一年内的产品注册检验合格报告”。对于其中检验机构的一年内的产品注册检验合格报告,在多中心开展临床试验的情形,是以检验报告出具时间至临床试验牵头单位伦理审查通过时间计算一年有效期;在非多中心开展临床试验的情形,是以检验报告出具时间至每家临床试验
MedSci原创 - 医疗器械,问题 - 2019-01-29
为您找到相关结果约500个