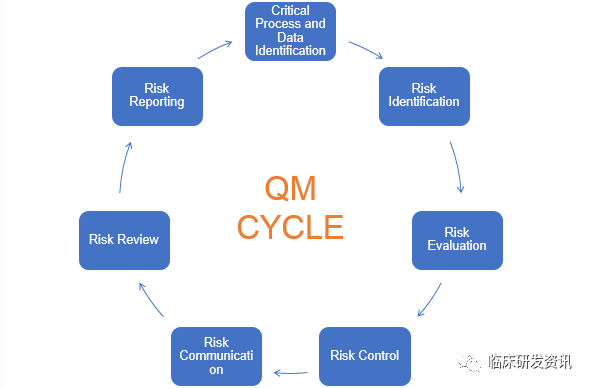
临床试验中的风险识别及风险管理
临床试验中不好的一面--风险,临床试验中处处都有坑。对待未知的事物,我们都会感觉莫名的恐惧和消极,但是对待任何未知事物人们的处理流程都是相似的,先认识,理解,再在这个认知的基础上去想办法应对,并加以利
MedSci原创 - 风险管理,临床试验 - 2020-03-29
抗肿瘤药物临床试验中的受试者管理
随着肿瘤诊断技术的提高,发病机制的深入探讨以及新的靶向治疗及免疫治疗方法的快速发展,肿瘤临床试验也取得了飞速发展。国际、国内的政策法规也对临床试验整体的质量提出了更高要求,其中重中之重是受试者的管理。由于肿瘤临床试验的复杂性及特殊性,对于受试者的管理有些特殊要求,笔者将结合自己的工作经验探讨一下肿瘤临床试验受试者的管理。 研究者对受试者的管理 1 知情同意的过程 《药物临床试验质量管
MedSci原创 - 抗肿瘤 - 2018-12-12
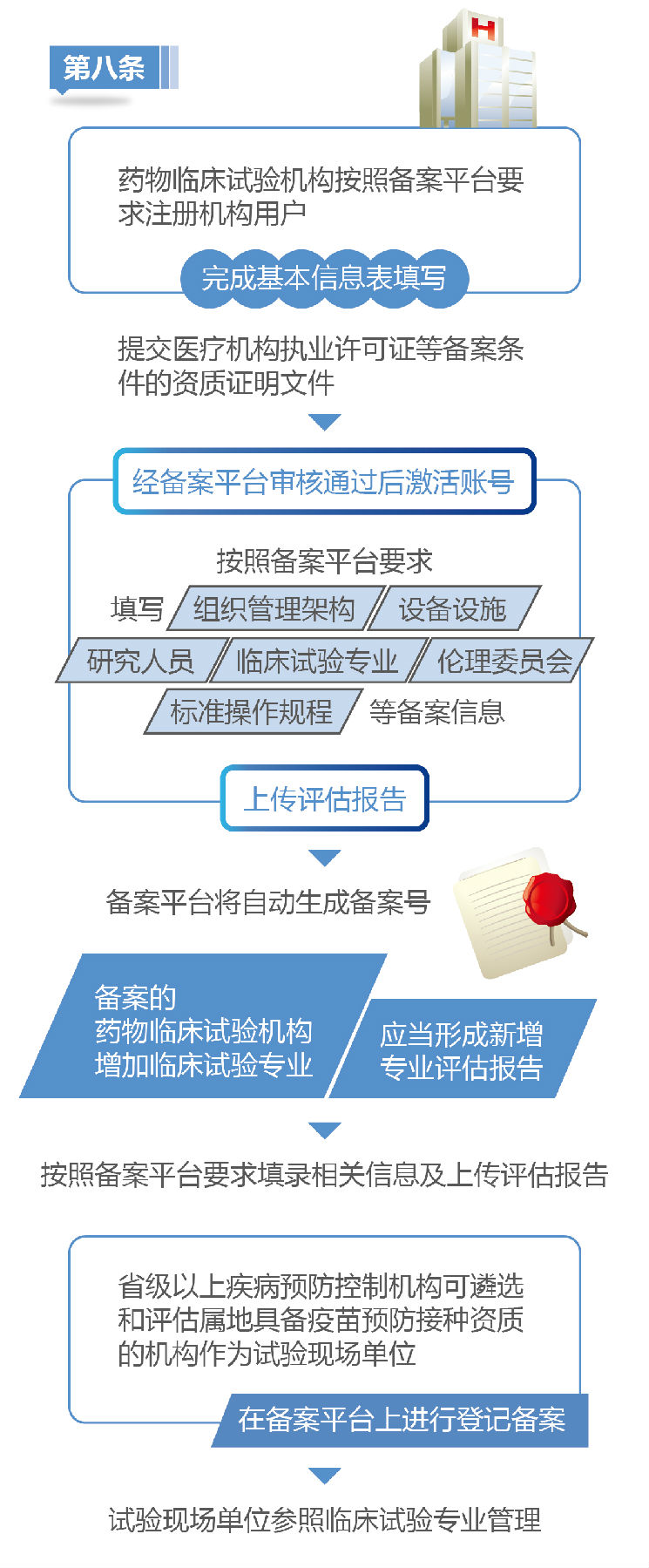
《医疗器械临床试验质量管理规范》今日实行
为加强医疗器械临床试验监督管理,维护医疗器械临床试验过程中受试者权益,保证医疗器械临床试验过程规范,国家食品药品监督管理总局、国家卫生计生委联合发布的《医疗器械临床试验质量管理规范》今起施行。规范提出,在受试者参与临床试验前,研究者应当充分向受试者或者无民事行为能力人、限制民事行为能力人的监护人说明临床试验的详细情况,包括已知的、可以预见的风险和可能发生的不良事件等。申办者对发生与试验相关
CFDA - 体外诊断,医疗器械,临床试验 - 2016-06-05
最新临床试验专场试验揭晓
侯静波获CIT青年医师一等奖 刘健获CIT最具教育意义病例奖 昨日(3月16日)下午,第十届中国介入心脏病学大会(CIT)最新临床试验专场的四项研究在众人期待中揭晓,本报记者刘敏第一时间为您传递TRACK-D 与任何商业利益无关的TRACK-D研究通过大样本的前瞻性多中心随机对照试验纳入患者2998例。结果显示,瑞舒伐他汀可降低伴有慢性肾病2~3期的糖尿病患者对比
MedSci原创 - 临床试验 - 2012-03-23
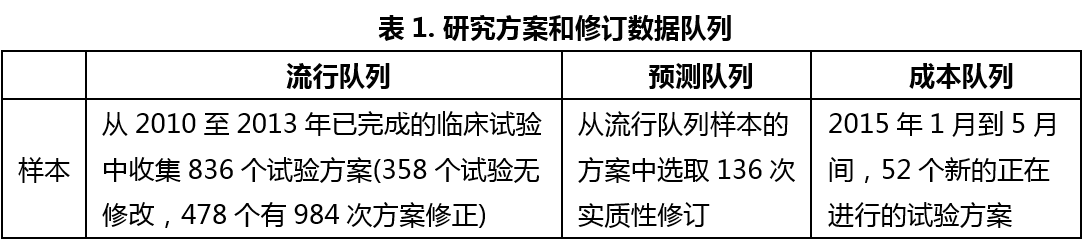
临床试验方案修订对临床试验结果和费用的影响
临床试验方案是保证临床试验顺利有序开展的前提,其一经制订并批准就应严格执行。在实际的临床试验开展过程中,有时对临床试验方案确有必要进行修订。但是,如果修订不够谨慎的话,就可能影响到试验结果、试验周期和试验经费。长期以来,对于制药公司和CRO公司而言,因临床试验方案的修订而导致的计划外的推迟、中断和花费都是很大的挑战。
国际药品检查动态研究 - 试验方案,修订 - 2019-12-26
如何开展新药临床试验:从GCP,SOP到临床试验管理和质量控制
GCP的原则与内容 GCP(Good Clinical Practice),即药物临床试验质量管理规范,它是临床试验过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。其目的是保证药品临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 一、GCP的发展过程 19世纪末化学制药工业的兴起,开创了化学药品开始用于临床治疗的新纪元。
上海交通大学医学院附属第九人民医院 - 新药,临床试验 - 2015-07-04
临床试验中偏离方案的管理
临床试验方案的设计过程中,人们总是尽可能的考虑到各 种可能影响试验的因素,并制定标准操作规程,建立质量控制和质量保证体系,尽量避免及减少在试验中可能出现违背及偏离方案的情况发生;但在试验的执行过程中,偏离试验方案的情况往往不可避免。本文综合临床试验的有关国内外指南与法规,以及国际多中 心临床试验的实践经验,对偏离方案的定义、举例分
中国新药杂志 - 临床试验,偏离,方案 - 2014-08-09
临床试验的依从性管理策略
临床试验的依从性(compliance或obedience)是指受试者或研究者对试验方案的遵循程度。受试者和研究者的依从性好坏直接关系到临床试验结果的可靠程度,因此必须加以控制。 临床试验受试者的依从性 受试者的依从性主要指受试者是否按试验方案的要求用药、是否按要求接受随访。一般来讲,住院病人的依从性较好控制,但门诊病人的依从性往往不易掌握。
MedSci原创 - 临床试验,依从性 - 2013-11-18
《医疗器械拓展性临床试验管理规定(试行)》解读
为满足公众临床需要,支持并规范医疗器械拓展性临床试验的开展和安全性数据的收集,国家药品监督管理局会同国家卫生健康委员会发布了《医疗器械拓展性临床试验管理规定(试行)》。现就有关问题解读如下:
动脉新器械 - 医疗器械,拓展性临床试验 - 2020-03-29
实施临床试验报告规范,提高临床试验透明度
临床试验是指以人为对象的前瞻性研究,预先将受试者或受试人群分配至接受一种或多种医疗干预,以评价医疗干预对健康结局的影响。1、临床试验信息透明化的必要性 临床试验是获得防病治病知识的必要途径,主要目的是不断改进预防、诊断和治疗方法,提
MedSci原创 - 临床试验,规范,透明度 - 2014-04-24
临床试验数据管理之数据记录的常见问题
做临床试验的数据管理,那肯定需要对数据记录进行核查的,虽然有程序核查来完成大部分数据库核查工作,不过毕竟机器不是万能,还是有一些东西需要经验老道的数据管理员来完成的。
MedSci原创 - 数据管理 - 2012-12-13
《临床试验数据管理工作技术指南》发布(可下载)
临床试验数据是支持药品获准上市的最重要实证。良好规范的数据管理工作是保证临床试验质量的关键。我国《药品注册管理办法》和《药物临床试验质量管理规范》等对此均有相应的原则性要求。 为加强我国药物临床试验数据的规范管理,保证药物临床研究数据的质量,使药物的评价基于科学的实证,自2009年以来,
MedSci原创 - 指南,临床试验 - 2012-05-30
为您找到相关结果约500个