2017全年CDE药品审评报告
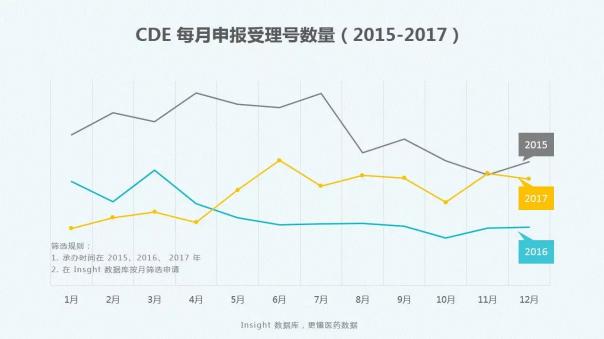
Insight数据库2017年终报告梳理了2017年CDE药品申报和审评的数据情况,让大数据来为你指路。
Insight数据库 - 药品审评,CDE,2017 - 2018-01-12
2019年6月CDE药品审评情况报告
摘要· 6月CDE共承办药品注册申请628件· 恒瑞医药提交马来酸吡咯替尼新适应症临床申请· 正大天晴首家提交甲磺酸仑伐替尼胶囊仿制申请· 9个品种通过仿制药一致性评价· 69个受理号获临床试验默示许可总体承办情况:药品注册申请628个据MED中国药品审评数据库2.0统计,2019年6月CDE共承办药品注册申请628个。
米内网 - CDE,药品审评 - 2019-07-04
CDE与山东省药监局达成战略合作 共同提升药品审评能力
为加快推进药品审评审批制度改革,促进国家总局及省局技术审评优势互补,共同推进药品技术审评能力建设,5月26日,国家食品药品监督管理总局药审中心与山东省食品药品监督管理局签署战略合作协议。
医药魔方 - 药品审评,CFDA,山东 - 2017-06-23
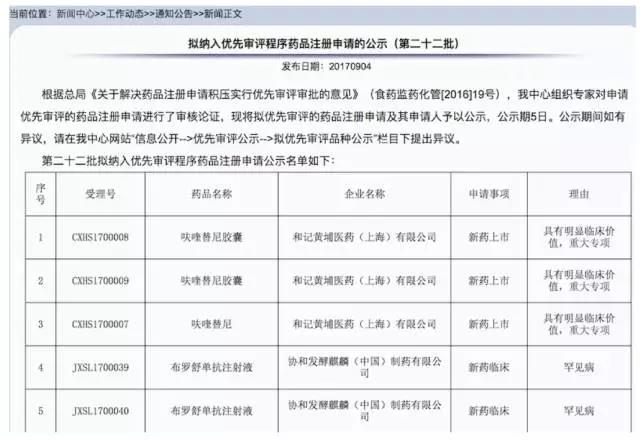
新增15个品种拟被CDE纳入优先审评程序
8月19日至22日,CDE网站拟优先审评公示栏新增15个品种。拟同意纳入优先审评的理由分别是:注射用复方维生素(13)为仿制药上市;小儿钠钾镁钙葡萄糖注射液、小儿等渗电解质注射液为儿童药;曲美替尼片、达拉非尼胶囊、HSK3486乳状注射液、西妥昔单抗注射液、帕博利珠单抗注射液为具有明显治疗优势药品
新浪医药新闻 - 优先审评,治疗优势 - 2019-08-25
【喜讯】肠癌新药呋喹替尼进入CDE优先审评程序
9月4日,国家食品药品监督管理局药品评审中心(CDE)在官网上发布公告,包括我国原创小分子靶向药物呋喹替尼在内的多个药品进入优先审批程序。
肿瘤资讯 - 呋喹替尼,靶向药物,药品注册 - 2017-09-07
SMO抑制剂上市申请获CDE优先审评,治疗基底细胞癌
今日,上海济煜医药/Sun Pharma磷酸索尼德吉胶囊(商品名:Odomzo)上市申请被CDE纳入优先审评并开始公示,用于手术或放疗后复发的局部晚期基底细胞癌(BCC)成年患者,或不宜手术或放疗的患
医药魔方 - 基底细胞癌,抑制剂,临床研究中 - 2021-03-07
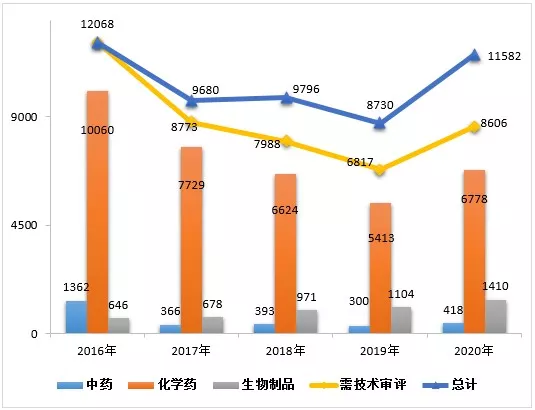
2020年度药品审评报告
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法
CDE - 药品审评报告 - 2021-06-23
CSCO2022 CDE专场|抗肿瘤ADC药物的临床研发与审评考虑
DE夏琳审评员作了题为“抗肿瘤ADC药物的临床研发与审评考虑”的报告,对ADC药物的临床研发现状进行了简要的介绍并强调了ADC药物研发过程中需要考虑的重要方面。
网络 - CDE,ADC药物,CSCO2022 - 2022-11-08
国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)
为加强药品监督管理,国家药品监督管理局发布了《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》,本文为其具体文件内容。
国家药品监督管理局官网 - 药品审评 - 2023-08-17
CSCO2022 CDE专场|2022年中国抗肿瘤新药审评情况报告
在2022年11月6日上午开启的CDE专场中,国家药品监督管理局药品审评中心副主任杨志敏针对2022年中国抗肿瘤新药审评情况展开精彩报告。
网络 - CDE,2022年中国抗肿瘤新药审评情况报告 - 2022-11-08
2014年3月CDE受理药品简介
2014年3月,CDE共受理药品申请745件,较2月份增长近40%。其中,新药申请212件,仿制申请193件,进口申请68件,均较2月份有不同程度的增加。图2014年3月CDE受理药品申请类型分布 注册分类为1类的新药申报均为新药临床申请,共有16件,涉及7个品种,均为化学药品,其中有6个品种为1.1类,1个品种为1.6类。
中国医药工业信息中心 - CDE,药品 - 2014-05-13
药品审评中心补充资料工作程序(试行)
为配合《药品注册管理办法》的贯彻实施,进一步规范药品注册审评补充资料管理工作,结合药品审评以流程为导向的科学管理体系的研究成果和审评工作实际,药审中心研究制定了《药品审评中心补充资料工作程序(试行)》
CDE - 药品审评中心 - 2020-12-07
为您找到相关结果约500个