真实世界证据支持药物研发与审评的指导原则(试行)
为进一步指导和规范真实世界证据用于支持药物研发和审评的有关工作,保障药物研发工作质量和效率,国家药品监督管理局组织制定了《真实世界证据支持药物研发与审评的指导原则(试行)》,现予发布。 国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,均提出鼓励研究和创制新药。
CDE - 真实世界,证据 - 2020-01-11
真实世界证据支持药物注册申请的沟通交流指导原则(试行)
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,药审中心组织制定了《真实世界证据支持药物注册申请的沟通交
国家药品监督管理局药品审评中心 - 真实世界证据,真实世界证据支持药物 - 2023-02-23
真实世界证据支持药物研发审评,这四点思考值得关注!
1月7日,国家药监局把2020年的一号文件,留给了此前就备受行业关注的真实世界证据支持药物研发与审评。 在其官网上,药监局同时公布了《真实世界证据支持药物研发与审评指导原则(试行)》,以及该文件的起草说明。作为国内发布的首个真实世界证据支持药物研发与审评的指导文件,这被视为新药研发审评道路上的里程碑事件,并迅速引起了行业的密切关注。事实上,如何利用真实世界证据评价药物的有效性和安全性
E药经理人 - 真实世界,证据 - 2020-01-11
真实世界证据支持药物研发? ——读真实世界证据支持药物研发征求意见稿的启示
真实世界研究、真实世界数据、真实世界证据、相信这三个名词我们的读者们都不陌生。真实世界这个概念近几年实在是太火了,以至于我们翻开一本期刊常常看到好几篇真实世界“冠名”的文章。今年五月二十九日药审中心发布了公开征求《真实世界证据支持药物研发的基本考虑》意见的通知(http://www.cde.org.cn/news.do?method=largeInfo&id=314865 支持下载相关文件
临床流行病学和循证医学 - 药物研发 - 2019-10-08
药物真实世界研究设计与方案框架指导原则(试行)
为了指导申办者科学合理的设计真实世界研究,明确真实世界研究方案撰写的技术要求,药审中心组织制定了《药物真实世界研究设计与方案框架指导原则(试行)》。根据《国家药监局综合司关于印发药品技术指导原则发布程
国家药品监督管理局药品审评中心 - 药物真实世界研究设计 - 2023-02-23
国家药监局药审中心关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,药审中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》(见附件)。
国家药品监督管理局药品审评中心 - 2021-04-15
CDE发布《真实世界证据支持药物研发的基本考虑》意见稿
5月29日,动脉新医药获悉,国家药品监督管理局药品审评中心组织起草发布了《真实世界证据支持药物研发的基本考虑(征求意见稿)》。为鼓励研究和创制新药的要求,考虑到药物临床研发过程中,存在临床试验不可行或难以实施等情形,利用真实世界证据用以评价药物的有效性和安全性成为可能的一种策略和路径。
动脉网 - CDE,药物研发,罕见病 - 2019-05-30
真实世界证据支持药物研发的基本考虑(征求意见稿)
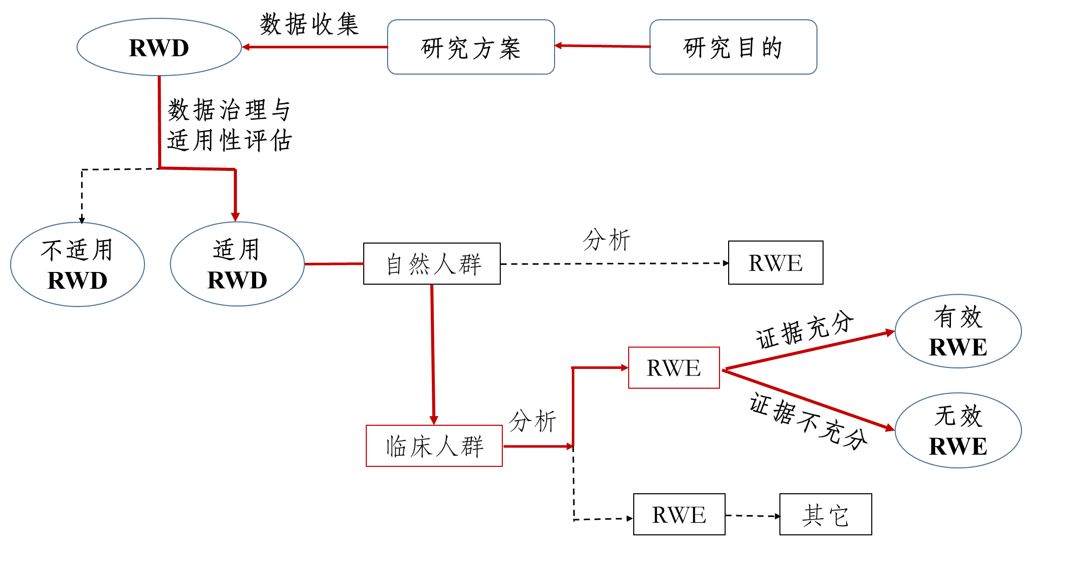
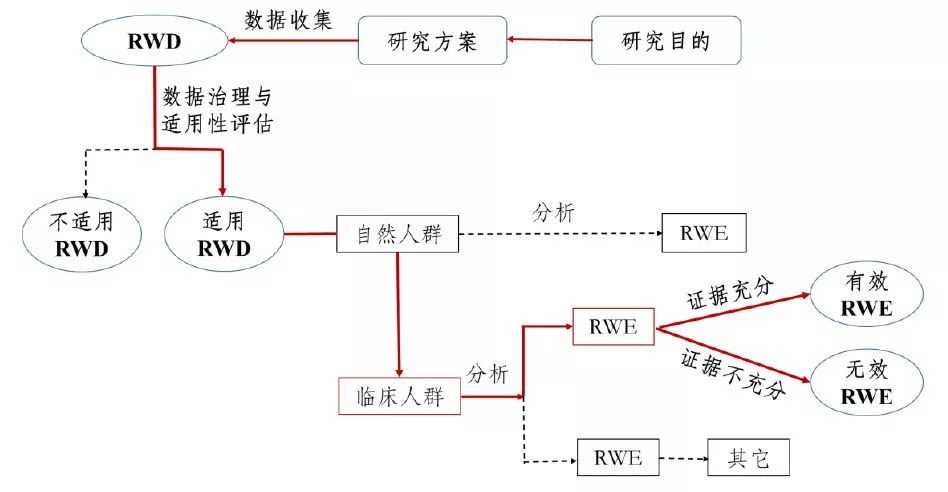
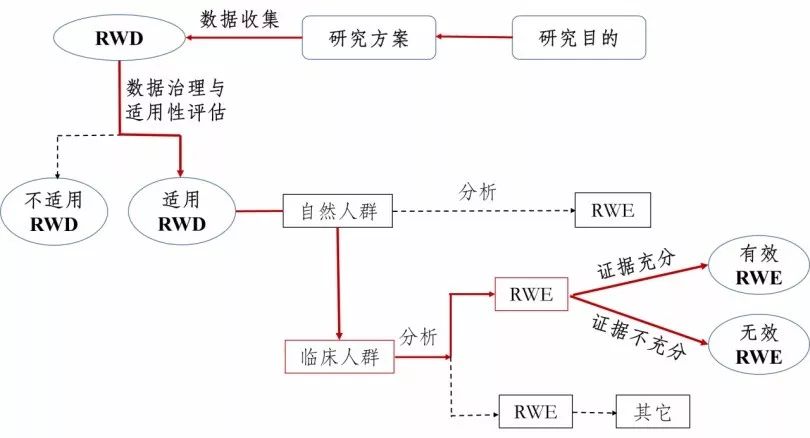
真实世界证据支持药物研发的基本考虑(征求意见稿)国家药品监督管理局药品审评中心2019年5月 一、 引言1.背景与目的随机对照临床试验(Randomized Controlled Trial,RCT)被认为是评价药物有效性的“金标准”,并为药物临床试验普遍采用。RCT严格控制试验入组与排除标准和其它条件,并进行随机化分组,因此能够最大限度地减少影响因果推断的因素,使得研究结论较为确定,所形成
CDE - 真实世界,药物研发 - 2019-05-29
关于《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》公开征求意见的通知
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,我中心组织起草了《真实世界证据支持药物注册申请的沟通交流
国家药品监督管理局药品审评中心 - 真实世界证据支持药物 - 2022-08-20
真实世界研究支持儿童药物研发与审评的技术指导原则(试行)
考虑到我国儿童药物研发及药品注册中的实际需要,帮助企业更好地理解《真实世界证据支持药物研发与审评的指导原则(试行)》在儿童药物研发中的应用,在国家药品监督管理局的部署下,药审中心组织制定了《真实世界研
CDE - 指导原则 - 2020-10-03
《用于产生真实世界证据的真实世界数据指导原则(试行)》
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,药审中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品
国家药品监督管理局药品审评中心 - 真实世界数据,真实世界研究 - 2021-04-15
真实世界证据支持药物研发的基本考虑
为落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)鼓
CDE - 指导原则,真实世界研究 - 2020-10-03
CDE:《真实世界证据支持药物研发的基本考虑》意见稿
为落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)鼓励研究和创制新药的要求,考虑到药物临床研发过程中,存在临床试验不可行或难以实施等情形,利用真实世界证据用以评价药物的有效性和安全性成为可能的一种策略和路径。
网络 - 真实世界证据,药物研发 - 2019-05-29
FDA指导原则:使用真实世界的证据支持医疗器械的监管决策
FDA 发布本指南以阐明我们如何评估真实世界数据,以确定它们是否足以生成可用于 FDA 医疗器械监管决策的真实世界证据类型。 本指南适用于所有设备,因为该术语是根据《联邦食品、药品和化妆品法案》(FD
FDA - 医疗器械 - 2021-10-22
为您找到相关结果约500个