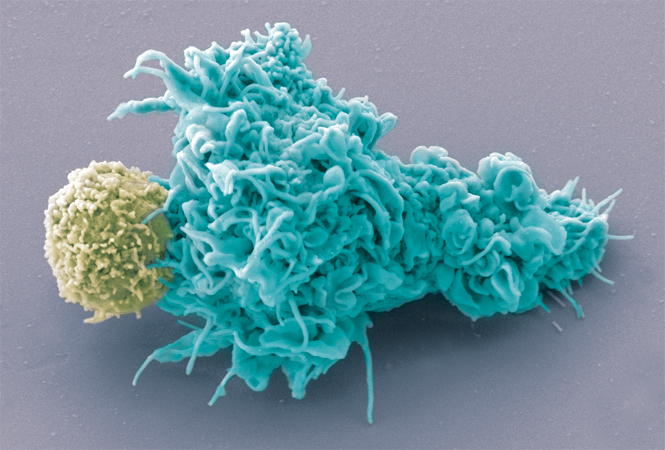
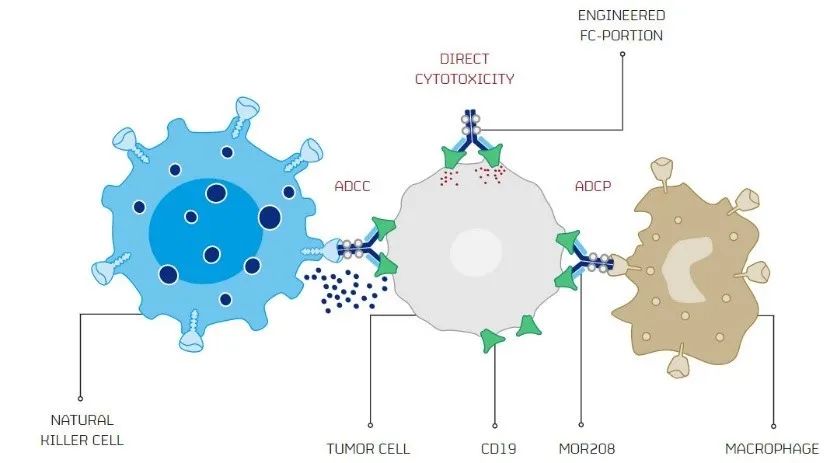
EMA开始审查MorphoSys的CD19单抗tafasitamab,治疗淋巴瘤
如果获得批准,tafasitamab可能会对诺华和吉利德的CAR-T疗法带来挑战。
MedSci原创 - 淋巴瘤,CD19单抗tafasitamab - 2020-05-22
天境生物与MorphoSys就肿瘤创新生物药 MOR210 开发达成战略合作
聚焦于肿瘤免疫和自身免疫疾病治疗领域的生物创新药研发公司天境生物科技(上海)有限公司(以下称“天境生物”)与德国 MorphoSys 公司今日联合宣布就肿瘤免疫创新生物药 MOR210 开发达成战略合作
美通社 - 天境生物,肿瘤创新生物药 - 2018-11-16
Incyte以11亿美元收购MorphoSys的抗CD19单抗tafasitamab,用于治疗B细胞淋巴瘤
Incyte已与MorphoSys签署了一项价值高达11亿美元的协议,以共同开发和商业化MorphoSys的淋巴瘤候选药物抗CD19单抗tafasitamab。
MedSci原创 - Incyte,11亿美元收购,MorphoSys,抗CD19单抗,淋巴瘤 - 2020-01-16
Janssen启动了Crohn''s药物Tremfya的PhII / III期计划
Janssen启动了一项评估克罗恩病Tremfya的II / III期计划。GALAXY计划将包括一项II期研究(GALAXY 1),随后进行两项III期研究(GALAXI 2和GALAXI 3),预计将招募约2,000名患者。Tremfya(guselkumab)的安全性和有效性将在患有中度至重度活动形式的克罗恩病的患者中进行评估,克罗恩病是一种无法治愈的炎症性肠病。Tremfya是由Janss
MedSci原创 - Janssen,tremfya,PhII,/,III期计划 - 2018-07-11
CAR-T对手来了!CD19单抗tafasitamab联合来那度胺治疗淋巴瘤提交FDA上市申请
德国生物制药公司MorphoSys近日发布了新型人源化Fc结构域优化免疫增强单克隆抗体tafasitamab(MOR208)II期临床研究L-MIND(NCT02399085)的最终分析结果。今年1月
MedSci原创 - 淋巴瘤,B细胞淋巴瘤,tafasitamab - 2020-05-06
tafasitamab一线治疗DLBCL的I期临床研究已正式开展
MorphoSys制药公司近日宣布,抗CD19抗体tafasitamab一线治疗弥漫性大B细胞淋巴瘤(DLBCL)的的Ib期临床研究已正式开始。
MedSci原创 - tafasitamab,DLBCL,I期临床 - 2019-12-30
治疗大 B 细胞淋巴瘤又一单抗获 FDA 突破性疗法指定
10 月 23 日,德国生物技术公司 MorphoSys 宣布,美国 FDA 将突破性疗法指定授予给公司单抗药物 MOR208,与来那度胺联用治疗不适于接受高剂量化疗或自体干细胞移植的复发或难治性弥漫性大
新浪医药 - B细胞淋巴瘤,疗法,突破 - 2017-10-27
GSK抗GM-CSF单抗otilimab治疗类风湿性关节炎正在开展3期临床研究
GSK启动了一项III期临床开发项目,测试抗粒细胞巨噬细胞集落刺激因子(抗GM-CSF)单抗otilimab对中度至重度类风湿性关节炎(RA)患者的治疗潜力。这类患者对改善疾病症状的抗风湿药物(DMARD)或靶向治疗反应不足。
MedSci原创 - GM-CSF单抗,otilimab,类风湿性关节炎,3期临床研究 - 2019-07-05
晚期实体瘤的新希望!FDA批准MOR210 / TJ210治疗晚期实体瘤的IND
美国食品药品监督管理局(FDA)已批准研究性新药申请(IND),允许研究性人类抗C5aR1抗体MOR210 / TJ210治疗复发或难治性晚期实体瘤的临床试验。
MedSci原创 - 晚期实体瘤,MOR210 / TJ210 - 2020-09-18
FDA批准Monjuvi(tafasitamab-cxix)联合来那度胺治疗复发难治弥漫性大B细胞淋巴瘤
美国食品药品监督管理局(FDA)已批准Monjuvi(tafasitamab-cxix)联合来那度胺治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)且不适合自体干细胞移植(ASCT)的成人患者。
MedSci原创 - 来那度胺,弥漫性大B细胞淋巴瘤,Monjuvi(tafasitamab-cxix) - 2020-08-03
诺诚健华重金引进淋巴瘤单抗新药,国内市场竞争再加剧
8月17日,诺诚健华和Incyte公司联合宣布,诺诚健华旗下一家子公司和Incyte公司就一款靶向CD19的Fc结构域优化的人源化单克隆抗体tafasitamab在大中华区的开发和商业化签订了合作和许
MedSci原创 - 人源化单克隆抗体 - 2021-08-18
天境生物与MorphoSys签署抗肿瘤创新生物药项目合作协议
美通社 - 2017-12-05
MorphoSys宣布开始3期试验(PROTOSTAR)评估IL-23单抗Guselkumab对银屑病儿童患者的疗效
MorphoSys宣布开始对患有慢性斑块状银屑病的儿科患者进行guselkumab的3期临床试验。
MedSci原创 - IL-23单抗,银屑病,三期临床,儿童患者 - 2018-09-26
诺华突破性药物bimagrumab临床后期研究遭遇滑铁卢
诺华公司最近表示,公司开发的用于治疗散发性包涵体肌炎新药bimagrumab(BYM338)在一项最新的临床IIb/III期研究中未能达到首要终点而宣告失败。这一结果对公司研发部门造成重创,甚至有人认为这是诺华公司研发部门近年来遭遇的最大失败。 对于BYM338,诺华公司一直寄予厚望。此前公司已经获得了美国FDA授予的突破性药物认证。公司还希望将这种药物拓展到包括COPD在内的多种疾病治疗中去。
不详 - 诺华,肌生成抑制蛋白,bimagrumab,MorphoSys - 2016-04-26
FDA审查诺华新型血液肿瘤药物
FDA肿瘤药物咨询委员会在11月06日召开了会议并提前发布了文件,该机构官员没有给出多少评论,而是注重诺华公司768例3期临床试验的相关数据。在疗效方面,使用由诺华的帕比司他,武田的万珂和类固醇地塞米松组合的复方药物相对单独使用帕比司他能够延长无进展生存期(PFS)3.9个月,帮助患者延长近半年的寿命且没有严重症状。 诺华公司相信,其新的肿瘤治疗药物对于有严重多发性骨髓瘤和血癌的患者会有强烈
cphi - 血液肿瘤,药物 - 2014-11-11
为您找到相关结果约25个