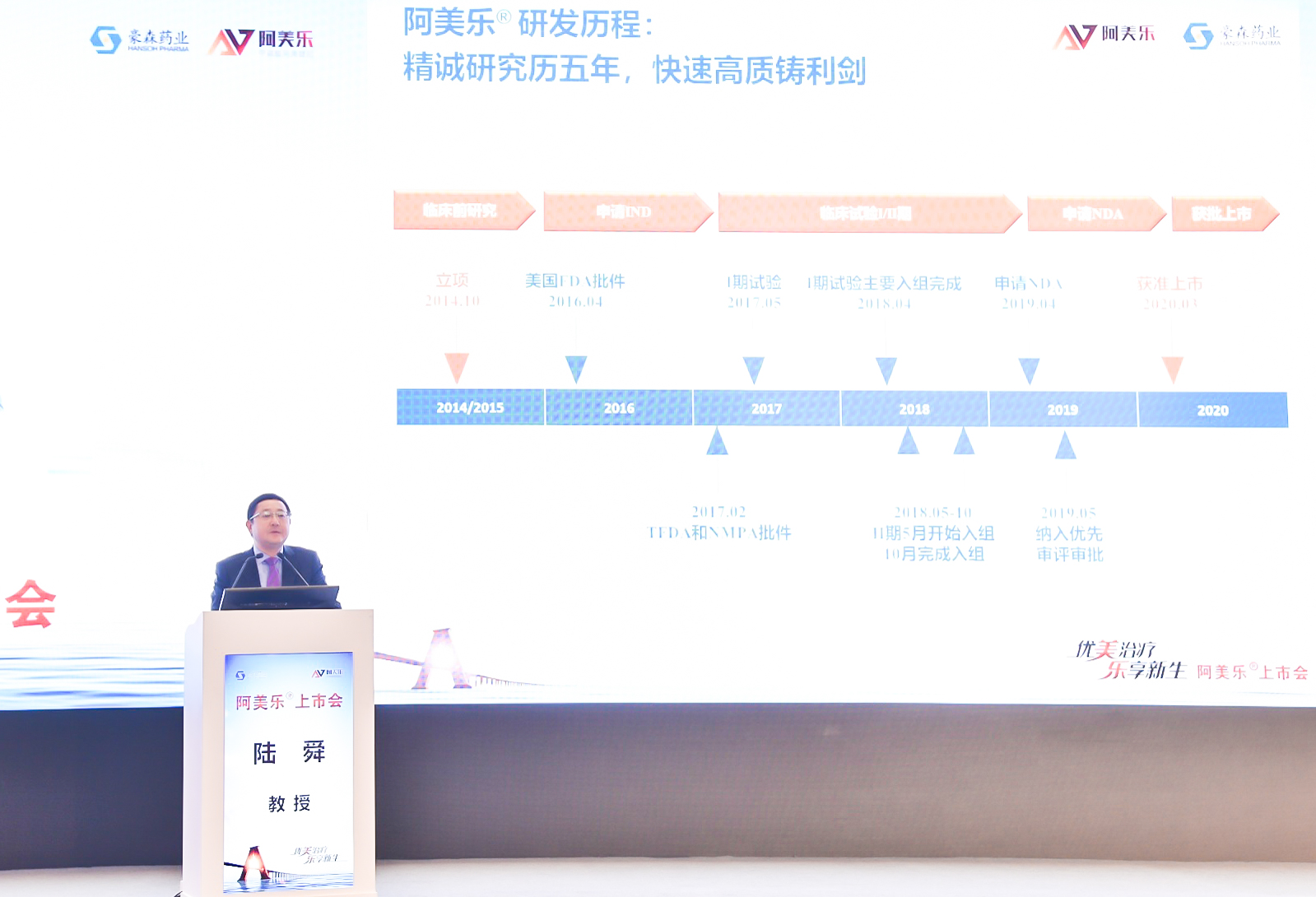
众议院通过“21世纪治愈法案”,FDA新药评审或将进一步改革
“21世纪治愈法案”是新药开发立法的又一个里程碑,不仅进一步推动FDA对新药评审的改革,也赋予国立卫生研究院(NIH)更多的研究资源,促进基础医疗研究的发展。
美中药源 - FDA新药评审,改革 - 2015-07-13
优先审评审批助力丙肝新药加快上市
随着我国药品审评审批制度改革的持续推进,广大丙肝患者的热切期盼成为现实——9月21日,国家食品药品监督管理总局同时批准吉利德公司(Gilead)的口服丙肝新药索磷布韦片,艾伯维公司(AbbVie)的奥比帕利片
中国医药报 - 优先评审,丙肝新药,上市 - 2017-09-25
加快境外上市新药审评审批获积极进展
党中央、国务院高度重视药品医疗器械审评审批制度改革工作,加快境外上市新药的审评审批是其中重要一环。今年4月、6月,李克强总理先后主持召开国务院常务会议,就加快进口新药上市作出系列重要部署。6月22日,在国务院新闻办召开的国务院政策例行吹风会上(以下简称吹风会),国家药品监督管理局局长焦红介绍,加快境外上市新药审评审批工作取得积极进展,简化境外上市新药审批政策效果初步显现。
中国医药报 - 境外上市新药,审评审批 - 2018-06-25
中国药品审评审批用时进一步压缩,创新药物审评审批再提速
记者6日从全国药品监管工作座谈会上获悉,我国药品审评审批用时进一步压缩,待审评的药品注册申请已由2015年高峰时的2.2万件降至3200件以内。创新药物和医疗器械审评审批进一步加快,截至今年6月底,共对29批597件药品注册申请进行优先审评审批,审核批准了39个创新医疗器械和4个优先审批医疗器械产品。国家药品监督管理局局长焦红介绍,今年以来,通过持续深化药品医疗器械审评审批制度改革,境外新药上市明
新华社 - 药品,审批,创新 - 2018-07-06
FDA优先评审再生元和赛诺菲特应性皮炎药物dupilumab
再生元($REGN)和赛诺菲($SNY)对他们治疗特应性皮炎的潜在重磅药物dupilumab使用了优先评审券。自从再生元和赛诺菲发布令人印象深刻的III期临床数据,并获得突破疗法认定之后,IL-4和IL-13抗体抑制剂的优先评审资格证实了之前的怀疑。
新浪医药新闻 - 特应性皮炎 - 2016-09-28
药品评审中心(CDE)已受理Pamiparib治疗卵巢癌的新药申请
生物技术公司百济神州今日宣布,中国药品监督管理局(NMPA)的药品评审中心(CDE)已接受百济神州PARP1和PARP2研究性抑制剂Pamiparib的新药申请(NDA)。
MedSci原创 - 卵巢癌,PARP1,Pamiparib - 2020-07-18
葛均波:建议加快创新药械审评审批 | 两会谈医学创新
“在关注医学创新的过程中,我曾被两位科学家的遭遇深深触动,一是浙江大学原副校长褚健,一是清华大学教授付林。”3月6日,全国政协委员、中国科学院院士、中国医学创新联盟CMIA总发起人、博鳌医学创新研究院院长、复旦大学附属中山医院心内科主任葛均波在接受媒体采访时说,“没有法律法规做保障,创新是搞不起来的。”葛均波一直以来都是国内医学创新的推动者和践行者。作为全国政协委员,今年两会期间,葛均波多次从不同
健康界 - 药械审评 - 2018-03-07
美国FDA批准首个干眼症新药
Shire公司宣布美国FDA已经批准其新药Xiidra滴眼剂溶液(5%浓度的lifitegrast眼用溶液)上市,每日使用两次,治疗成人干眼症患者。
生物谷 - FDA,干眼症,新药 - 2016-07-13
科技日报:现在新药审评审批提速了,进医保进医院难怎么破
“国家鼓励创新,创新药更需要政策的扶持。”10月16日,浙江贝达药业有限公司董事长丁列明在接受科技日报记者采访时说。众所周知,新药研发有“两高一长”之说:高投入、高风险、长周期。一款新药从开始研发到获批上市,需要经过10到15年的时间,花费至少要10亿美元。“新药研发非常不容易,而获批上市后进入临床应用的路仍很长。”丁列明说,药品集中招标采购、进医院难、药占比考核等都成为横亘在我国新药研发企
科技日报 - 科技日报,新药审批,医保 - 2018-10-17
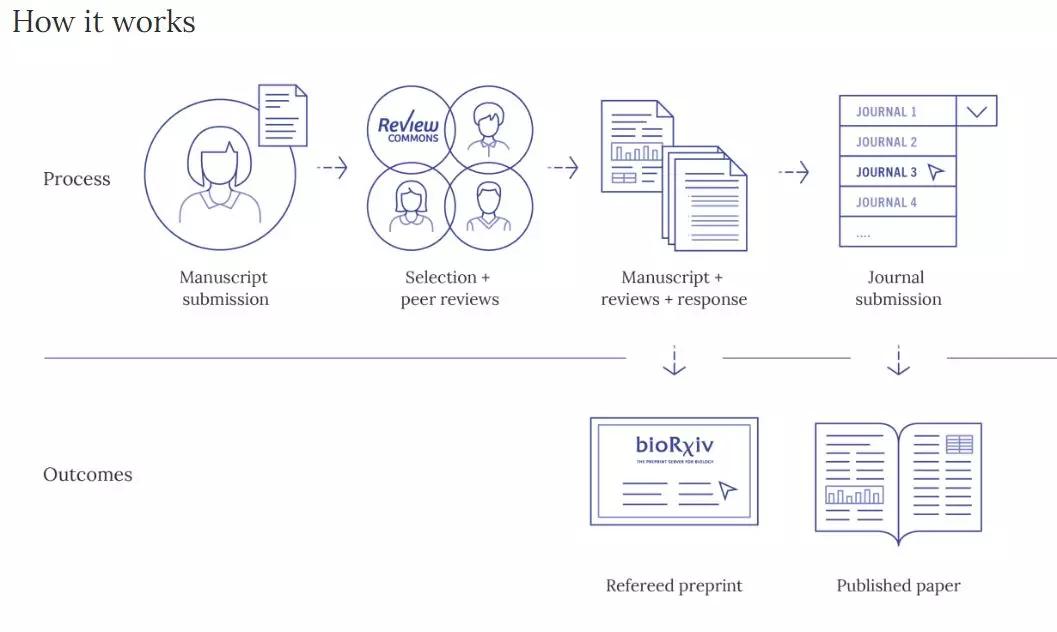
Review Commons:先于期刊同行评审之前的评审
ASAPbio和 EMBO Press于2019年12月9日推出了 Review Commons,这是一个高质量,独立于期刊的,用于对生命科学领域稿件进行同行评审,然后再提交给期刊同行评审平台。作者可以将预印本或未出版的手稿提交给Review Commons进行专家级同行评审。最终的 “ Refered Preprint”(包含稿件,审稿人报告以及作者回复审稿人意见)
网络 - 同行评审,评审 - 2020-02-13
FDA接受阿斯利康naloxegol新药申请
阿斯利康(AstraZeneca)11月19日宣布,FDA已接受naloxegol新药申请(NDA),该药是一种实验性外周作用(peripherally-acting)μ-阿片受体拮抗剂,专门开发用于治疗阿片类药物引发的便秘
生物谷 - 新药,FDA - 2013-11-20
FDA:安斯泰来新药获美国FDA批准
这款名为他克莫司的处方新药需要配合其他药物一起服用,适合于肾移植患者。公司首席科学官西夫·克斯坦恩表示说,每个患者使用的药剂都是不同,需要区别对待。
大智慧 - FDA,新药 - 2013-07-23
FDA批准治疗热带疾病新药
FDA日前批准Impavido(米替福斯)治疗热带病利什曼病(leishmaniasis),该病是苍蝇叮咬引起,由寄生虫传染给人类。Impavido获得FDA快速审批,优先审查和罕用药资格认定。
医药经济报 - 新药,FDA - 2014-04-04
评审专家:国家自然基金上会评审若干情况介绍
这些天网上有不少老师就国家自然基金的各种情况作了介绍,也有不少朋友晒了自己的基金评语,可是还没有一个参加会评(自然基金会议评审)的朋友介绍有关情况,为 了减少疑问,我作为今年的上会评审专家介绍一些有关基金最后阶段评审的一些情况
科学网 - 国家自然基金,上会,评审 - 2015-09-14
为您找到相关结果约500个