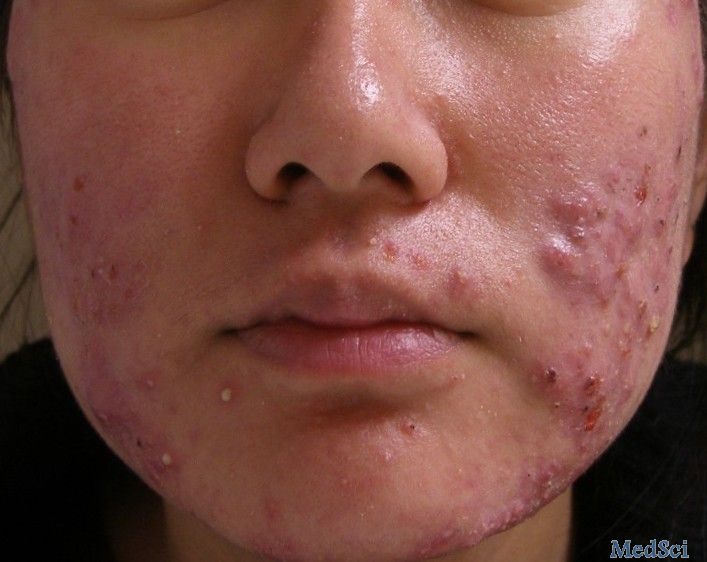
Dermira将终止olumacostat glasaretil的研发
Dermira近日表示,在实验性药物不能满足中度至重度痤疮患者的两项III期临床研究的共同主要终点后,可能会停止olumacostat glasaretil的开发。
MedSci原创 - olumacostat,glasaretil,痤疮,ACC - 2018-03-06
FDA批准Dermira的Qbrexza治疗原发性腋窝多汗症
Dermira本周五宣布,FDA批准了Qbrexza(glycopyrronium)用于局部治疗9岁及以上成人和儿童患者的原发性腋窝多汗症。该公司指出,该产品预计将于10月开始供货。
MedSci原创 - 原发性腋窝多汗症,Qbrexza,FDA - 2018-06-30
礼来宣布以11亿美元收购Dermira,同时获得中度至重度特应性皮炎III期IL-13单抗lebrikizumab
礼来制药公司已宣布计划以每股18.75美元的现金,总价约11亿美元的价格收购Dermira,以扩大其免疫学管线。
MedSci原创m - 礼来,11亿美元收购,Dermira,中度至重度特应性皮炎,lebrikizumab - 2020-01-16
lebrikizumab获得FDA快速通道资格用以治疗特应性皮炎
Dermira制药公司近日宣布,FDA已经授予lebrikizumab快速通道资格,用于治疗中度至重度特应性皮炎患者。Dermira首席执行官Tom Wiggans表示:“如果在进行中的III期研究中证实了II期研究的结果,那么这种快速通道资格将加快lebrikizumab的上市”。
MedSci原创 - FDA,lebrikizumab,特应性皮炎 - 2019-12-11
AAD 2020:Lebrikizumab治疗特应性皮炎,患者生活质量得以显著改善
礼来公司和其全资子公司Dermira宣布,将在2020年美国皮肤病学会(AAD)虚拟会议上介绍lebrikizumab治疗中度至重度特应性皮炎IIb期临床试验的最新数据。
MedSci原创 - 特应性皮炎,lebrikizumab - 2020-06-13
2020年生物医药领域发展趋势预测
2019年,FDA共批准48款创新药,多款first-in-class疗法争相获批,生物类似药快速发展。2019年,医药行业投资热度持续,两起大宗医药并购占据了全年并购金额的2/3,各项技术相继走向成熟,小型药企的临床试验呈现积极结果。步入2020年,生物医药行业将会如何发展,以下五点值得关注。
CPhI制药在线 - 生物医药,发展趋势 - 2020-01-16
为您找到相关结果约6个