Takeda的Alunbrig在ALK阳性NSCLC的PFS击败了辉瑞公司的Xalkori
武田的Alunbrig在一项III期试验中击败了辉瑞公司的Xalkori无进展生存期(PFS),该试验测试了其作为ALK阳性肺癌一线治疗的功效。患者每天服用一次Alunbrig (brigatinib) 180毫克(每天服用90毫克,7天一个疗程)或每天两次服用Xalk
MedSci原创 - Alunbrig,Xalkori - 2018-07-26
NICE推荐布加替尼Alunbrig用于治疗非小细胞肺癌
英国国家健康与护理研究所(NICE)推荐使用Alunbrig(布加替尼)治疗Xalkori(克唑替尼)作用后ALK阳性的晚期非小细胞肺癌NSCLC患者。
MedSci原创 - 布加替尼,非小细胞肺癌,酪氨酸激酶抑制剂 - 2019-02-18
ALUNBRIG(brigatinib)治疗ALK阳性NSCLC的中长期数据:两年随访展现的优势
武田制药公司近日宣布了来自III期ALTA-1L试验的更新数据,该试验评估了ALUNBRIG与crizotinib在成年ALK阳性非小细胞肺癌(NSCLC)患者中的有效性,这些患者之前未接受过ALK抑制剂治疗
MedSci原创 - NSCLC,Brigatinib,Alunbrig - 2019-11-25
欧盟委员会批准ALUNBRIG(brigatinib)治疗ALK+非小细胞肺癌
武田制药近日宣布,欧盟委员会已经批准ALUNBRIG(brigatinib)上市,单药治疗先前经克唑替尼治疗的成人间变性淋巴瘤激酶阳性(ALK+)的晚期非小细胞肺癌患者(NSCLC)。
MedSci原创 - Brigatinib,ALK,非小细胞肺癌 - 2018-11-28
欧盟批准武田的TKI抑制剂ALUNBRIG,用作ALK阳性非小细胞肺癌患者的一线治疗药物
ALUNBRIG目前已在包括美国、加拿大和欧盟在内的40多个国家/地区获得批准,用于克唑替尼治疗后疾病进展的ALK阳性转移性非小细胞肺癌患者。
MedSci原创 - ALk阳性非小细胞肺癌,ALUNBRIG(brigatinib),酪氨酸激酶抑制剂(TKI) - 2020-04-07
FDA批准武田的酪氨酸激酶抑制剂ALUNBRIG(brigatinib),一线治疗ALK阳性的转移性非小细胞肺癌患者
结果表明ALUNBRIG优于克唑替尼,具有显着的抗肿瘤活性,尤其是在脑转移患者中。
MedSci原创 - 非小细胞肺癌,酪氨酸激酶抑制剂ALUNBRIG - 2020-05-23
武田制药宣布FDA接受其补充新药申请并给予优先审查,将酪氨酸激酶抑制剂ALUNBRIG用作ALK +转移性非小细胞肺癌的一线治疗
武田制药有限公司宣布,美国食品药品监督管理局(FDA)已对该公司的补充新药申请(sNDA)给予优先审查,以扩大其ALUNBRIG(brigatinib)的适应症,用作经FDA批准的检测方法检测的间变性淋巴瘤激酶阳性
MedSci原创 - 武田制药,补充新药申请,优先审查,酪氨酸激酶抑制剂,Alunbrig,ALK,转移性非小细胞肺癌 - 2020-02-25
武田2020财年业绩保持韧性,利润率和现金流均表现强劲;基础营收增长预计在2021财年加速
武田有五大关键业务领域,包括肠胃病、罕见病、血浆疗法、肿瘤和神经科学,其列报收入为26,237亿日元,约占2020财年总收入的82%,基础营收同比增长4.7%。
网络 - 药品工业 - 2021-05-18
2017年FDA批准的41个新药
截止目前,CDER已经批准了41个新分子实体,还有2个药物的PDUFA最后期限落在12月,如12月间FDA不加速批准新药,那么2017年获批的新分子实体可能是41-43个。当然本文所涉及的新药,均为 CDER 受理的 NDA 或 BLA,并不包括CBER审评的品种,如 CAR-T 产品。相对去年的20来个,今年算是一个丰收年。已经获批的41个产品中,有31个是全球首次批准,19个产品获得了优先
科睿唯安生命科学与制药 - FDA,新药 - 2017-12-06
2017上半年FDA批准的新药
2017上半年FDA共批准23个新药,包括16个新分子实体和7个新生物制品。这个数字已经超过2016年全年批准的新药数量总和。近20年来批准新药数量最多的年份是2015年的45个,上半年批准了14个新药。如果按此趋势持续下去,2017年批准的新药数量将创下历史新高。
新浪医药 - FDA,新药 - 2017-06-28
2017年FDA批准新药名单,上半年已达21种!
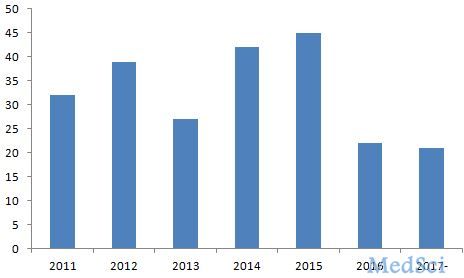
据FDA官网(http://www.fda.org)2017年5月22日提供的最新公布结果,截止2017年5月22日,FDA已经批准了21种新药,约占2016年FDA批准新药数量(22种)的95%,去年创造新药新低,今 年有望获得重大突破,甚至能创造近年来审批新药的新高。2011-2017年5月5日FDA批准新药数量变化见图1所示。 图1 FDA2011-2017年批准新药数量变
诸平 - FDA,新药 - 2017-05-25
为您找到相关结果约12个