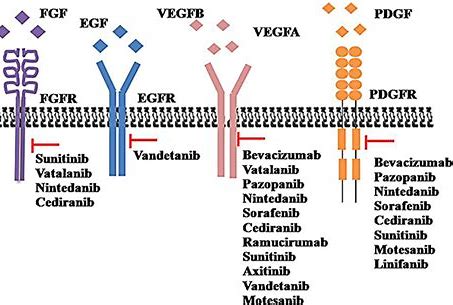
NMPA批准BYVASDA(贝伐单抗生物仿制药)治疗复发性胶质母细胞瘤
BYVASDA®(贝伐单抗生物仿制药)已获得中国国家药品监督管理局(NMPA)的正式批准,用于治疗复发性胶质母细胞瘤(GBM,最常见的恶性原发性脑肿瘤)。
MedSci原创 - 复发性胶质母细胞瘤,贝伐单抗生物仿制药,BYVASDA - 2020-12-31
2019 ASCO:信达生物发布其贝伐单抗生物仿制药IBI305的安全性数据
在美国2019年ASCO会议上,信达生物宣布其贝伐单抗生物仿制药IBI305与贝伐单抗相比,在晚期非鳞状NSCLC患者(NCT02954172)中的安全性数据。
MedSci原创 - 2019,ASCO,信达生物,贝伐单抗,生物仿制药,IBI305,安全性数据 - 2019-06-03
Lancet oncol:Sintilimab联合贝伐单抗生物仿制药治疗不能切除的肝癌的预后明显优于索拉非尼!
信迪利单抗联合IBI305作为一线治疗方案用于不可手术切除的HBV相关肝癌患者,可提供优于索拉非尼治疗的总生存期和无进展生存期
MedSci原创 - 肝细胞癌,索拉非尼,IBI305,抗PD-L1单抗TYVYT(Sintilimab),贝伐单抗生物仿制药 - 2021-06-16
中国生物仿制药出海:曲妥珠单抗生物仿制药HLX02获CHMP正面评价
上海复宏汉霖和Accord医疗保健有限公司共同宣布,欧洲药品管理局(EMA)的人用药品委员会(CHMP)对曲妥珠单抗生物仿制药HLX02持积极意见。
MedSci原创 - 曲妥珠单抗生物仿制药,HLX02 - 2020-06-02
NMPA批准中国首个曲妥珠单抗生物仿制药
曲妥珠单抗生物仿制药HLX02成为首个在欧洲获批的“中国籍”单抗生物仿制药。
MedSci原创 - 乳腺癌,胃癌,复宏汉霖,曲妥珠单抗生物仿制药HLX02 - 2020-08-20
国内首个贝伐珠单抗生物类似药获批上市
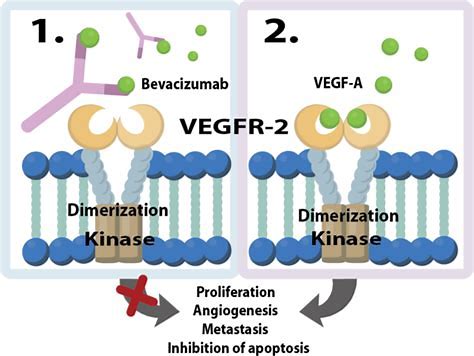
近日,国家药品监督管理局批准齐鲁制药有限公司研制的贝伐珠单抗注射液(商品名:安可达)上市注册申请。该药是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。 贝伐珠单抗是利用重组DNA技术制备的一种人源化单克隆抗体IgG1,通过与人血管内皮生长因子(VEGF)结合,抑制VEGF与其受体结合,阻断血管生成的信号传导途径,抑制肿瘤细胞生长。
国家药监局网站 - 贝伐珠单,生物类似药,上市 - 2019-12-09
信达生物贝伐珠单抗生物类似药——达攸同上市
抗肿瘤药物达攸同®获得中国国家药品监督管理局(NMPA)的批准,适应症为晚期非鳞非小细胞肺癌和转移性结直肠癌。
MedSci原创 - 达攸同 - 2020-06-20
我国首个贝伐珠单抗生物类似物获批,安可达®上市
12月9日,齐鲁制药有限公司研制的贝伐珠单抗注射液(商品名:安可达®)上市注册申请获得国家药品监督管理局批准。
医药经济报 - 贝伐珠单抗生物类似物 - 2019-12-12
FDA批准美国市场首个阿达木单抗生物仿制药Amjevita
美国生物技术巨头安进(Amgen)生物仿制药管线近日在美国监管方面迎来重大喜讯。美国食品和药物管理局(FDA)已批准生物仿制药Amjevita(adalimumab-atto,阿达木单抗)用于艾伯维品牌药Humira(修美乐,通用名:adalimumab,阿达木单抗)全部的适应症。此次批准,使Amjevita成为美国市场首个Humira生物仿制药,将用于全部7种炎症性疾病的治疗,包括:中度
生物谷 - 安进,生物仿制药,Amjevita,阿达木单抗 - 2016-09-27
三星Bioepis旗下贝伐单抗生物类似物AYBINTIO获CHMP正面评价
韩国三星Bioepis公司近日宣布,欧洲药品管理局(EMA)的人用药品委员会(CHMP)对AYBINTIO持肯定态度,该药品是贝伐单抗的生物类似物。
MedSci原创 - 贝伐单抗,生物类似物,AYBINTIO - 2020-06-28
欧洲药品管理局(EMA)接受曲妥珠单抗生物仿制药营销授权申请
欧洲药品管理局(EMA)已接受Prestige BioPharma公司的曲妥珠单抗生物仿制药Tuznue(HD201)的营销授权申请(MAA)。
MedSci原创 - 欧洲药品管理局,曲妥珠单抗,生物仿制药,营销授权申请 - 2019-06-01
Lancet Gastroen Hepatol:贝伐单抗生物类似物BEVZ92用于转移性结肠癌一线治疗
研究认为BEVZ92与贝伐单抗生物及临床疗效等效,可联合化疗作为一线转移性结肠癌治疗手段
MedSci原创 - 贝伐单抗,结肠癌,BEVZ92 - 2018-09-25
Angiogenesis:可预测贝伐单抗诱发高血压风险的血浆生物标志物
血管生成素-2、VEGF-A和VCAM-1水平降低与贝伐单抗诱导性高血压风险升高相关
MedSci原创 - 高血压,贝伐单抗,生物标志物,血管生成素-2 - 2021-05-30
生物仿制药ABP 980与曲妥珠单抗具有可比性
一项随机3期研究的数据表明,与曲妥珠单抗相比,ABP 980对HER-2阳性早期乳腺癌患者的治疗是有效的生物仿制药。这项多中心、双盲、对照研究纳入了725名HER-2阳性早期乳腺癌女性,随机分配364人进行ABP 980 (Amgen/Allergan)治疗,361人进行曲妥珠单抗(Herceptin,Genentech
MedSci原创 - 曲妥珠单抗,ABP,980,乳腺癌 - 2016-07-22
辉瑞阿达木单抗生物仿制药PF-06410293在III期临床获得成功
美国制药巨头辉瑞(Pfizer)近日宣布该公司开发的一款生物类似药PF-06410293(adalimumab,阿达木单抗)在III期临床研究(REFLECTIONS B538-02)达到了主要终点。PF-06410293是一种单克隆抗体药物,正开发作为艾伯维重磅抗炎药修美乐(Humira,通用名:adalimumab,阿达木单抗)的生物类似药。目前,辉瑞的生物类似药管线中共有8个独特的分子处于
生物谷 - 生物仿制药 - 2017-01-09
为您找到相关结果约500个