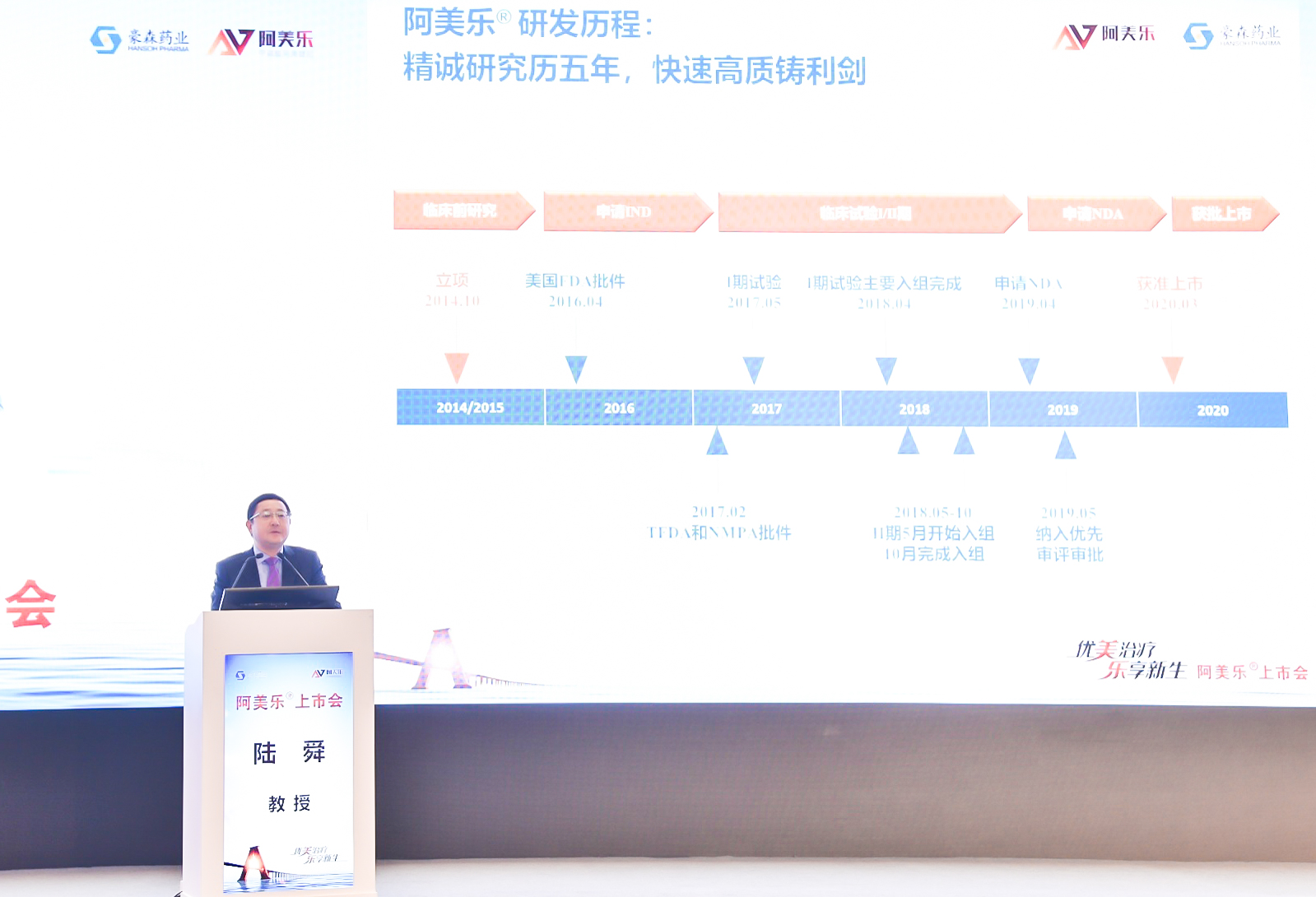
FDA“创新行动计划”促进药品研发与审评
FDA的官方博客-FDA Voice上发表了题为“ How FDA Plans to Help Consumers Capitalize on Advances in Science”的文章,旨在推行“创新行动计划
CDE网站;凡默谷 - FDA,药品研发,药品评审 - 2017-09-08
葛均波:建议加快创新药械审评审批 | 两会谈医学创新
“在关注医学创新的过程中,我曾被两位科学家的遭遇深深触动,一是浙江大学原副校长褚健,一是清华大学教授付林。”3月6日,全国政协委员、中国科学院院士、中国医学创新联盟CMIA总发起人、博鳌医学创新研究院院长、复旦大学附属中山医院心内科主任葛均波在接受媒体采访时说,“没有法律法规做保障,创新是搞不起来的。”葛均波一直以来都是国内医学创新的推动者和践行者。作为全国政协委员,今年两会期间,葛均波多次从不同
健康界 - 药械审评 - 2018-03-07
药谈 | 药监局审评专家:中国创新药审批率,不如非洲
中国新药的“致命伤”:“近五年来,美国批准的‘新药’,在中国的批准率只有10.4%,‘甚至非洲有的国家创新药都发展得比我们快’。”
健康点 - 药监局,创新药审批率 - 2017-07-05
中国药品审评审批用时进一步压缩,创新药物审评审批再提速
记者6日从全国药品监管工作座谈会上获悉,我国药品审评审批用时进一步压缩,待审评的药品注册申请已由2015年高峰时的2.2万件降至3200件以内。创新药物和医疗器械审评审批进一步加快,截至今年6月底,共对29批597件药品注册申请进行优先审评审批,审核批准了39个创新医疗器械和4个优先审批医疗器械产品。国家药品监督管理局局长焦红介绍,今年以来,通过持续深化药品医疗器械审评审批制度改革,境外新药上市明
新华社 - 药品,审批,创新 - 2018-07-06
去年我国审评通过新药106个 其中1类创新药均为我国自主创新
记者昨天从国家药监局发布的“2018年度药品审评报告”获悉,去年国家药监局药审中心审评通过的新药有106个,包含关黄母颗粒、金蓉颗粒2个新中药复方制剂,以及9个1类创新药和67个进口原研药等。值得关注的是,其中的1类创新药全部为我国自主创新药品且以抗癌药居多,分别是呋喹替尼胶囊、罗沙司他胶囊、马来酸吡咯替尼片、盐酸安罗替尼胶囊、达诺瑞韦钠片、注射用艾博韦泰6个化学新分子实体药物,特瑞普利单抗注射液
北京日报 - 审评,新药,创新药 - 2019-07-03
药审中心加快创新药上市许可申请审评工作规范(试行)
为进一步鼓励创新,药审中心组织制定了《药审中心加快创新药上市许可申请审评工作规范(试行)》,经国家药品监督管理局审核同意,现予发布,自发布之日起实施。
国家药品监督管理局药品审评中心 - 创新药物 - 2023-07-10
不受制NMPA加速创新审评,药审、械审大湾区分中心挂牌成立
国家药品监督管理局(NMPA)药品审评检查大湾区分中心、医疗器械技术审评检查大湾区分中心正式挂牌。
亿欧 - NMPA,创新审评,挂牌成立 - 2021-01-11
百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评
2021年2月4日,百时美施贵宝中国宣布,其红细胞成熟剂Luspatercept(英文商品名Reblozyl;自拟中文通用名:注射用罗特西普;自拟中文商品名:利布洛泽)的上市申请已获CDE正式受理。
MedSci - 血液病,luspatercept - 2021-02-04
《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,附梅斯医学解读
近日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,并发出通知,要求各地区各部门结合实际认真贯彻落实。
新华网 - 国务院,创新,医生 - 2017-10-08
2020年度药品审评报告
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法
CDE - 药品审评报告 - 2021-06-23
药品医疗器械审评审批制度意见:经典名方类中药,按照简化标准审评审批
近日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,并发出通知,要求各地区各部门结合实际认真贯彻落实。其中第十三条提出支持中药传承和创新。建立完善符合中药特点的注册管理制度和技术评价体系,经典名方类中药,按照简化标准审评审批。
中国中医 - 药品医疗器械审评审批,经典名方类中药,简化 - 2017-10-16
纳入优先审评!恒瑞医药创新药吡咯替尼新适应症——新辅助治疗
近日,恒瑞医药创新药马来酸吡咯替尼片联合曲妥珠单抗加多西他赛用于表皮生长因子受体 2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗的注册申请获国家药品监督管理局受理,被国家药品监督管理局药品审评
恒瑞医药 - 吡咯替尼 - 2021-09-26
FDA审评员揭秘“FDA如何”
如何雇用审评员?如何使用审评经费?就这些运行机制问题,南方周末记者采访了思路迪医药科技公司CEO龚兆龙。他曾于1998-2008年在美国FDA药品审批中心内分泌和代谢药品审评处工作十余年,负责糖尿病,减肥和降血脂药等新药审评。 南方周末:FDA
南方周末 - 审评药品 - 2014-11-17
为您找到相关结果约500个