FDA批准四价脑膜炎球菌疫苗MenQuadfi的生物制剂许可
近日,美国食品药品监督管理局(FDA)已批准四价脑膜炎球菌疫苗MenQuadfi的生物制剂许可,用于预防2岁及以上人群的侵袭性脑膜炎。
MedSci原创 - 脑膜炎球菌疫苗,MenQuadfi - 2020-04-26
Evinacumab治疗纯合型家族性高胆固醇血症(HoFH):美国FDA已接受生物许可申请(BLA)
Evinacumab是一种研究性的全人源单克隆抗体,可结合并阻断血管生成素样3(ANGPTL3)。
MedSci原创 - 高胆固醇血症,家族性高胆固醇血症,Evinacumab - 2020-08-13
武田候选登革热疫苗(TAK-003)生物制品许可申请(BLA)获得美国食品药品管理局优先审查
武田正在4岁至60岁人群中评估TAK-003对任一登革热病毒血清型引起的登革热病的预防效果
网络 - 武田,登革热疫苗, 美国食品药品管理局 - 2022-11-24
FDA 指南:新药和生物制品的获益-风险评估
本指南首先阐明了药物评价与研究中心(CDER)和生物制品评价与研究中心(CBER)获益-风险评估的重要考虑因素,包括如何使用患者经验数据来告知获益-风险评估。
FDA官网 - 风险评估,生物制品 - 2023-10-19
通用型皮肤组织StrataGraft:BLA申请已经成功递交给FDA
StrataGraft是一种再生性皮肤组织,正在开发用于减少严重热灼伤患者的自体移植。
MedSci原创 - 通用型皮肤组织StrataGraft,生物制剂许可证申请(BLA) - 2020-06-10
强生向FDA提交申请寻求批准其抗CD38单抗DARZALEX皮下制剂治疗多发性骨髓瘤
强生制药公司今天宣布向美国食品和药物管理局(FDA)提交生物制剂许可证申请(BLA),寻求批准其DARZALEX(daratumumab)皮下制剂,用于治疗多发性骨髓瘤患者。
MedSci原创 - CD38单抗,Darzalex,皮下制剂,多发性骨髓瘤 - 2019-07-14
美国FDA批准辉瑞/BioNTech新冠疫苗用于12-15岁青少年
当地时间5月10日,美国FDA扩大了辉瑞新冠疫苗的紧急使用授权范围,将包括12至15岁的青少年人群。
MedSci原创 - 辉瑞/BioNTech - 2021-05-11
FDA接受Sacituzumab Govitecan治疗转移性三阴性乳腺癌的BLA
抗体药物偶联物领域领先的生物制药公司Immunomedics近日宣布,美国FDA已接受其Sacituzumab Govitecan治疗转移性三阴性乳腺癌(mTNBC)的生物制剂许可证申请(BLA)。
MedSci原创 - FDA,Sacituzumab,Govitecan,转移性三阴性乳腺癌 - 2019-12-27
科济生物CAR-T细胞疗法治疗复发或难治性多发性骨髓瘤,被FDA授予再生医学先进疗法称号
美国食品和药物管理局(FDA)已为科济生物医药CARsgen公司的CT053 CAR-T细胞疗法授予再生医学先进疗法(RMAT)称号。
MedSci原创 - 科济生物,Car-T细胞疗法,复发或难治性多发性骨髓瘤,FDA,再生医学先进疗法 - 2019-11-03
FDA 指导文件:人类细胞和基因治疗产品的制造变化和可比性
本指南的目的是为FDA提供当前的思路:1)根据生命周期方法管理和报告cct产品的制造变化,2)进行可比性研究,以评估制造变化对产品质量的影响。
FDA官网 - 基因治疗,人类细胞 - 2023-07-25
FDA 指南:人体处方药和生物制品--根据重量或可使用容器的体表面积对剂量进行标记--"剂量带"
本指南中的建议和例子与以下情况有关:申请人(1)提议为可注射药物产品开发具有各种不同长处的现成容器,以及(2)试图将剂量段幅信息纳入根据先前核准的药物产品的剂量信息而根据重量或BSA提供的处方信息。
FDA官网 - 生物制品,人体处方药 - 2023-10-08
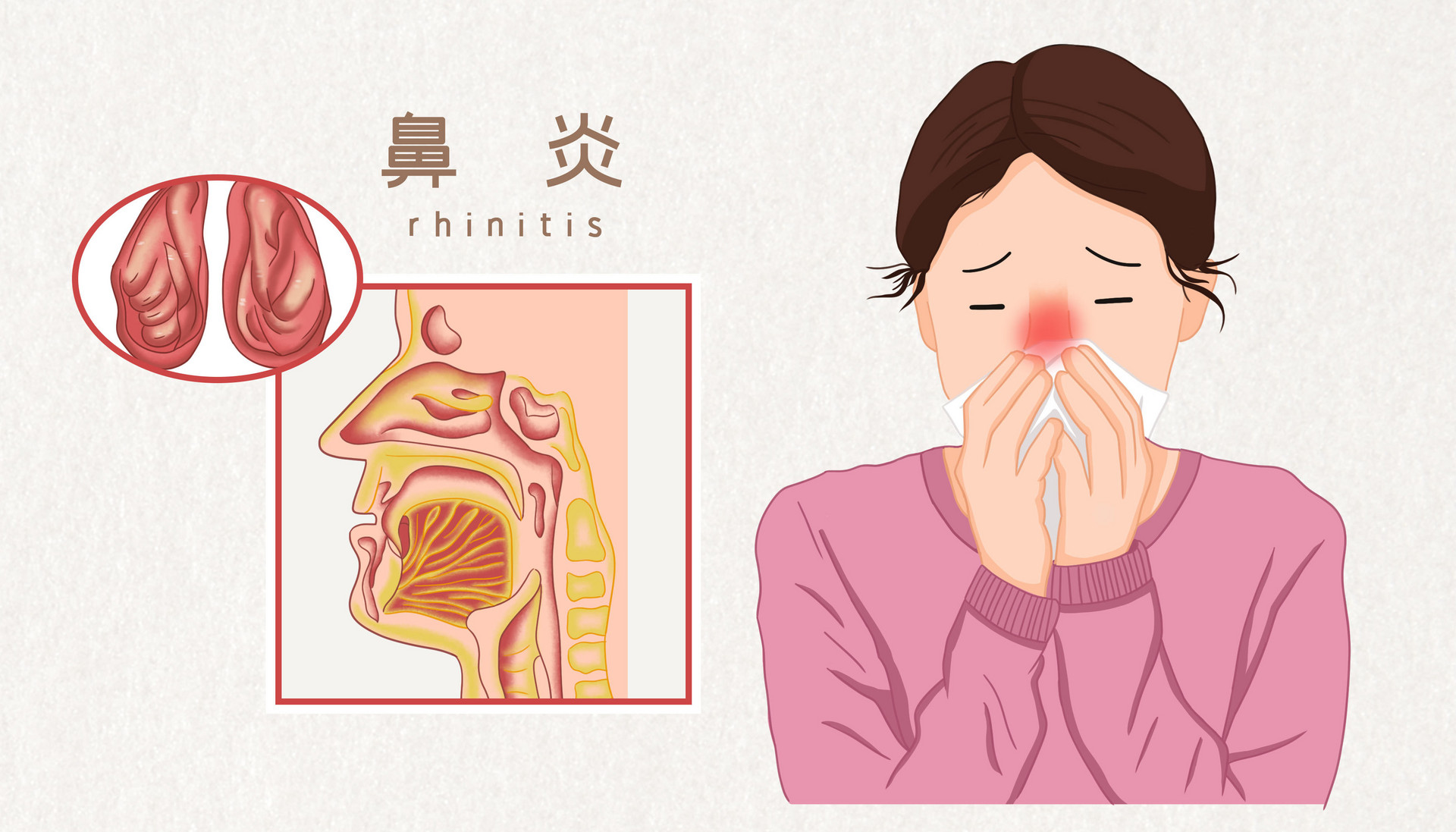
FDA指南:非过敏性鼻炎治疗药物的研发【中文版】
本指南旨在研发治疗儿童和成人非过敏性鼻炎(NAR)治疗药物过程中,在新药申请上市及生物制剂许可证申请方面支持申办方。指南讨论内容包括研发过程中临床表现,试验设计,有效性,药物安全性的定义。
美国食品药品监督管理局(FDA) - 非过敏性鼻炎 - 2024-01-05
CTX001获得FDA快速通道资格用于治疗镰状细胞病
CRISPR治疗公司和Vertex制药公司近日宣布,美国食品和药品管理局(FDA)已授予CTX001快速通道资格用于治疗镰状细胞病(SCD)。CTX001是针对患有严重血红蛋白病患者的研究性、自体性、CRISPR基因编辑的造血干细胞疗法。
MedSci原创 - CTX001,镰状细胞病,地中海贫血,CRISPR - 2019-01-10
FDA指南:非过敏性鼻炎治疗药物的研发【英文版】
本指南旨在研发治疗儿童和成人非过敏性鼻炎(NAR)治疗药物过程中,在新药申请上市及生物制剂许可证申请方面支持申办方。指南讨论内容包括研发过程中临床表现,试验设计,有效性,药物安全性的定义。
美国食品药品监督管理局(FDA) - 非过敏性鼻炎 - 2024-01-05
FDA指导原则:批准非小细胞肺癌药物和生物制剂的临床试验终点
本指南的目的是就提交给食品和药物管理局 (FDA) 的药物的非小细胞肺癌 (NSCLC) 临床试验终点向申请人提供建议,以支持新药申请 (NDA)、生物制剂中的有效性声明 许可证申请 (BLA) 或补
FDA - 非小细胞肺癌 - 2021-10-22
为您找到相关结果约500个