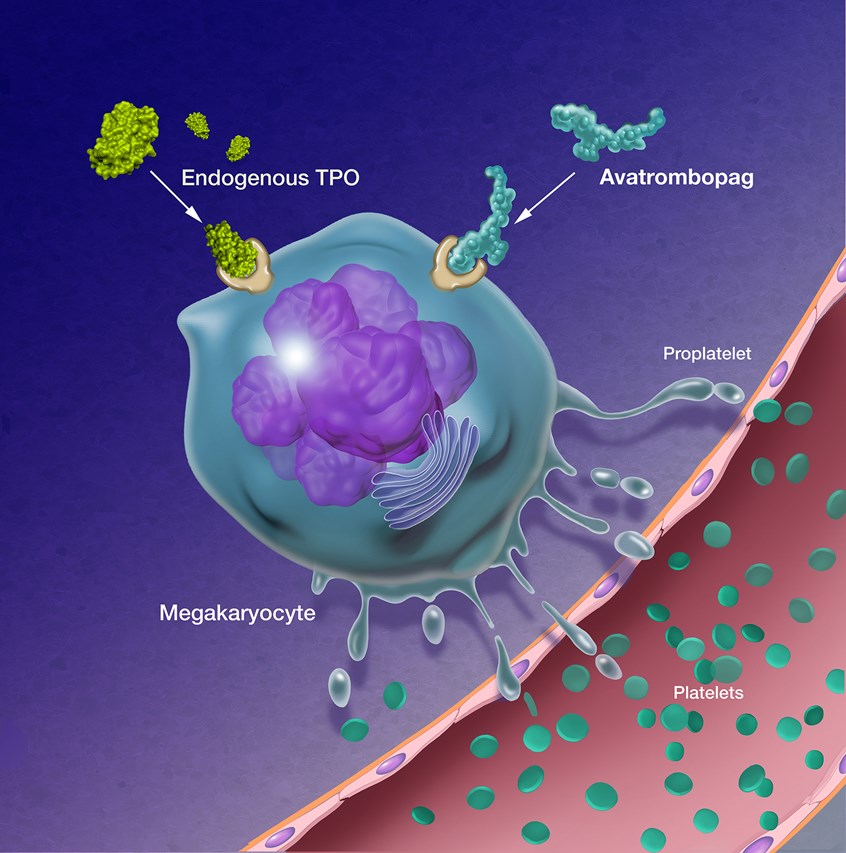
欧盟批准血小板减少症药物Doptelet
Doptelet通过模拟血小板生成素刺激巨核细胞发育和成熟,增加血小板数量。
MedSci原创 - 血小板减少症,血小板生成素受体激动剂,Doptelet(avatrombopag) - 2020-11-06
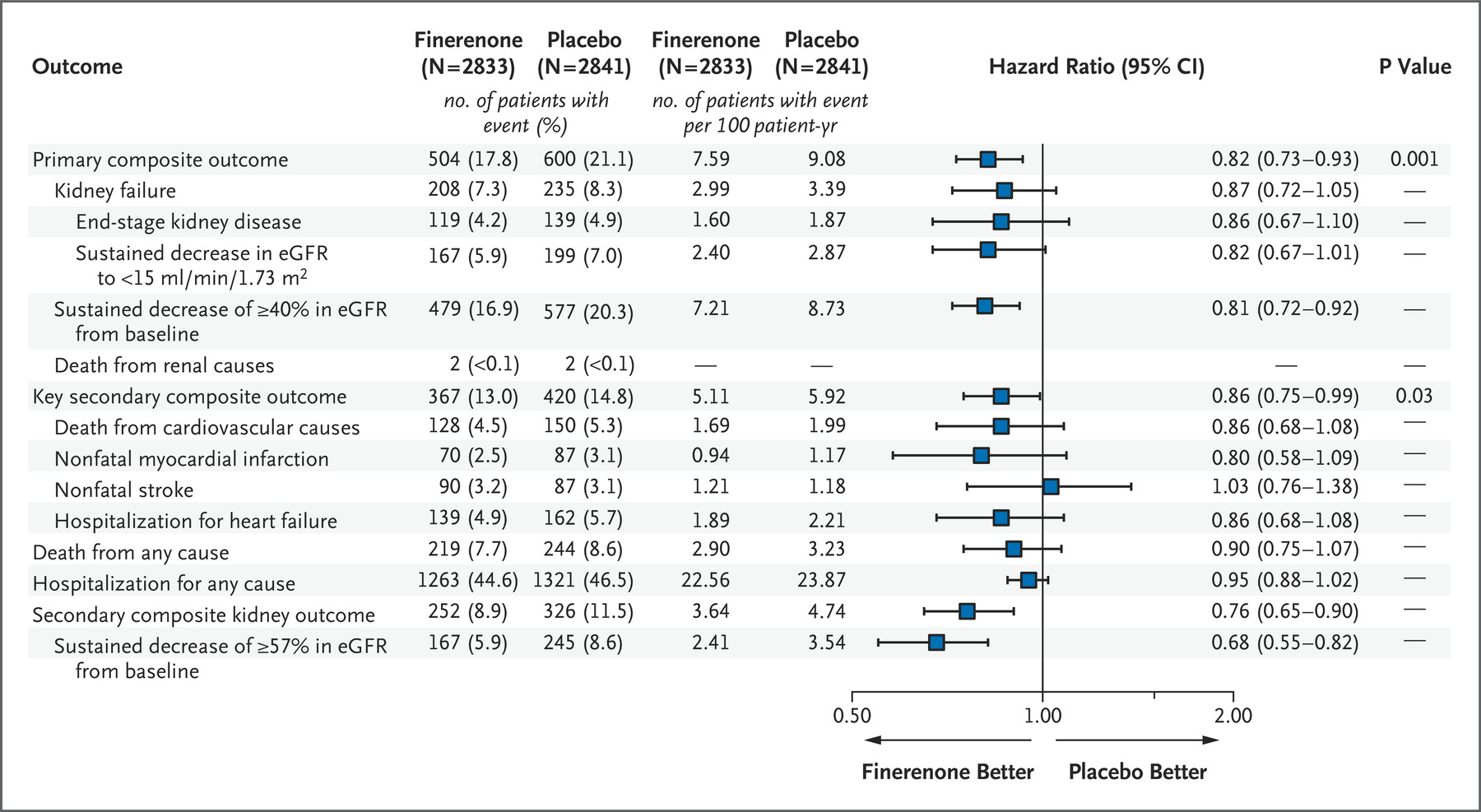
拜耳CKD药物Kerendia获得欧盟批准
拜耳近日宣布,欧盟监管机构已批准 Kerendia (finerenone) 用于治疗患有与 2 型糖尿病相关的慢性肾病(CKD)的成年患者。
MedSci原创 - 慢性肾病,慢性肾病患者,2 型糖尿病,Kerendia - 2022-02-28
欧盟批准Fintepla治疗Dravet综合征
Dravet综合征是一种罕见的儿童遗传性癫痫综合征,其特征是从婴儿期开始出现的难治性癫痫以及神经发育问题。70%-80%的DS患者检测出电压门控钠离子通道α-1亚基基因(SCN1A)突变。
MedSci原创 - 欧盟,SCN1A,Dravet综合征,Zogenix,Fintepla - 2020-12-29
欧盟出台限制基因测试新政策
最近,欧盟出台限制基因测试新政策。这可能缩小了基因测试的应用场景。 医学研究者们并不支持这一限制。一些研究人员聚集在一起并表达了他们的意见。
生物谷 - 体外诊断 - 2016-03-02
吉利德丙肝新药Sovaldi获欧盟批准
吉利德(Gilead)宣布,丙肝新药Sovaldi(sofosbuvir,400mg片剂)获欧盟批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)成人感染者的治疗。Sovaldi为每日一次的口服核苷类似物聚合酶抑制剂,此次批准,为该药在整个欧盟的上市铺平了道路。
生物谷 - 新药,FDA - 2014-01-20
Orexigen口服减肥药Mysimba获欧盟批准
Orexigen公司口服减肥药Mysimba(纳曲酮/安非他酮缓释片)近日在欧盟实现重大监管里程碑,该药获欧盟批准作为一种辅助药物,结合低热量饮食和运动,用于肥胖成人患者的体重管理。但相比美国市场,欧盟市场对Mysimba更为重要,原因有二:竞争少,拥有完全商
生物谷 - 口服减肥药,Orexigen - 2015-03-31
论欧盟基因专利的保护范围及启示
经过近三十年的实践,美国、欧盟等一些发达国家与地区陆续通过司法判例逐步调整,或者说进一步明确其有关生物技术的专利保护政策。
生物知识产权 - 基因专利,专利保护 - 2017-01-04
欧盟批准AZ的Fasenra治疗严重哮喘
阿斯利康(AstraZeneca)的biologic Fasenra在欧洲被批准用于治疗严重嗜酸粒细胞性哮喘。具体而言,尽管高剂量吸入皮质类固醇加长效β受体激动剂,但该药物的标签允许其在成人中的使用得到充分控制。阿斯利康说,Fasenra(benralizumab)是第一个获得批准的呼吸类生物制剂,它是一种招募自然杀伤细胞以消耗嗜酸性粒细胞的单克隆抗体,在体内维持药效的时间长达八周。批准是基于WI
MedSci原创 - Fasenra,严重哮喘 - 2018-01-11
清华脑起搏器获欧盟CE认证
科学网 www.sciencenet.c - 脑起搏器 - 2016-11-12
近期六种新药获得欧盟批准
近日,六种新药已获得欧洲药品管理局人类药用产品委员会(CHMP)的批准,其中还包括甲状腺病的第一种激素替代疗法。罕见病药物 Natpar(甲状旁腺激素)已被委员会批准上市。委员会推荐该药用于那些不能用标准治疗方法(钙和维生素 D)充分控制病情的慢性甲状旁腺功能减退患者。甲状旁腺功能低下症是一种激素障碍,该类患者颈部的甲状旁腺产生甲状旁腺激素少于正常人。这将导致血液中钙过少而磷酸盐过多,患者神经和肌
新浪医药 - 新药研发,欧盟批准 - 2017-02-28
欧盟批准新型糖尿病复合药物
欧盟委员会于近日批准二肽基肽酶-4抑制剂利格列汀(Linagliptin)+二甲双胍的复合剂型,用于与健康饮食和运动一起治疗成人2型糖尿病。
医学论坛网 - 二肽基肽酶-4抑制剂,利格列汀,二甲双胍,磺酰脲类药 - 2012-07-31
欧盟发布《个案病例安全报告实施指南》
欧洲药品管理局(EMA)为支持这项新国际标准在欧盟(EU)的实施,近期发布了《个案病例安全报告实施指南》。ISO ICSR旨在为全球各地患者发生的涉及某种药物疑似不良反应的病例提供相同的报告格式。
MedSci原创 - 个案,病例 - 2015-07-22
GSK皮肤癌药物Mekinist获欧盟批准
Mekinist(trametinib)已在欧盟批准作为单一治疗药物用于携带BRAFV600突变的不可切除或转移性黑色素瘤成人患者。
不详 - 皮肤癌,药物 - 2014-07-14
为您找到相关结果约500个