Nat Med:T细胞受体疗法(TCR)治疗骨髓瘤疗效良好
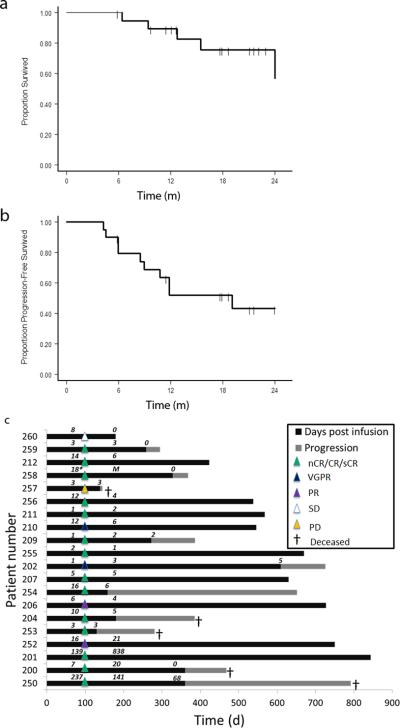
1/2期试验结果显示,对于多发性骨髓瘤患者,自体干细胞移植之后进行新型T细胞受体(TCR)疗法治疗是安全的,而且与临床缓解和无进展生存期改善相关。Aaron Rapoport及其同事写到,骨髓瘤的自体免疫调节是可能发生的,因为存在于骨髓瘤患者血液和骨髓瘤中的肿瘤活化T细胞可靶向骨髓瘤细胞。研究者还写道,对于黑素瘤的早期临床试验、研究者推荐TCR设计的T细胞,但是其临床结果差强人意。
MedSci原创 - 骨髓瘤,TCR - 2016-05-06
Blood:CD19-CAR-T细胞的内源性TCR表达的去留?
抗CD19-CAR表达的CRISPR/Cas9介导的T细胞受体敲除使allo-CAR-T细胞治疗成为可能;内源性TCR和CD19-CAR的共表达延长了T细胞的体内持久性。
MedSci原创 - ALL,抗CD19嵌合抗原受体,内源性T细胞受体 - 2020-06-07
张会来教授:T细胞耗竭及靶向T细胞免疫治疗展望
T细胞耗竭是慢性病毒感染和肿瘤状态下T细胞发生的一种功能障碍状态。耗竭T细胞效应功能低下,持续高表达免疫抑制性受体。逆转T细胞耗竭已经延伸出一种新的治疗手段即免疫检查点疗法,这种治疗方法通过靶向高表达于耗竭T细胞上的免疫抑制性受体如PD-1等。
ioncology - T细胞耗竭,免疫治疗 - 2017-12-19
体内诱导CAR-T细胞:有望突破当前CAR-T细胞治疗的障碍
该论文综述了CAR结构、基因编辑工具和基因递送技术在免疫治疗中的应用,以及免疫细胞治疗的未来趋势,有助于设计和开发新的体内原位诱导CAR-T细胞。
生物世界 - CAR-T细胞,嵌合抗原受体T细胞疗法 - 2023-04-05
异体γδT细胞治疗新突破,肿瘤治疗潜力显现
γδ T细胞治疗有望在肿瘤、难治性重大传染病治疗、免疫重建中能发挥治疗作用,在免疫治疗中发挥不可替代和互补的作用。
MedSci原创 - 细胞治疗,细胞免疫疗法,γδ T细胞,异体γδ-T细胞治疗 - 2021-09-30
完全个体化肿瘤免疫疗法:一种针对个体化抗原的自体基因编辑的TCR T细胞疗法(NeoTCR-P1)
PACT Pharma是癌症免疫学和细胞治疗领域的领导者,与加州大学洛杉矶分校的团队合作,能够使用其专有的基因工程技术为每个癌症患者制造免疫细胞治疗产品(NeoTCR-P1)。
MedSci原创 - TCR,T细胞疗法,NeoTCR-P1,完全个体化肿瘤免疫疗法 - 2019-07-22
γδT细胞治疗:100%CR,疗效好得吓人!
γδ T细胞则由γ链和δ链组成,约占人体内T细胞数量的5%,具有天然的归巢优势,杀伤力强大,识别目标抗原不受限于组织相容性复合物(MHC),不会引发Gv
MedSci原创 - γδT细胞治疗 - 2023-04-26
双靶点CAR-T细胞治疗
嵌合抗原受体(CAR)T细胞已经复发性血液系统恶性肿瘤的治疗中取得了显著的成功,如急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)。
小药说药 - 细胞治疗,CAR-T - 2023-02-02
突破实体瘤:基于干细胞样T细胞的CAR-T细胞,显示出实体瘤治疗潜力
该研究开发了一种基于干细胞样T细胞(TSTEM)的新型CAR-T细胞疗法,相较于基于传统T细胞的CAR-T细胞,TSTEM CAR-T细胞扩增能力更强,并在临床前研究中证明其对实体瘤有效。
生物世界 - 实体瘤,CAR-T细胞 - 2023-04-10
异基因CAR-T细胞治疗的临床前景
多项研究正在临床中检验不同靶点和不同技术平台开发的异基因CAR-T细胞疗法,随着现有技术的进一步成熟和新技术的开发,相信异基因CAR-T细胞疗法终将会使更多的肿瘤患者受益。
小药说药 - 病毒特异性T细胞,αβT细胞,γδT细胞 - 2022-09-18
UnitedHealthcare 临床指南:嵌合抗原受体 T 细胞治疗
本指南概述了嵌合抗原受体 T 细胞治疗的一般信息和适应症。
UnitedHealthcare官网 - CAR-T,嵌合抗原受体T细胞免疫疗法 - 2022-07-14
Blood:抗CD37嵌合抗原受体T细胞可有效治疗B/T细胞淋巴瘤
嵌合抗原受体(CAR)T细胞已成为B细胞恶性肿瘤患者的新的治疗方式。特别是抗CD19 CAR T细胞疗法,可明显提高B血细胞急性淋巴细胞白血病(ALL)和弥漫性大B细胞淋巴瘤(DLBCL)的临床缓解率。Irene Scarfò等人于近日在《Blood》杂志上发表一篇文章,介绍了一种针对在B细胞非霍奇金淋巴瘤、慢性淋巴
MedSci原创 - CD37,嵌合抗原受体,淋巴瘤 - 2018-08-13
Scientific Reports:白细胞去除术外周血中的 T 细胞计数可预测对后续 CAR-T 细胞治疗的反应
白细胞去除术中的CD3+细胞计数可以预测输注后CAR-T细胞的扩增和CAR-T细胞治疗的结果,并且有助于在白细胞去除术时建立全面的治疗策略。
MedSci原创 - CAR-T 细胞治疗,白细胞去除术, T 细胞计数 - 2022-11-08
美国FDA授予Lion TCR两项针对肝癌T细胞疗法的孤儿药物资格
美通社 - 2017-08-22
CAR-T细胞治疗的现状及监管
嵌合抗原受体修饰的T细胞(CAR-T)因其对终末期癌症有效,已经成为癌症免疫治疗的一种新形式。报道显示,CAR-Ts比单克隆抗体和抗体-药物联合用药效力更高,其作用机制异于T细胞受体工程T细胞。通过将编码癌抗原识别单链Fv的融合蛋白的基因与T细胞受体胞内信号传导结构域相连构建CAR-T。根据T细胞受体的细胞内信号传导域数目,CAR-Ts分为第一代,第二代和第三代。本综述涵盖了CAR-T研究的现状,
生物制品圈 - CAR-T疗法,血液肿瘤,研究现状 - 2018-01-30
为您找到相关结果约500个