识别和降低研究用新药在首次人体和早期临床试验中风险的策略指导原则(三)
本文为《识别和降低研究用新药在首次人体和早期临床试验中风险的策略指导原则》中文译本,相较于旧版本增加了综合方案(integrated protocol)设计时应注意的问题。
上海医药 - 早期临床试验 - 2023-05-02
运动生理学家的代谢组学指南
这篇综述探讨了一些关键的技术和生物信息学进步,这些进步将代谢组学推向了运动生理学研究的前沿。
Experimental Physiology - 运动生理学 - 2024-02-25
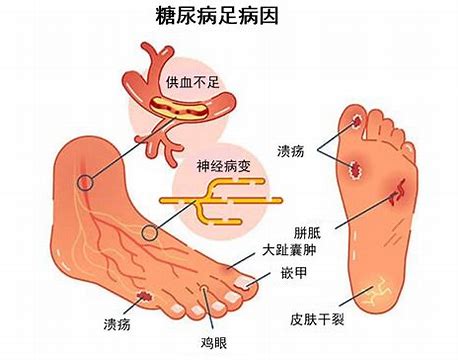
中成药治疗糖尿病足随机对照试验的证据总结与评价
系统收集、分析和评价中成药治疗糖尿病足的临床随机对照试验(randomized controlled trial,RCT),总结临床证据,以期为后续研究的开展及证据转化应用提供参考。
中国中药杂志 - 糖尿病足 - 2023-10-20
创新医疗器械临床研究方法学框架解读
创新医疗器械的上市审批和临床应用,需基于高质量临床研究,证明其可靠性、安全性和有效性。2016年IDEAL(Idea,Development,Exploration,Assessment and Lo
中国胸心血管外科临床杂志 - 医疗器械 - 2022-07-25
FDA指南:结合人类基因组编辑的人类基因治疗产品
在本指南中,我们FDA为申办者提供建议,以开发包含人类体细胞基因组编辑(GE)的人类基因治疗产品。具体而言,本指南提供了有关研究性新药 (IND) 申请中应提供的信息的建议,以便根据联邦法规 312.
FDA官网 - 基因治疗 - 2024-02-01
FDA“糖尿病足感染:开发治疗药物的供企业用的指导原则草案”介绍
美国食品药品监督管理局(FDA)于2023年11月发布了“糖尿病足感染:开发治疗药物的供企业用的指导原则(草案)”。该指导原则草案提出了糖尿病足感染治疗药物临床开发的建议,包括
药物评价研究 - 糖尿病足 - 2024-04-07
新型信使核糖核酸疫苗研究:开启革命性疫苗科学——解读2023年诺贝尔生理学奖或医学奖
本文旨在总结和讨论传统疫苗与新兴mRNA疫苗技术的区别,以及mRNA疫苗的关键化学设计和原理。
中国医学前沿杂志(电子版) - 核糖核酸 - 2024-01-15
外科安慰手术应用指南及其对针刺临床研究中假针刺应用的借鉴
合理、规范地应用假针刺对照是决定针刺临床研究质量的关键,亦是针刺临床研究面临的难题。英国国家健康研究所和医学研究委员会联合发表了随机化评价中外科安慰手术应用指南——ASPIRE
针刺研究 - 针刺,针刺疗法 - 2023-03-18
肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)
肿瘤治疗性疫苗作用机制是通过抗原呈递细胞(APC)将抗原加工并呈递给T细胞,从而诱导产生或放大已存在的抗原特异性T细胞反应,这一系列的免疫反应过程需要较长时间。与传统细胞毒药物、靶向治疗或
国家药品监督管理局药品审评中心 - 肿瘤治疗性疫苗 - 2022-10-09
2023 EGS 青光眼手术创新指南
发布本青光眼手术指南,以帮助临床医生为患者做出适当的决定,并为研究人员在未来的研究中提高证据质量提供框架和指导。
Br J Ophthalmol - 青光眼 - 2024-01-23
中药药源性肝损伤临床评价技术指导原则
此,国家药品监督管理局组织全国相关专业专家,融合医学与药学、临床与科研等领域的国内外专家共识和研究进展,以加强药品全生命周期风险管理为主要导向,起草制订了《中药药源性肝损伤临床评价指导原则》,旨在指导和帮助相关机构及人员有效捕捉和识别中药药源性肝损伤风险信号,科学评估患者肝损伤与中药的因果关系,有效减少误判,全面评估相关中药的安全性以及风险与获益情况,有针对性地制订中药药源性肝损伤风险防控措施,降
临床肝胆病杂志.2018.34(7):1403-1409. - 中药,药源性肝损伤,临床评价技术 - 2018-07-09
FDA行业指南:扩展队列:用于首次人体临床试验以加快肿瘤药物的开发和生物制剂
本指南的目的是向申办者提供有关首次人体 (FIH) 临床试验的设计和实施的建议,旨在通过多个扩展队列试验设计有效地加快包括生物制品在内的肿瘤药物的临床开发。 这些试验设计采用多个同时累积的受试者队列,
FDA - 药物开发 - 2022-03-16
FDA发布真实世界研究用于药物和生物制品的非干预临床研究的指导原则
美国食品药品监督管理局(FDA)的关于利用非干预性研究评估药物有效性和安全性的指导草案文件。文件主要内容包括:
FDA - 真实世界研究 - 2024-03-24
FDA有关非青霉素 β-内酰胺类药物:预防交叉污染的 CGMP 框架
本指南描述了在防止药物与含有β-内酰胺环的化合物交叉污染方面很重要的方法、设施设计元素和控制措施。 本指南还提供了有关非青霉素β-内酰胺类抗菌药物和非抗菌β-内酰胺类化合
FDA - β-内酰胺类单药,β-内酰胺类 - 2022-08-08
为您找到相关结果约500个