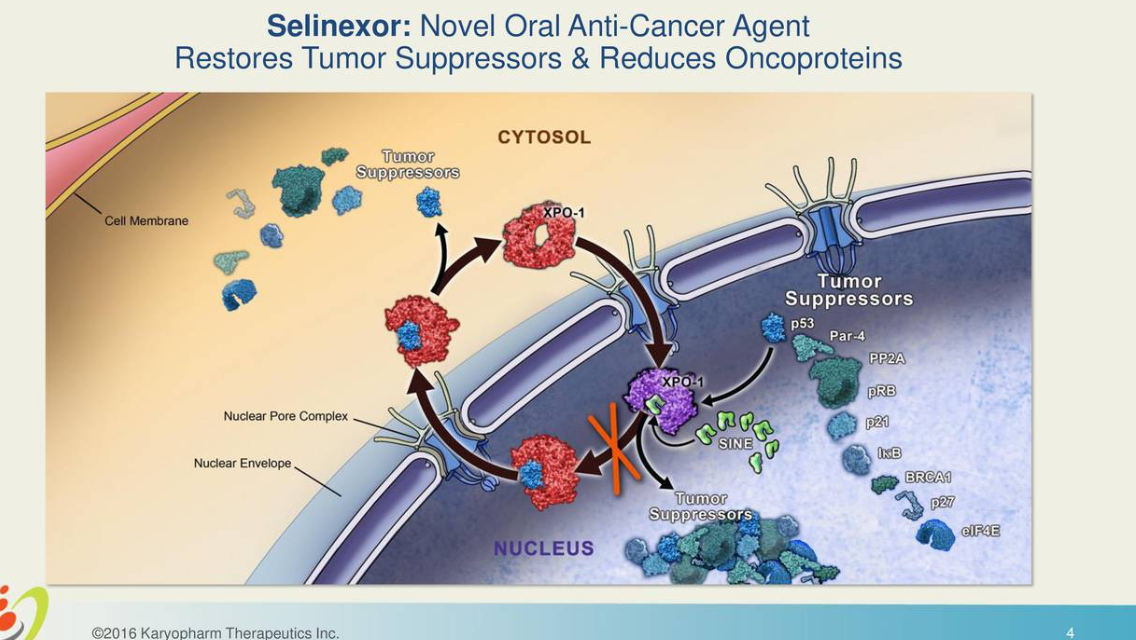
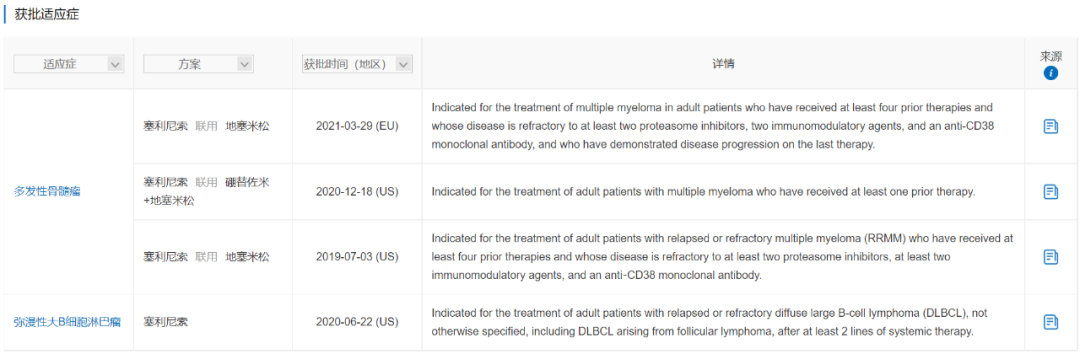
FDA批准Karyopharm的Xpovio(selinexor)用于治疗多发性骨髓瘤
FDA已批准Xpovio(selinexor)联合硼替佐米和地塞米松用于治疗多发性骨髓瘤成年患者,这些患者至少接受过一种疗法。
MedSci原创 - 多发性骨髓瘤,复发/难治性多发性骨髓瘤,Karyopharm,Xpovio(selinexor) - 2020-12-20
NEJM:XPOVIO(Selinexor)治疗难治性多发性骨髓瘤的IIb期STORM研究
Karyopharm是一家专注于肿瘤学的制药公司,近日宣布,XPOVIO(Selinexor)治疗难治性多发性骨髓瘤患者的IIb期STORM研究结果已经发表于《新英格兰医学杂志》。
MedSci原创 - 多发性骨髓瘤,Xpovio,selinexor - 2019-08-22
第17届国际骨髓瘤研讨会(IMW):XPOVIO(Selinexor)的最新临床数据将被披露
Karyopharm Therapeutics是一家专注于肿瘤学的制药公司,近日宣布,将在9月12日至15日举行的第17届国际骨髓瘤研讨会(IMW)上发表五篇重点介绍XPOVIO™(selinexor)
MedSci原创 - selinexor,骨髓瘤,Xpovio - 2019-09-16
FDA批准Karyopharm的核输出抑制剂Xpovio用于治疗复发或难治的多发性骨髓瘤
Karyopharm Therapeutics宣布FDA批准Xpovio(selinexor)联合地塞米松用于复发或难治性多发性骨髓瘤的成人患者。
MedSci原创 - Karyopharm,核输出抑制剂,Xpovio,多发性骨髓瘤 - 2019-07-04
Karyopharm的口服核出口选择性抑制剂XPOVIO针对多发性骨髓瘤的III期临床试验达到终点
Karyopharm宣布其口服核出口选择性抑制剂XPOVIO(selinexor)针对多发性骨髓瘤的III期BOSTON研究达到终点。
MedSci原创 - Karyopharm,口服核出口选择性抑制剂,Xpovio,多发性骨髓瘤,III期临床试验,达到终点 - 2020-03-05
FDA批准首个治疗复发或难治性大B细胞淋巴瘤患者的口服药物:核出口抑制剂XPOVIO
“这项批准标志着XPOVIO成为先前治疗过的DLBCL患者首个获批的口服药物,也是针对这种高度侵袭性淋巴瘤的首个获批的单一药物。”
MedSci原创 - 核出口抑制剂XPOVIO,复发或难治性弥漫性大B细胞淋巴瘤(DLBCL) - 2020-06-23
The Lancet:核出口抑制剂XPOVIO显著延长复发或难治性多发性骨髓瘤患者的无进展生存期
SVd治疗方案相比于Vd将PFS中位数增加了4.47个月(47%)。
MedSci原创 - 复发/难治性多发性骨髓瘤,核输出蛋白1,口服核出口选择性抑制剂XPOVIO - 2020-11-16
FDA接受Karyopharm的口服核出口选择性抑制剂XPOVIO的补充新药申请,用于治疗复发或难治的弥漫性大B细胞淋巴瘤
Karyopharm Therapeutics宣布,美国食品药品监督管理局(FDA)已接受其补充新药申请(sNDA)寻求将口服核出口选择性抑制剂XPOVIO(selinexor)片剂,用于先前已接受过至少两种治疗方案的复发或难治的弥漫性大
MedSci原创 - FDA,Karyopharm,Xpovio,补充新药申请,复发或难治的弥漫性大B细胞淋巴瘤 - 2020-02-20
骨髓瘤治疗新进展,全新作用机制药物Selinexor(ATG-010)三种治疗方案入选最新版NCCN®多发性骨髓瘤诊疗指南
12月15日,德琪医药有限公司(简称“德琪医药”)宣布,美国国家综合癌症网络(NCCN®)在最新版多发性骨髓瘤临床实践指南(NCCN Guidelines®)中添加了三种selinexor(ATG-0
医药魔方 - 多发性骨髓瘤,德琪医药 - 2020-12-16
最新临床失败、加速评估被撤、用药被限制 诺华最近有点背!
诺华重磅心衰药物Entresto已被批准用于治疗射血分数降低的心力衰竭(HFrEF),该公司一直在努力希望扩大适应症,用于治疗另一种类型的心力衰竭——射血分数保留的心力衰竭(HFpEF)。
新浪医药新闻 - 诺华,临床试验,用药限制 - 2019-07-31
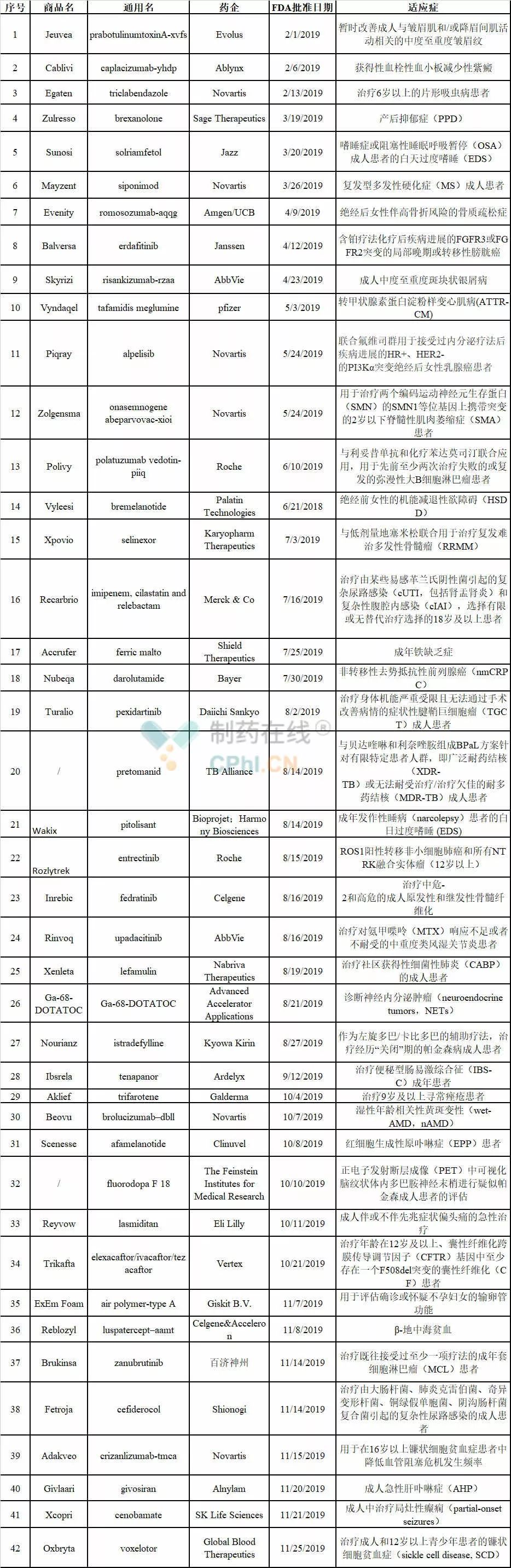
FDA 2019:批准45款新药,9款生物类似药
美国FDA的药物评估与研究中心(CDER)已经批准42款新药,9款生物类似药,3款在路上,而生物制品评估与研究中心(CBER)也批准了诺华公司的基因疗法Zolgensma和首款登革热疫苗。另外还有3款新药的PDUFA时间在12月,预计2019年将有45款新药获得FDA批准。相较于2017年和2018年,2019年会是FDA批准新药数量最低的一年,但质量不差,比如Skyrizi、Zolgensm
MedSci - FDA,新药 - 2019-12-24
为您找到相关结果约13个