除了换季流感和过敏,还可了解的 7 个公共卫生前沿专刊
前沿专刊「Research Topic」,是 Frontiers 赋能学术工作者的创新方式之一,前沿专刊的客座编辑确定某领域内的研究方向,接收相关领域作者的投稿,最终以文章合辑的形式发表在期刊正刊。
最新研究 | 一种新的益生菌——乳杆菌的调节方式,可有效缓解过敏性鼻炎的症状
与其他常用的治疗过敏性鼻炎的药物相比,GUANKE 菌作为一种国家卫健委批准的可食用益生菌,具有安全性高、效果明显、而且对过敏原非特异的优势,因此更易推广使用并被患过敏症患者接受。
每周“洗脑”30分钟,让大脑返老还童?Nature最新:改善老年的认知能力,还能缓解阿尔茨海默症的病理!但要注意...
Nature子刊:用近红外光“洗洗脑”,能够改善认知功能,让你的大脑“返老还童”!
心血管治疗类医疗器械非劣效性试验特点及界值设置的系统评价
中国心血管疾病现患人数高达3.3亿并持续上升,疾病负担较大[1]。在迫切的临床需求下,心血管疾病领域的创新医疗器械发展迅速,在疾病的诊断、治疗以及康复随访等各个阶段均发挥了重要作用[2]。其中,经皮冠
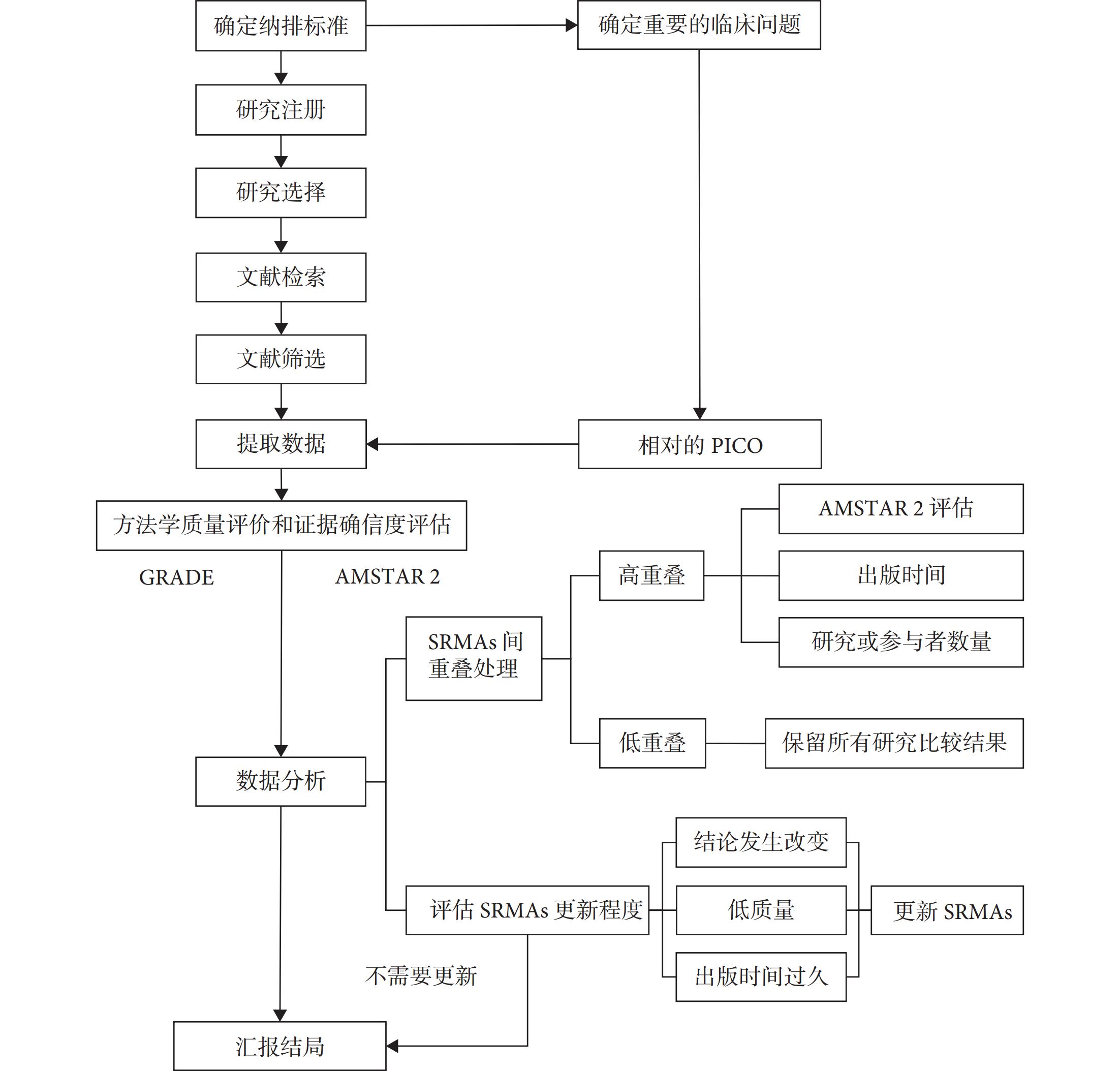
伞状评价制定方法和步骤
系统评价和Meta分析(systematic reviews and meta-analysis,SRMAs)作为“证据金字塔”中最高等级的证据,在过去20年间发表的数量显著增
卫生经济学证据在临床实践指南制订中的应用
在临床医生的诊疗决策中,临床实践指南(clinical practice guideline,CPG)是重要的依据。根据美国医学研究所(Institute of Medicine,IOM)的定义,CP
个体预后与诊断多变量预测模型系统评价/Meta分析报告规范(TRIPOD-SRMA)解读
预测模型是指利用多个预测因子估计患有(即诊断模型)或未来发生特定疾病或结局(即预后模型)风险的数学模型,它们对临床实践具有重要的指导意义[1]。目前,预测模型研究的数量正在急剧增加,并且越来越多地被应
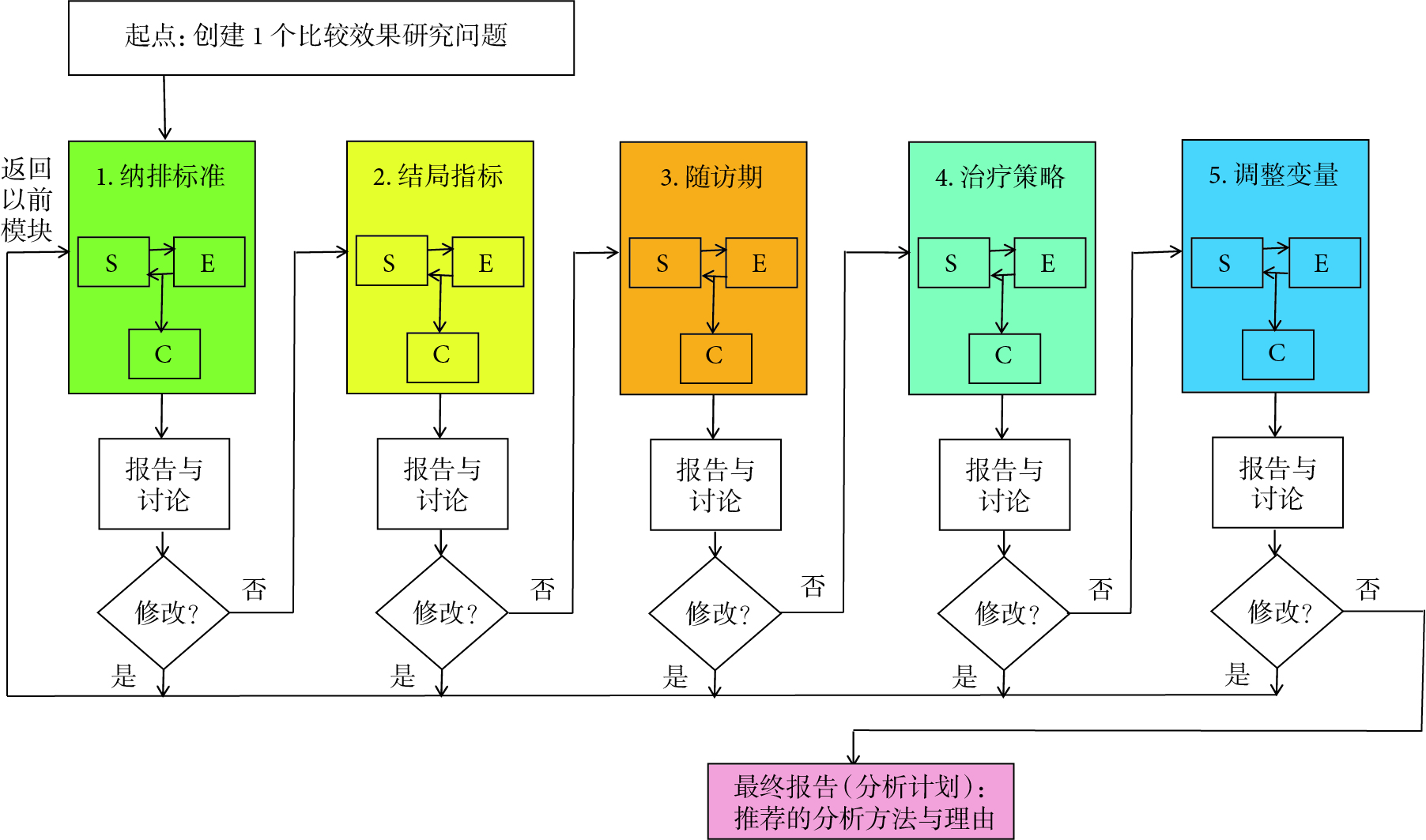
目标试验模拟研究辅助实施工具CERBOT简介与应用
因果推断的快速发展正在引起众多学科领域研究的“范式革命”[1,2]。长期以来,随机对照试验被认为是进行因果推断的金标准设计[2],医学领域中通常使用它来获取医疗干预有效性和安全
临床预测模型研究方法与步骤
临床预测模型又称风险预测模型、预测指数、预测规则、风险评分,是一种通过纳入多个变量(如临床指标、生化指标、影像学等)预测结局发生情况的统计学模型[1-3],可对患者的疾病发生、严重程度分层、风险和转归
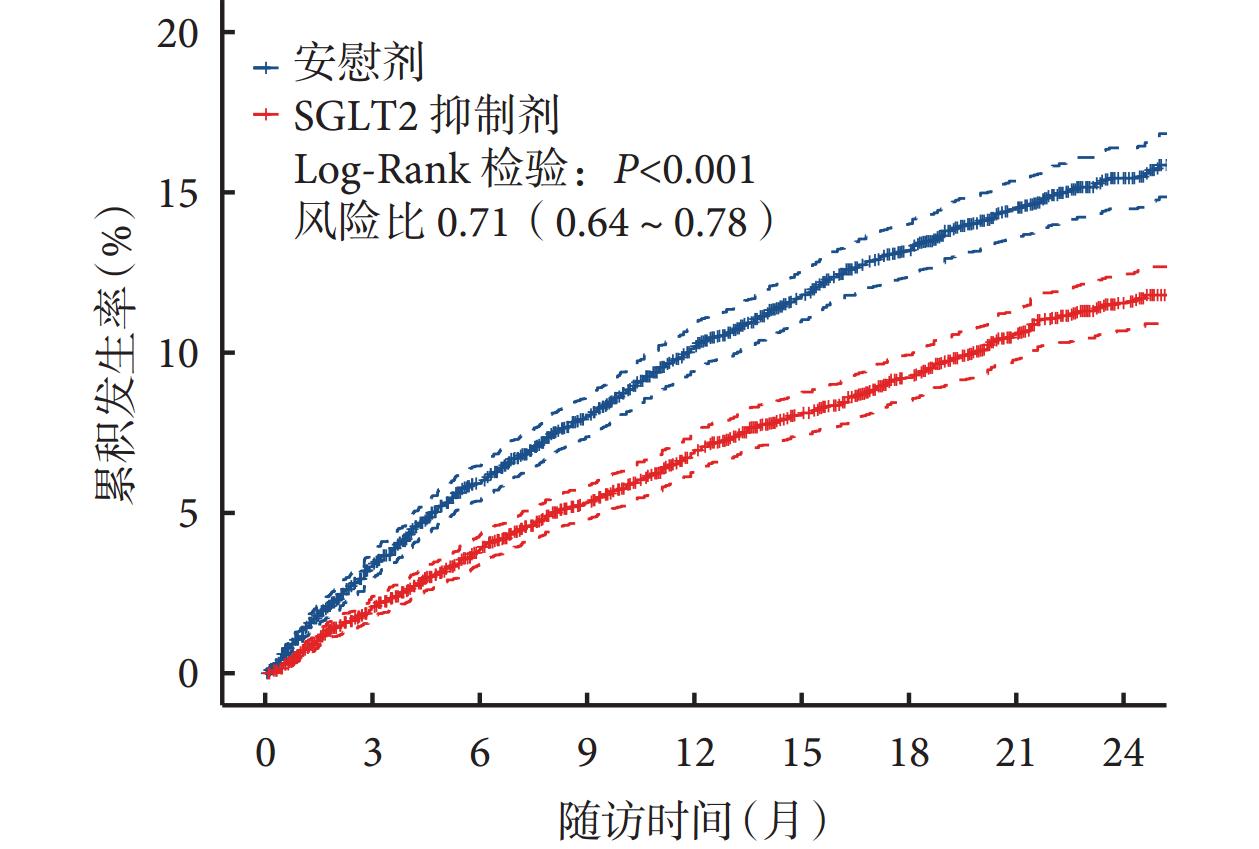
时间-事件结局证据合成中时间的效应修饰作用
在涉及疾病痊愈、复发、死亡等重大问题上,研究者不仅关注事件是否发生,也关注事件发生的时间[1]。时间-事件(time-to-event)结局数据,亦称生存资料,是纵向研究中记录和描述事件发生状况及时间
数字健康实施报告规范(iCHECK-DH清单)解读
近年来,数字健康技术实施迅速增长,为规范数字健康实施研究质量和增加报告的透明度与完整性,Perrin等于2023年发表了iCHECK-DH: guidelines and checklist for