NCB:南京大学甘振继等合作发现脂肪细胞的细胞身份转换的调控新机制
2023-05-24 iNature iNature 发表于上海
该研究表明LONP1对线粒体进行蛋白水解重排,指导脂肪细胞的细胞身份转换。
线粒体蛋白酶是线粒体可塑性的关键调节因子,并通过进行高度调节的蛋白质水解反应,作为蛋白质质量监测和调节酶。然而,目前尚不清楚受调节的线粒体蛋白水解是否与细胞身份转换有机制联系。
2023年5月22日,南京大学甘振继及中国科学院上海巴斯德研究所邵孟乐共同通讯在Nature Cell Biology 在线发表题为“Proteolytic rewiring of mitochondria by LONP1 directs cell identity switching of adipocytes”的研究论文,该研究表明LONP1对线粒体进行蛋白水解重排,指导脂肪细胞的细胞身份转换。该研究发现冷响应线粒体蛋白水解是脂肪细胞产热重塑过程中白色到米色脂肪细胞命运编程的先决条件。产热刺激通过线粒体蛋白酶LONP1选择性地促进成熟白色脂肪细胞的线粒体蛋白质停滞。破坏LONP1依赖的蛋白水解会严重损害冷或β3肾上腺素能激动剂诱导的成熟脂肪细胞白色到米色的身份转换。
在机制上,LONP1选择性地降解琥珀酸脱氢酶复合体铁硫亚基B,并确保足够的细胞内琥珀酸水平。这改变了产热基因上的组蛋白甲基化状态,从而使脂肪细胞命运编程成为可能。最后,增加的LONP1表达提高琥珀酸盐水平,并纠正白色到米色脂肪细胞转化和脂肪细胞产热能力的衰老相关损伤。总之,这些发现表明,LONP1将蛋白水解监测与线粒体代谢重新连接联系起来,并在脂肪细胞产热重塑过程中指导细胞身份转换。

线粒体是重要的代谢中心,其作用远远超出了能量的产生,为许多细胞过程提供燃料。进化上保守的线粒体蛋白酶(即有丝分裂蛋白酶)通过确保线粒体蛋白的持续更新负责蛋白质质量控制。除了在介导错误折叠或受损蛋白的非选择性降解中发挥作用外,有丝分裂蛋白酶还发挥高度调节功能,并通过进行高度调节的蛋白水解反应来调节线粒体活动。
棕色和米色(或灰白色)脂肪细胞是特殊的富含线粒体的产热细胞,能够产生热量,这是保护胎盘哺乳动物在寒冷环境中免受低温的关键机制。棕色和米色脂肪细胞都依靠线粒体的能量传导能力以热量的形式消耗营养能量。与之形成鲜明对比的是,储存能量的白色脂肪细胞线粒体较少,但在对产热刺激的反应中表现出实质性的线粒体动力学和可塑性。在白色脂肪组织(WAT)中,低温或β3肾上腺素能激动剂刺激可诱导线粒体富集的多室米色脂肪细胞的出现,这一过程被称为褐变。脂肪细胞β3肾上腺素能受体的激活诱导先前存在的单眼白色脂肪细胞进行戏剧性的细胞编程,以采用米色表型。其特征包括线粒体数量和活性的大量增加,以满足脂肪细胞热重构日益增加的代谢需求。
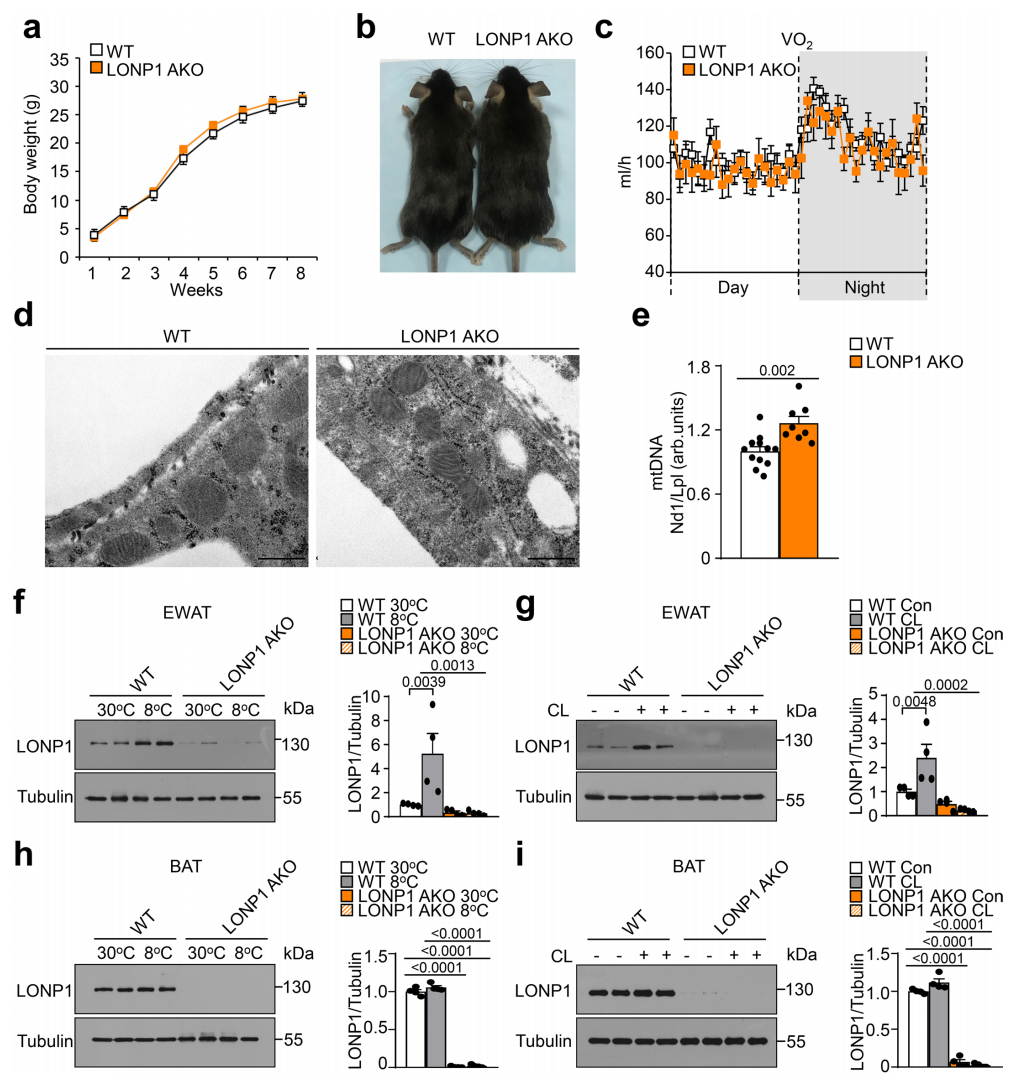
产热刺激在WAT中特异性地促进线粒体蛋白酶抑制,而在BAT中没有(图源自Nature Cell Biology )
除了从头开始线粒体生物发生外,WAT beiging 还伴随着线粒体蛋白质组的深刻转变,以满足高效线粒体生物发生、重组和呼吸的要求。此外,WAT beiging大大增加了许多线粒体蛋白的丰度,这些线粒体蛋白参与细胞呼吸、脂肪酸氧化、跨膜运输和其他必要的生物过程,以支持脂肪细胞产热所需的葡萄糖、脂质、氨基酸和其他燃料底物的有效运输和消耗。因此,维持线粒体蛋白质组的完整性和可塑性对于在WAT期间激活和维持脂肪细胞产热能力至关重要。然而,线粒体蛋白水解酶和受调节的线粒体蛋白水解是否与白色到米色脂肪细胞转化有机制联系尚不清楚。
该研究发现LONP1-从酵母到人类最保守的线粒体蛋白酶是米色脂肪细胞中负责维持线粒体蛋白平衡的主要蛋白酶。该研究结果确定了LONP1依赖的调节线粒体蛋白水解在脂肪细胞身份转换中的核心作用,并表明LONP1可能作为线粒体传感器,协调线粒体与产热刺激的复杂相互作用。
原文链接:
https://www.nature.com/articles/s41556-023-01155-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言