【专题论著】| 单细胞RNA测序技术揭示卵巢高钙血症型小细胞癌复发病灶的细胞分子特征
2023-08-09 中国癌症杂志 中国癌症杂志 发表于上海
揭示了SCCOHT的肿瘤微环境由iPSC、神经施万细胞、神经上皮细胞及巨噬细胞组成,鉴定出iPSC关键细胞亚群,寻找到PLK1基因作为潜在的治疗靶点。
[摘要]
背景与目的:卵巢高钙血症型小细胞癌(small cell carcinoma of the ovary, hypercalcemic type,SCCOHT)是高度恶性的、极为罕见的原发性未分化卵巢癌,本研究旨在分析SCCOHT肿瘤微环境及细胞分子特征,探究潜在药物靶标。方法:收集1例SCCOHT患者盆腔复发病灶,应用单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)寻找关键细胞亚群及潜在药物靶点,进一步在细胞学层面进行验证。结果:SCCOHT复发病灶中有诱导性多能干细胞(induced pluripotent stem cell,iPSC)、神经施万细胞、神经上皮细胞和巨噬细胞4种细胞亚群和12个细胞亚簇。iPSCs细胞亚群显著上调的基因主要富集于细胞周期调控,其中PLK1基因上调最为显著。PLK1蛋白在SCCOHT组织切片中呈阳性表达,在SCCOHT细胞系中表达水平升高。结论:揭示了SCCOHT的肿瘤微环境由iPSC、神经施万细胞、神经上皮细胞及巨噬细胞组成,鉴定出iPSC关键细胞亚群,寻找到PLK1基因作为潜在的治疗靶点。
[关键词] 卵巢高钙血症型小细胞癌;单细胞RNA测序技术;PLK1
[Key words] Small cell carcinoma of the ovary, hypercalcemic type; Single-cell RNA sequencing; PLK1
卵巢高钙血症型小细胞癌(small cell carcinoma of the ovary, hypercalcemic type,SCCOHT)是一种临床上极为罕见的原发性未分化卵巢癌类型,肿瘤生物学行为具有高度恶性,组织构成及其起源迄今仍未完全确定[1-2]。SCCOHT好发于年轻女性,平均年龄约24岁,约62%的患者以恶心、呕吐、不明原因的高钙血症作为首诊症状。目前对SCCOHT主要采取手术、化疗、放疗相结合的综合治疗方案,因其对放疗和化疗敏感性差,所以预后极差,且易复发,1年存活率仅为50%,5年存活率<10%,约74.5%的患者会复发,且其中位复发或进展时间仅为6.5个月[3]。SCCOHT是一种少见的单基因突变肿瘤,约90%以上的患者都存在SMARCA4基因的胚系或体系突变,这也被视为SCCOHT的主要发病特征[4]。SCCOHT中SMARCA4基因突变会导致其编码的BRG1蛋白表达缺失,这也常作为其诊断的重要指标。
肿瘤微环境包括多种细胞类型,这些细胞类型的存在共同导致肿瘤生长和转移,从而引起发病。肿瘤微环境中的每个细胞都具有独特的基因组、表观基因组、转录组和蛋白质组。即使是基因相同的细胞也会在驱动、调节、转录和翻译的机制上有所差异,从而导致不同的基因表达。既往研究[5]发现,SCCOHT虽然作为一种单基因突变肿瘤,具备较低的肿瘤突变负荷,但在其肿瘤微环境中,依然存在增加的肿瘤浸润淋巴细胞和高表达的程序性死亡[蛋白]配体-1 (programmed death ligand-1,PD-L1)。然而对于SCCOHT的肿瘤微环境内细胞类型的构成仍缺乏足够的认识。
SCCOHT的靶向药物主要是利用SMARCA4功能缺失引起的已知合成致死作用,以及通过无偏遗传筛选得到的靶标,包括EZH2抑制剂[6]、受体酪氨酸激酶(receptor tyrosine kinase, RTK)抑制剂[7]、细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂[8]等。目前,SCCOHT靶向治疗的临床效果有限,还需要更多的研究来探究SCCOHT的潜在药物靶标。单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)以其极高的分辨率无疑成为探索SCCOHT肿瘤微环境及潜在药物靶标的有力工具。
1 材料和方法
1.1 组织样本
收集2020年10月—2021年6月就诊于复旦大学附属妇产科医院、经病理学检查诊断为SCCOHT的盆腔复发病灶肿瘤组织,同时收集另外3例SCCOHT患者的手术切除组织切片及3例由于良性病变进行卵巢切除手术的组织切片。本研究经复旦大学附属妇产科医院伦理委员会审查通过,并已取得患者知情同意。
1.2 实验细胞
人SCCOHT细胞系COV434[9]购自美国Sigma公司,并进行短串联重复序列(short tandem repeat,STR)验证其SMARCA4突变信息;人卵巢正常上皮细胞IOSE80、高级别浆液性卵巢癌细胞系OVCAR3及OVCAR8均为本课题组前期购买、鉴定和保存。
1.3 实验方法
1.3.1 数据处理
使用R语言Seurat包筛选基因数量为200~7 500、线粒体基因比例小于20%、血红蛋白基因比例小于5%的细胞,整合各样本数据并使用harmony矫正批次效应。
1.3.2 降维聚类与细胞注释
使用RunPCA函数及RunTSNE函数进行细胞降维聚类,查看标记基因的表达并进行细胞注释。
1.3.3 轨迹分析
利用Monocle包分析调节性T细胞(regulatory T cells,Treg)发育轨迹。使用newCellDataSet函数创建数据集进行后续分析,随即设置max_components为2和“DDRTree”进行降维,并使用“orderCells”对细胞进行排序,获得细胞发育轨 迹。
1.3.4 scCancer算法
分析每个细胞基因表达值与数据库提供的参考值相比的基因拷贝数变异(copy number variation,CNV)信息,并根据整体基因拷贝数变化的情况对细胞进行恶性打分(malignScore)。scCancer参考R包算法inferCNV来估计初始CNV分布图。然后,通过滑动窗口来获得细胞的CNV值,并将恶性评分定义为它们的平方的平均值。
1.3.5 免疫组织化学染色
烤片;脱蜡;置于3%过氧化氢溶液中10 min;磷酸缓冲盐溶液(phosphate-buffered saline,PBS)洗3次,每次5 min;抗原修复;转移至湿盒,用免疫组织化学笔圈出组织边缘;3%过氧化氢溶液滴于切片上,37 ℃温育 25 min;一抗温育:湿盒中4 ℃过夜;自然复温 1 h;二抗温育,37 ℃温育1 h;加入二氨基联苯胺(diaminobenzidine,DAB)显色液;苏木精复染,脱水;置于二甲苯Ⅰ和Ⅱ中各5 min;中性树胶1~2滴封片。
1.3.6 蛋白质印迹法(Western blot)
蛋白样品制备;蛋白定量;配胶;电泳:电泳程序先设置为60 V,待样本跑到下层胶(15~30 min),将程序调整为120 V,约70 min;转膜:转膜程序设置为300 mA,然后根据所需要的蛋白分子质量调整转膜的时间;封闭:用含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)配制5%的脱脂牛奶,将膜浸泡其中,室温摇床上缓慢摇45~60 min;一抗温育:将封闭结束的膜按照不同相对分子质量大小进行裁剪,置于相应的一抗中,在摇床上4 ℃温育过夜;二抗温育:置于5%脱脂牛奶配置的二抗中,室温60 min;显色。
1.3.7 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
提取RNA样本后按照日本Takara公司反转录试剂盒中的体系配体比配制反应体系,反应时间的设定条件一般均为37 ℃反应15 min,85 ℃反应5 s。以反转录得到的cDNA为模板进行,实验过程中所有样品和试剂均置于冰上保持低温环境,并且注意避光。将cDNA稀释3~5倍后进行上样。反应程序为95 ℃ 30 s;60 ℃ 5 s,60 ℃ 34 s;40个循环,并添加溶解曲线(95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s)。
1.4 生物信息学分析
1.4.1 GO分析
使用Fisher算法对样品间不同基因组完成转录基因的分子功能(molecular function,MF)、细胞组成(cellular component,CC)、生物学过程(biological process,BP)的富集解析。根据上述分析结果,运用超几何检验,找出差异表达基因明显富集的GO条目。
1.4.2 KEGG分析
使用KEGG数据库系统结合KEGG注释结果对差异基因开展通道分析,并用超几何分布试验的方法分析各个通道中差异基因富集的显著性。
2 结 果
2.1 依据Fine数据库进行细胞类型注释,SCCOHT中存在4种细胞亚群和12个细胞亚簇
利用marker基因和单细胞测序细胞类型注释软件SingleR[10]相结合,注释细胞类型。SingleR软件以RNAseq的数据资料为参照系,选取高变异的基因,经过反复比较和循环运算,最后得出一种预测细胞类型的注解结果(图1)。
参照Main数据库进行比对与注释提供的信息比较简略,除C10细胞亚群被定义为巨噬细胞以外,其余所有细胞亚群被定义为神经细胞。而与Fine数据库进行对比注释提供的信息相对丰富。其中,C1、C3、C4、C6、C7细胞亚群被定义为诱导性多能干细胞(induced pluripotent stem cell,iPSC),C0、C2、C5、C8、C11细胞亚群被定义为神经施万细胞,C9被定义为神经上皮细胞,C10被定义为巨噬细胞。虽然在两种数据库的比对与注释之下,均未定义出经典的卵巢肿瘤细胞或肿瘤上皮细胞,但Fine数据库可以提供更加丰富的信息与结果,因此采用Fine数据库的比对结果进行后续分析。
对相同细胞亚群进行合并,发现iPSC细胞亚群占比超过50%,在本次获取的样本中占比最多,神经施万细胞占比仅次于iPSC细胞亚群,神经上皮细胞占比较少,而巨噬细胞数量最少。
2.2 SCCOHT肿瘤微环境中细胞亚群的恶性程度
在细胞的生长、分化过程中,各个细胞状态是一个不断发生变化的过程,肿瘤内不同细胞所处的生长分化状态也有所不同,拟时序(pseudotime)分析就是通过特殊计算了解所有基因表达模式,并将每个细胞安排在自己的生长和分化轨迹上。为进一步了解细胞亚群之间的分化变化情况,我们利用Monocle软件进行pseudotime分析。
在进行pseudotime分析后,发现5个关键的细胞分化时间节点(图2)。在细胞分化的时间轨迹上将细胞亚群所处的分化阶段进行定位与分析,发现各细胞簇所处的分化时间有所不同。
为进一步明确样本中恶性程度高的细胞亚群,应用scCancer分析明确每一个细胞和细胞亚群的恶性程度得分[11]。通过与数据库参考的恶性程度分值进行对比,发现本样本中所有细胞组分的恶性程度评分均高于参考值,即与参考库相比,本样本所含细胞均为恶性(图3)。
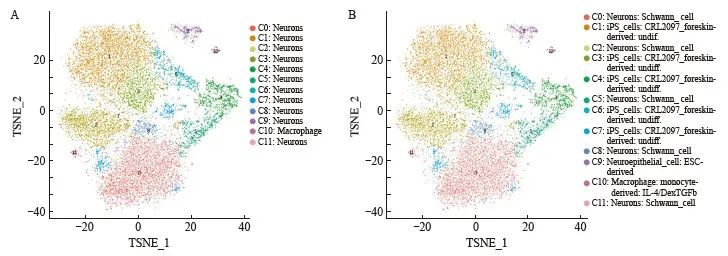
图1 细胞注释后依据cluster的TSNE可视化结果
Fig. 1 Visualization results of TSNE based on cluster after cell annotation
A: Results refered to Main database; B: Results refered to Fine database.
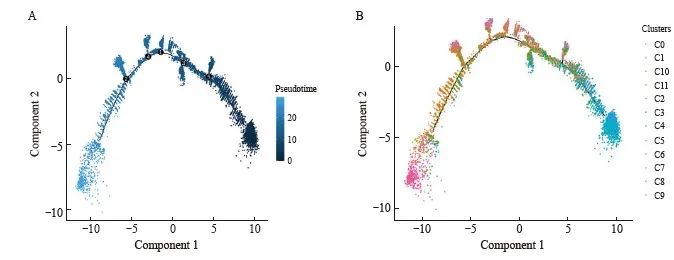
图2 细胞分化时间与亚群细胞分化轨迹展示
Fig. 2 Display of cell differentiation time and subpopulation cell differentiation track
A: Display of cell differentiation time; B: Display of cell differentiation track.
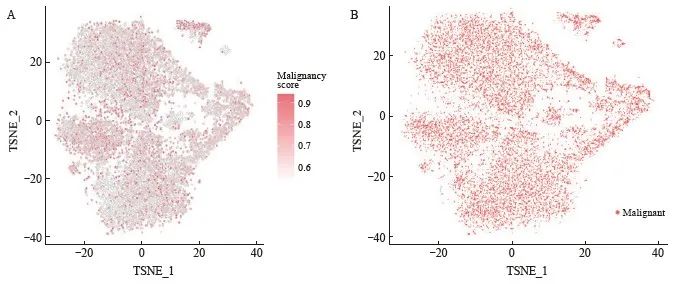
图3 恶性程度分值及恶性程度分类的TSNE可视化结果
Fig. 3 TSNE visualization results of malignant degree score and classification
A: Visualization results of malignant degree scores. Each cell subpopulation contains cell components with high malignant degree scores; B: Visualization results of classification of malignant degree. Except for a few macrophages, other cells are defined as malignant.
2.3 iPSC细胞亚群显著上调基因富集于细胞周期调控通路
根据之前的实验结果,对于SCCOHT这种罕见疾病,仅依靠scRNA-seq暂时无法明确其内部关键的细胞亚群。本研究发现,有超过50%细胞被定义为iPSC,这一亚群中存在最多的分化时间较晚、恶性程度较高的细胞亚簇。既往文献[12-13]报道,干细胞主要分为3种基本类型,包括胚胎干细胞(embryonic stem cell,ESC)、肿瘤干细胞(cancer stem cell,CSC)和iPSC。这3种主要的多能干细胞类型都具有同样的干性、组织再生功能和机体自我更新能力等独特性质[12]。与其他干细胞不同,ESC在正常生理条件下几乎不存在致瘤性,而CSC和iPSC都具备一定的致瘤特性[12]。因此,iPSC很可能是影响SCCOHT复发、进展等恶性行为的关键细胞亚群。
对iPSC与非iPSC进行差异基因功能富集GO和KEGG分析,结果显示,在多能干细胞细胞亚群中显著上调的基因功能主要富集于细胞周期、细胞分裂等相关功能调控通路。其中,PLK1基因显著上调,且涉及最多的信号转导通路 (图4)。
2.4 SMARCA4和PLK1蛋白在SCCOHT细胞系、人卵巢正常上皮细胞系及高级别浆液性卵巢癌细胞系中的表达水平
为明确SMARCA4和PLK1蛋白在SCCOHT细胞系中的表达水平,检测了SMARCA4和PLK1蛋白在SCCOHT细胞系COV434、人卵巢正常上皮细胞系IOSE80和高级别浆液性卵巢癌细胞系OVCAR8中的表达水平。结果显示,在COV434细胞中,SMARCA4蛋白不表达,PLK1表达水平明显升高,并且显著高于IOSE80(P=0.001)及OVCAR8(P=0.001)。而在OVCAR8细胞中,SMARCA4和PLK1蛋白有表达,SMARCA4蛋白表达水平高于IOSE80细胞(P=0.001)和COV434(P=0.001),PLK1蛋白表达水平低于IOSE80细胞(P=0.001)和COV434细胞(P=0.001,图 5)。
2.5 SMARCA4和PLK1 mRNA在SCCOHT细胞系、人卵巢正常上皮细胞系及高级别浆液性癌细胞系中的转录水平
为进一步明确SMARCA4和PLK1 mRNA在SCCOHT细胞系中的转录水平,检测SMARCA4和PLK1 mRNA在SCCOHT细胞系COV434、人卵巢正常上皮细胞系IOSE80和高级别浆液性癌细胞系OVCAR8中的转录水平。结果显示,在COV434细胞中,SMARCA4 mRNA水平显著低于IOSE80细胞(P=0.001)和OVCAR8细胞(P=0.001),PLK1 mRNA水平显著高于IOSE80细胞(P=0.007)及OVCAR8细胞(P=0.002,图6)。
2.6 PLK1在SCCOHT肿瘤组织中的表达水平
进一步通过免疫组织化学染色比较SCCOHT患者肿瘤组织中及因良性病变行手术治疗患者的卵巢组织中PLK1的表达。结果显示,正常卵巢组织中PLK1表达阳性率较低,SCCOHT中PLK1都有不同程度的表达,说明PLK1不仅在SCCOHT细胞系中高表达,在SCCOHT肿瘤组织中也呈高表达,提示PLK1高表达可能是SCCOHT中的一种常见事件(图7)。
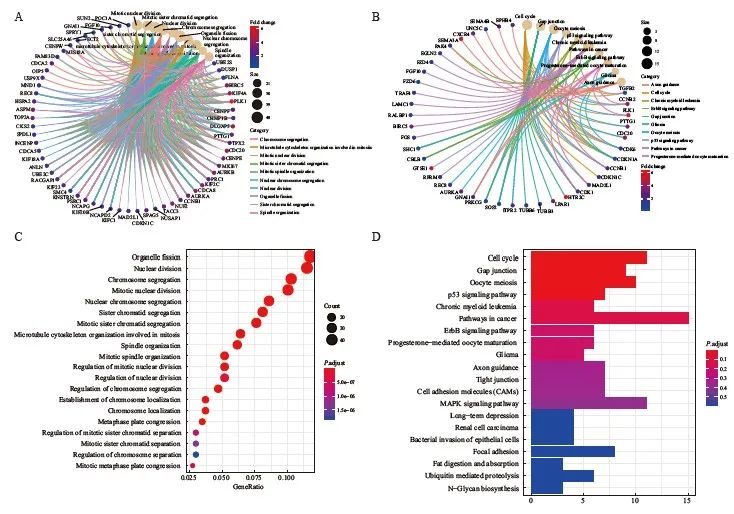
图4 对iPSC与非iPSC进行差异基因功能富集分析
Fig. 4 Differential gene function enrichment analysis was conducted for iPSC and non iPSC
A, C: GO analysis of the differential genes between iPSC and non iPSC indicates that the differential genes are mainly enriched in mitosis, mitosis, chromosome separation and other functions, of which PLK1 gene is significantly up-regulated; B, D: KEGG analysis of the differential genes between iPSC and non iPSC indicates that the differential genes are mainly enriched in tumor related pathways, cell cycle regulation, oocyte division, etc., of which PLK1 gene is significantly up-regulated.
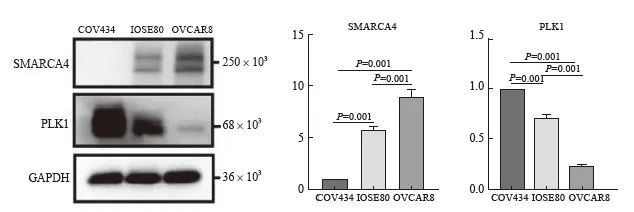
图5 SMARCA4和PLK1蛋白在SCCOHT细胞系COV434、卵巢正常上皮细胞系IOSE80
和高级别浆液性卵巢癌细胞系OVCAR8中的表达情况
Fig. 5 Expression of SMARCA4 and PLK1 proteins in SCCOHT cell line COV434, normal ovarian epithelial cell line IOSE80 and high-grade serous ovarian cancer cell line OVCAR8
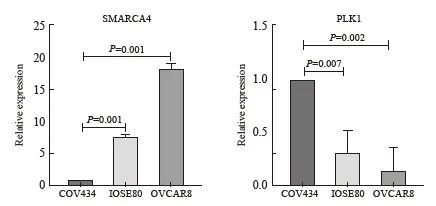
图6 SMARCA4和PLK1 mRNA在SCCOHT细胞系COV434、人卵巢正常上皮细胞系IOSE80
和高级别浆液性癌细胞系中OVCAR8的表达情况
Fig. 6 The expression of SMARCA4 and PLK1 mRNA in SCCOHT cell line COV434, human ovarian normal epithelial cell line IOSE80 and high-grade serous carcinoma cell line OVCAR8
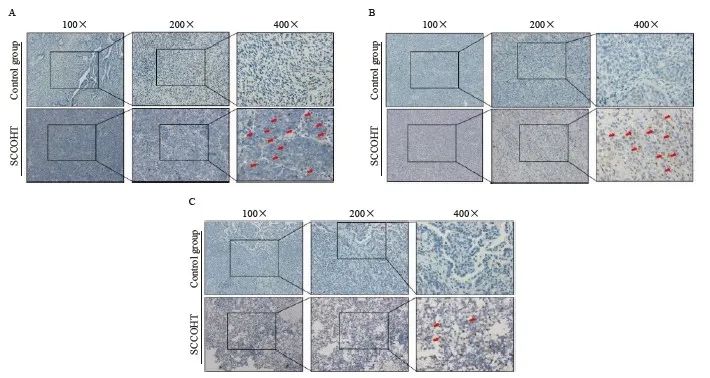
图7 PLK1蛋白在SCCOHT组织切片中的表达情况
Fig. 7 Expression of PLK1 protein in SCCOHT tissue ps
A: Control represented ovarian tissue resected from a patient diagnosed as ovarian endometrioid cyst; SCCOHT represented surgical rep of patient A diagnosed as SCCOHT. B: Control represented ovarian tissue resected from a patient diagnosed as ovarian cyst; SCCOHT represented surgical rep of patient B diagnosed as SCCOHT. C: Control represented ovarian tissue resected from a patient diagnosed as ovarian endometrioid cyst; SCCOHT represented recurrence patient C diagnosed as SCCOHT.
3 讨 论
本研究分别利用Single R[10]及Marker基因联合分析,参考Main数据库和Fine数据库对细胞亚群进行注释。Main数据库提供的信息相对简略,Fine数据库提供的信息相对丰富。在Main数据库的对比注释结果中,除C10细胞亚群被定义为巨噬细胞以外,其余所有细胞亚群被定义为神经细胞。而与Fine数据库进行对比注释后,C1、C3、 C4、C6、C7细胞亚群被定义为iPSC,C0、C2、C5、C8、C11细胞亚群被定义为神经施万细胞,C9被定义为神经上皮细胞,C10被定义为巨噬细胞。
对比两种数据库的注释结果,发现在两种数据库的参照比对下均未定义出经典的卵巢肿瘤细胞或卵巢上皮细胞。分析原因,一方面可能是由于本例卵巢肿瘤组织取自盆腔复发病灶组织,并不是来自于卵巢;另一方面可能是由于SCCOHT发病率低,目前尚未有研究描绘出SCCOHT的单细胞转录组图谱;更重要的是,SCCOHT的基因组和转录组特点为SMARCA4基因的失活突变[14],进而导致其在mRNA水平无法被检测出,而scRNA-seq是通过转录组中获取高表达的基因来进行细胞分类,因此无法直接定义出SCCOHT细胞亚群。
虽然两个数据库作为参考均未定义出经典的卵巢肿瘤细胞,但Fine数据库比Main数据库可以提供更加详细的注释信息,因此,本研究采用Fine数据库的注释结果进行后续分析。在Fine数据库的注释结果中,C0、C2、C5、C8、C11细胞簇被定义为神经施万细胞,C9被定义为神经上皮细胞,这与SCCOHT的神经-内分泌细胞起源学说相符[15];C10被定义为巨噬细胞,但数量极少,验证了SCCOHT的免疫微环境具有较少的免疫细胞浸润[16];C1、C3、C4、C6、C7细胞簇被定义为iPSC,占据超过样本的50%细胞量,且具有干性[13],可能是SCCOHT中的关键细胞亚群。
众所周知,干细胞主要包括ESC、CSC和iPSC[12]。CSC、iPSC和ESC等也都同样具有干性和细胞自我更新修复等独特能力。在正常生理状况下,ESC不具备致瘤性,而CSC和iPSC却能在特定的环境下导致肿瘤发生、进展,也可能导致临床治疗肿瘤过程中不断出现的药物耐药、复发和转移等问题[17]。与CSC和ESC不同,iPSC是由人工在体外诱导得到的,目的是将此项技术应用于临床再生医学领域。临床再生医学在展现出广泛的技术应用和产业潜力的同时,也对其应用的安全性提出了更高的要求。
本研究将12个细胞簇中相同细胞亚群合并后进行TSNE可视化分析发现,iPSC细胞亚群组成的细胞数量多,iPSC具有多能干性和致瘤性,因此,我们认为iPSC可能是SCCOHT中独特的细胞亚群,与SCCOHT高度恶性、易复发、易进展相关。
本研究对iPSC细胞亚群与niPSs细胞亚群进行差异表达基因富集分析,结果显示,在多能干细胞细胞亚群中显著上调的基因功能主要富集于细胞周期调控通路。其中,PLK1基因显著上调,且涉及最多的信号转导通路。
PLK1是一种丝氨酸/苏氨酸蛋白激酶,普遍存在于人类真核细胞组织中,结构高度保守[18]。1988年POLO基因首次于果蝇体内被发现,随后有研究报道了PLK1基因的功能[18]。在细胞有丝分裂进程中,PLK1主要在G2/M期转化、姐妹染色单体分离、中心体成熟及有丝分裂后期细胞质分裂等4个方面参与细胞有丝分裂调控,并且参与控制有丝分裂过程的正常启动和退出[19]。除参加正常的细胞有丝分裂调控以外,还参与肿瘤的发生、发展过程,尽管PLK1作为癌基因的证据仍然不足,但越来越多的证据表明PLK1参与肿瘤发生。
在SCCOHT细胞系、SCCOHT患者的肿瘤组织中均能检测到PLK1蛋白表达的升高,在SCCOHT细胞系中也能检测到PLK1 mRNA水平的升高,说明PLK1的表达升高可能是SCCOHT中的一种常见事件,PLK1可能在SCCOHT的发生、发展中发挥作用,并且也预示着PLK1可能成为高钙血症型小细胞卵巢癌治疗的潜在靶点。
本研究首次将scRNA-seq应用于SCCOHT这一罕见的妇科肿瘤领域,为以SCCOHT为代表的罕见疾病的基础研究和临床治疗方案制订提供了新思路。通过scRNA-seq,初步描绘了SCCOHT独特的单细胞图谱,鉴定出SCCOHT中存在iPSC这一关键细胞亚群,并寻找到在关键细胞亚群中显著上调的PLK1基因,进一步在生物信息学、细胞学、临床组织样本中进行了验证,发现PLK1可能成为治疗SCCOHT的潜在靶点。
本研究是通过对1例SCCOHT病例的盆腔复发病灶组织样本进行scRNA-seq开展的,尚缺乏在大规模的临床病例中进行单细胞水平的验证和对照。同时,复发病灶与原发病灶之间的单细胞图谱或许存在一定差异,但由于SCCOHT的确诊往往依赖于术后病理学检查、基因检测报告及家族史等的综合诊断,而单细胞测序要求组织保持细胞活性,因此对于原发病灶的获取并行scRNA-seq较为困难。在细胞注释过程中,未注释出上皮细胞或肿瘤细胞,这可能与SCCOHT罕见性有关,关于恶性细胞的鉴定与注释仍需进一步分析。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] 汪 璟, 刘 浏, 李 可, 等. 卵巢高钙血症型小细胞癌研究进展[J]. 中国实用妇科与产科杂志, 2019, 35(10): 1166-70.
WANG J, LIU L, LI K, et al. Research progress of small cell carcinoma of ovary with hypercalcemia[J]. Chin J Pract Gynecol Obstet, 2019, 35(10): 1166-70.
[2] YOUNG R H, OLIVA E, SCULLY R E. Small cell carcinoma of the ovary, hypercalcemic type. A clinicopathological analysis of 150 cases[J]. Am J Surg Pathol, 1994, 18(11): 1102-1116.
[3] 徐燕宁, 刘易欣, 陈 凌. 卵巢高钙血症型小细胞癌的研究进展[J]. 国际妇产科学杂志, 2021, 48(5): 548-552.
XU Y N, LIU Y X, CHEN L. Advances in small cell carcinoma of the ovary-hypercalcemic type[J]. J Int Obstet Gynecol, 2021, 48(5): 548-552.
[4] BELL E H, CHAKRABORTY A R, MO X K, et al. SMARCA4/BRG1 is a novel prognostic biomarker predictive of cisplatinbased chemotherapy outcomes in resected non-small cell lung cancer[J]. Clin Cancer Res, 2016, 22(10): 2396-2404.
[5] TUMEH P C, HARVIEW C L, YEARLEY J H, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance[J]. Nature, 2014, 515(7528): 568-571.
[6] WANG Y M, CHEN S Y, COLBORNE S, et al. Histone deacetylase inhibitors synergize with catalytic inhibitors of EZH2 to exhibit antitumor activity in small cell carcinoma of the ovary, hypercalcemic type[J]. Mol Cancer Ther, 2018, 17(12): 2767-2779.
[7] LANG J D, HENDRICKS W P D, ORLANDO K A, et al. Ponatinib shows potent antitumor activity in small cell carcinoma of the ovary hypercalcemic type (SCCOHT) through multikinase inhibition[J]. Clin Cancer Res, 2018, 24(8): 1932-1943.
[8] XUE Y B, MEEHAN B, MACDONALD E, et al. CDK4/6 inhibitors target SMARCA4-determined cyclin D1 deficiency in hypercalcemic small cell carcinoma of the ovary[J]. Nat Commun, 2019, 10: 558.
[9] KARNEZIS A N, CHEN S Y, CHOW C, et al. Re-assigning the histologic identities of COV434 and TOV-112D ovarian cancer cell lines[J]. Gynecol Oncol, 2021, 160(2): 568-578.
[10] ANGERER P, HAGHVERDI L, BÜTTNER M, et al. Destiny: diffusion maps for large-scale single-cell data in R[J]. Bioinformatics, 2016, 32(8): 1241-1243.
[11] LEVINE J H, SIMONDS E F, BENDALL S C, et al. Data-driven phenotypic disp of AML reveals progenitor-like cells that correlate with prognosis[J]. Cell, 2015, 162(1): 184-197.
[12] BACAKOVA L, ZARUBOVA J, TRAVNICKOVA M, et al. Stem cells: their source, potency and use in regenerative therapies with focus on adipose-derived stem cells-a review[J]. Biotechnol Adv, 2018, 36(4): 1111-1126.
[13] OHNUKI M, TAKAHASHI K. Present and future challenges of induced pluripotent stem cells[J]. Philos Trans R Soc Lond B Biol Sci, 2015, 370(1680): 20140367.
[14] WITKOWSKI L, CARROT-ZHANG J, ALBRECHT S, et al. Germline and somatic SMARCA4 mutations characterize small cell carcinoma of the ovary, hypercalcemic type[J]. Nat Genet, 2014, 46(5): 438-443.
[15] HARRISON M L, HOSKINS P, DU BOIS A, et al. Small cell of the ovary, hypercalcemic type: analysis of combined experience and recommendation for management. A GCIG study[J]. Gynecol Oncol, 2006, 100(2): 233-238.
[16] JELINIC P, RICCA J, VAN OUDENHOVE E, et al. Immuneactive microenvironment in small cell carcinoma of the ovary, hypercalcemic type: rationale for immune checkpoint blockade[J]. J Natl Cancer Inst, 2018, 110(7): 787-790.
[17] NASSAR D, BLANPAIN C. Cancer stem cells: basic concepts and therapeutic implications[J]. Annu Rev Pathol, 2016, 11: 47-76.
[18] HAMANAKA R, MALOID S, SMITH M R, et al. Cloning and characterization of human and murine homologues of the drosophila polo serine-threonine kinase[J]. Cell Growth Differ, 1994, 5(3): 249-257.
[19] TONG C, FAN H Y, LIAN L, et al. Polo-like kinase-1 is a pivotal regulator of microtubule assembly during mouse oocyte meiotic maturation, fertilization, and early embryonic mitosis[J]. Biol Reprod, 2002, 67(2): 546-554.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







