航天中心医院王玉敏、陈济超团队Drug Resistance Updates综述:诱导铜死亡与肿瘤耐药逆转
2023-11-20 BioMed科技 BioMed科技 发表于上海
本文以2022年新发现的调节性细胞死亡铜死亡为出发点,详细概述了铜稳态和铜代谢失调在肿瘤中的作用。
2023年11月11日,航天中心医院/北京大学航天临床医学院王玉敏教授和陈济超教授在Drug Resistance Updates发表题为Cuproptosis: A novel therapeutic target for overcoming cancer drug resistance的近叁万字、引用368篇文献的长文观点综述。提出了诱导铜死亡治疗治疗和逆转肿瘤耐药的治疗策略。本文以2022年新发现的调节性细胞死亡铜死亡为出发点,详细概述了铜稳态和铜代谢失调在肿瘤中的作用,回顾了铜研究和铜死亡的研究历史(Fig 1),随后从系统、全面的角度总结了铜螯合剂(Copper chelators)、铜离子载体(Copper ionophores )、铜配合物依赖的动力疗法抗肿瘤研究现状,进一步总结了铜配合物和铜配合物逆转肿瘤耐药的机理,最后总结了小分子化合物和纳米药物诱导铜死亡抗肿瘤耐药的最新进展。同时,作者深入讨论了未来的研究方向,这可能会激发更深的思考,促进铜死亡抗肿瘤研究领域发展。
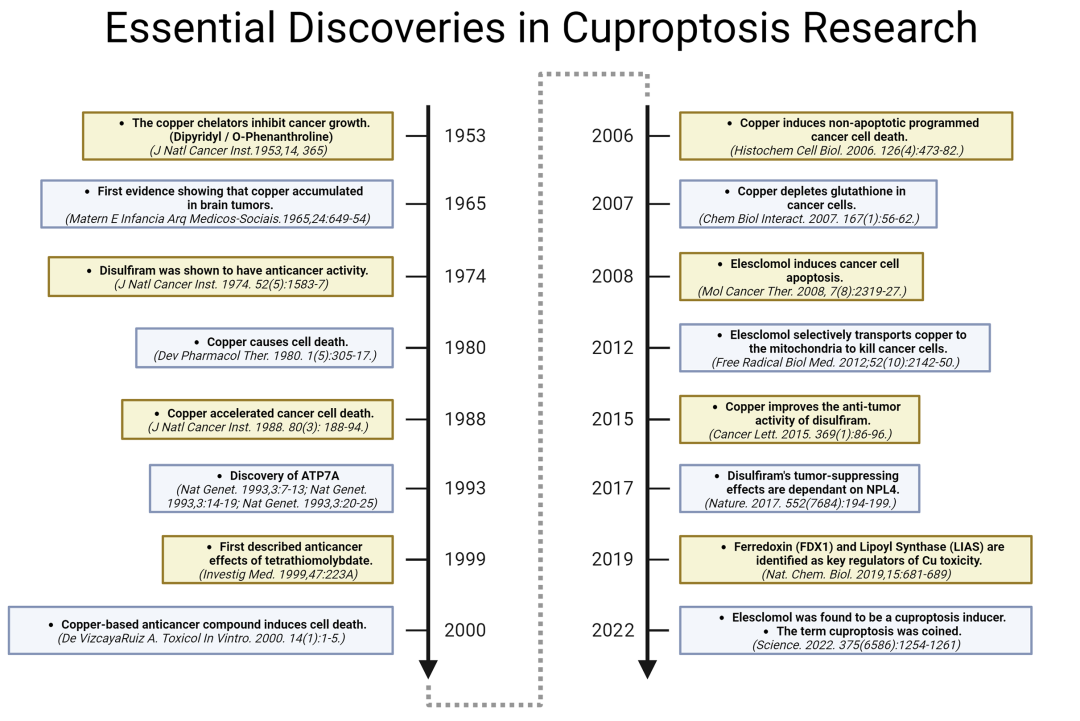
Fig 1.铜死亡的研究历史和重要发现的时间点。
铜(Cu)是一种必需的微量营养素,在广泛的生物过程中充当关键的催化辅因子,包括线粒体呼吸、抗氧化应激和生物化合物合成等。Cu积累或缺乏对健康有不利影响,无法维持Cu平衡与多种病理状况有关,包括Wilson病(WD)、神经退行性疾病、癌症和心血管疾病等。细胞内Cu含量的稳态调节受Cu依赖性蛋白质的复杂网络影响,包括铜酶、Cu伴侣蛋白和膜转运蛋白。这些蛋白质协同工作以协调Cu的输入、输出和细胞内利用,从而将细胞内的Cu水平维持在特定范围内,这有助于防止Cu过载和Cu缺乏的后果(Fig 2 和Fig 3)。
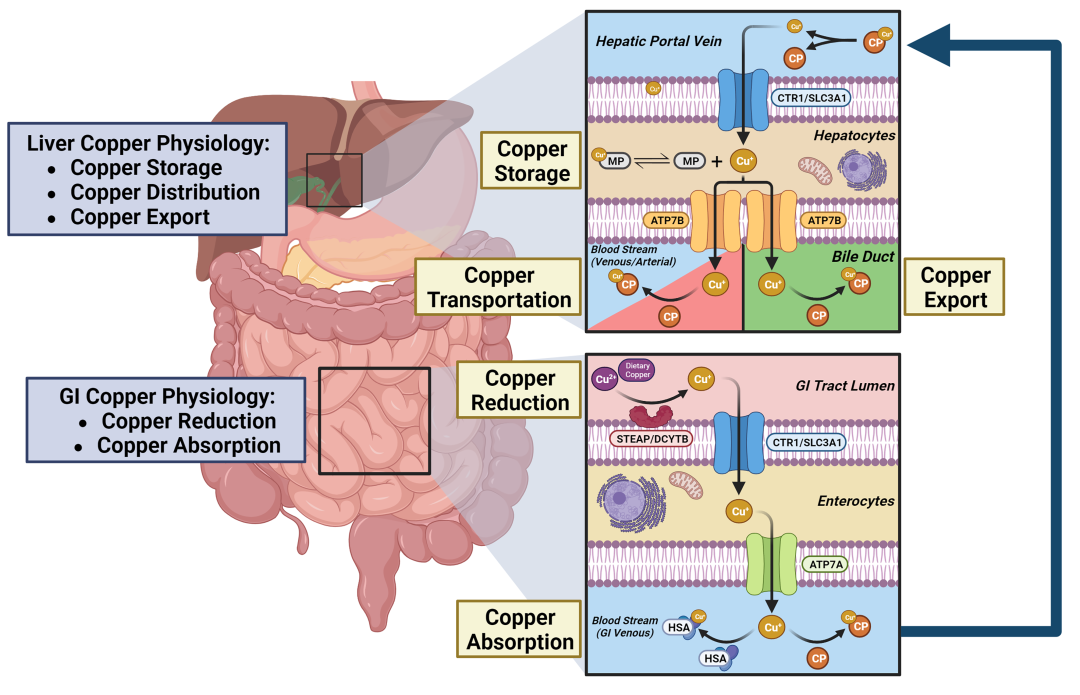
Fig 2. 生理系统中的铜稳态。
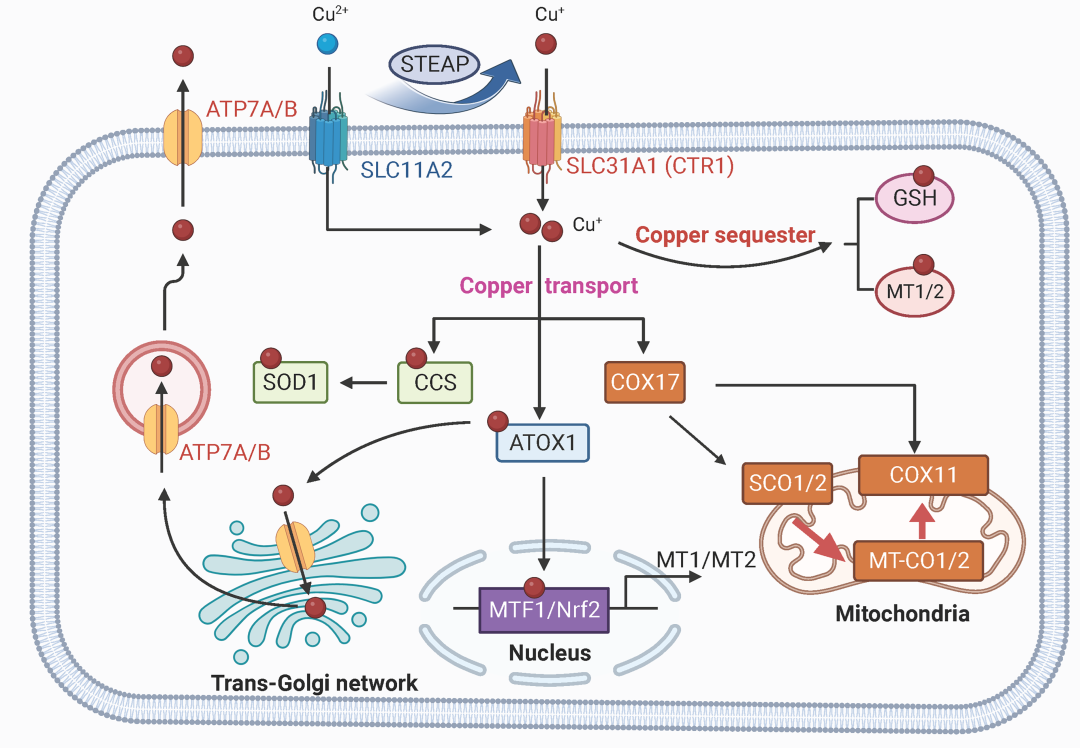
图3.哺乳动物细胞水平铜代谢。
基于铜诱导细胞死亡的主要发现,2022年3月被麻省理工学院和哈佛大学Broad研究所的研究人员发表在Science期刊上提出铜死亡概念。过量的细胞内Cu2+可以通过离子载体转运到线粒体,铁氧还蛋白 (Ferredoxin, FDX1)将Cu2+还原为Cu+,Cu+含量的增加直接与脂酰化的二氢脂酰胺S-乙酰基转移酶(dihydrolipoamide S-acetyltransferase, DLAT)结合,导致脂酰化蛋白聚集和Fe-S簇蛋白的不稳定,导致蛋白毒性应激,最终导致铜死亡(Fig 4)。
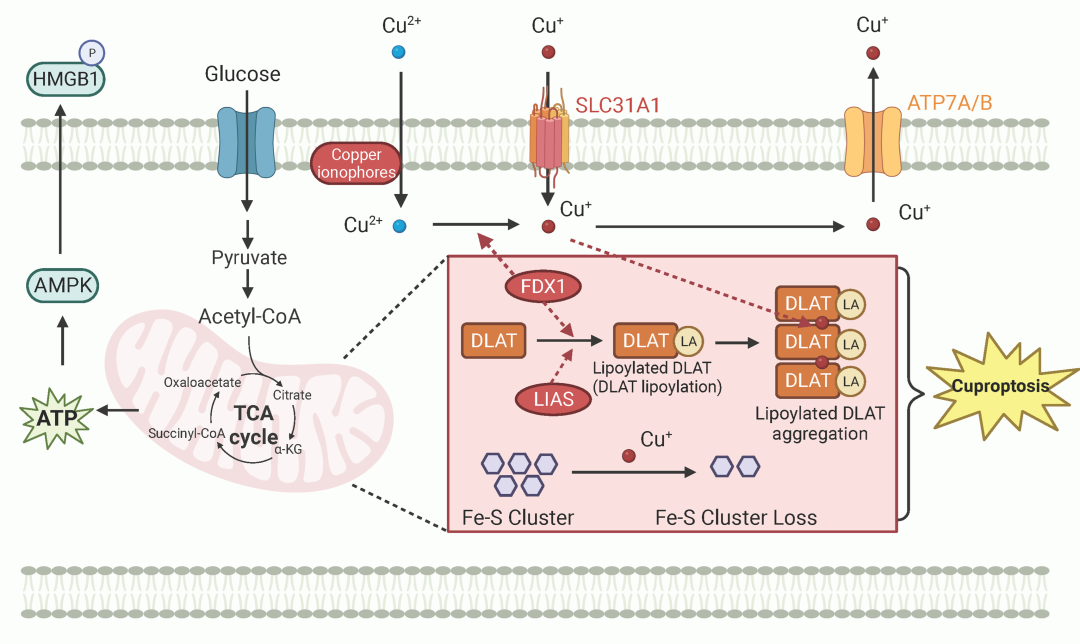
Fig 4.铜死亡核心机制。
一些小分子化合物和纳米药物通过诱导铜死亡能够达到杀死癌症细胞的作用,这将为未来通过诱导铜死亡开发抗癌药物提供新的线索(Fig 5)。靶向铜死亡可能是一种新的抗肿瘤疗法和克服耐药性的治疗策略本文指出,对铜死亡作用的研究是一个新兴领域,仍处于初级阶段。仍存在不可避免的挑战。首先,人们对铜死亡是如何触发和最终执行知之甚少。其次,缺乏有效且已证实的铜死亡抑制剂或诱导剂,这给揭示铜死亡在疾病中的作用带来了困难。第三,铜死亡在癌症中的作用还不清楚。第四,癌症铜死亡的调节机制有待进一步揭示。第五,迫切需要铜死亡的特异性生物标志物来预测铜死亡诱导的效率。第六,铜死亡可能导致病理状况,如神经退行性疾病。因此,诱导铜死亡进行治疗可能是一把双刃剑,并导致意想不到的毒性和损伤。第七,诱导铜死亡可以克服对常规化疗的耐药性,但尚不清楚诱导铜死亡是否可以克服对靶向治疗和免疫疗法的耐药性。第八,可以想象,线粒体质量控制系统线粒体特异性自噬或线粒体自噬的激活可能会限制铜死亡。然而,包括泛素-蛋白酶体系统和自噬在内的蛋白质降解机制如何调节和控制铜死亡值得进一步研究。
总之,铜死亡被认为是一种新型调节性细胞死亡,可以杀死癌症细胞。因此,诱导铜死亡在癌症治疗中具有很大的前景,尤其是与常规化疗相结合。诱导铜死亡可能是一种很有前途的治疗方案,可以杀死癌症细胞并克服肿瘤耐药性。
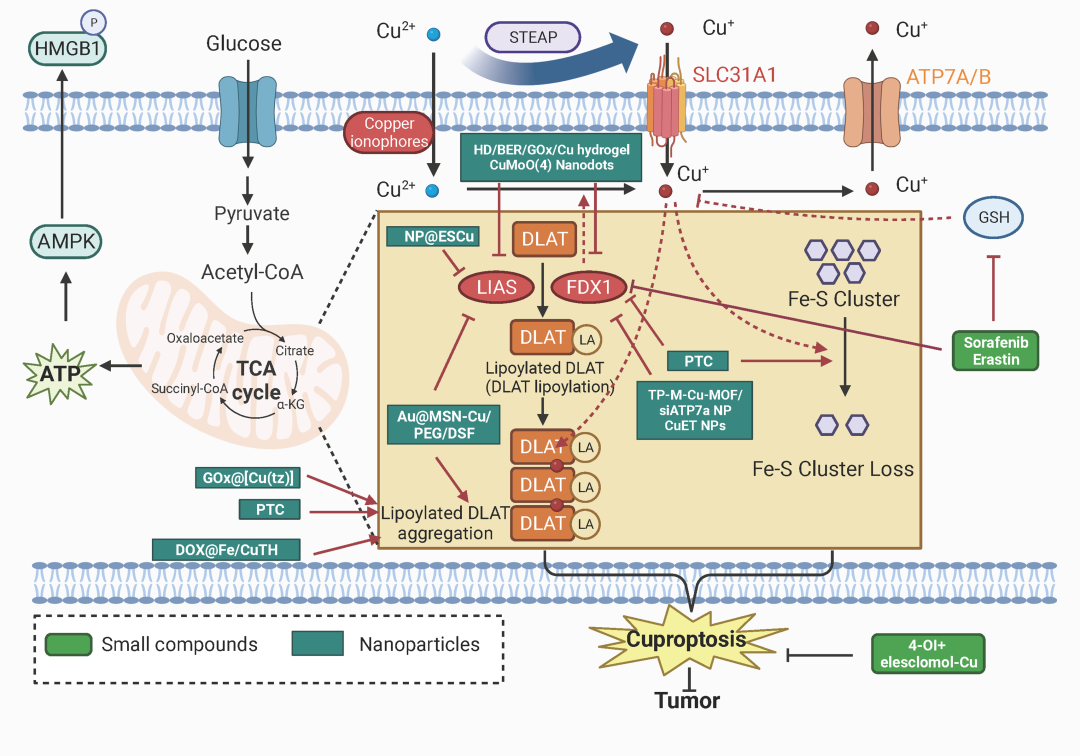
Fig 5.药物诱导铜中毒的小化合物和纳米颗粒杀死癌症细胞。
航天中心医院/北京大学航天临床医学院呼吸与危重症医学科王玉敏教授/主任医师、中山大学肿瘤防治中心(胃外科)李元方博士、呼和浩特市第一医院肝胆外科张俊晶博士/教授为该论文共同第一作者,中国医学科学院/北京协和医学院药物研究所杨艺辉博士、美国St. John’s University药学系Joshua S. Fleishman博士、中南大学湘雅二医院普外科(肝胆外科)王焱博士为共同作者,中国医学科学院/北京协和医学院药物研究所王金华教授做出重要贡献,王玉敏教授、中山大学肿瘤防治中心(胃外科)陈永明教授以及王洪权教授为本文共同通讯作者。
参考文献:
Yumin Wang#*, Yongming Chen#, Junjing Zhang#, Yihui Yang, Joshua S. Fleishman, Yan Wang, Jinhua Wang, Jichao Chen, Yuanfang Li*, Hongquan Wang*.Cuproptosis: a novel therapeutic target for overcoming cancer drug resistance. Drug Resistance Updates.2024, 72:101018.
原文链接:
https://www.sciencedirect.com/science/article/pii/S1368764623001012
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肿瘤耐药# #铜死亡# #铜稳态# #铜代谢失调#
36