专家指路:如何追上CRISPR技术快速发展的脚步?
2017-03-09 薄荷 生物通
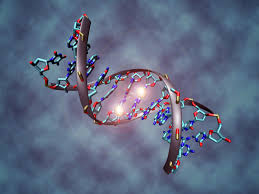
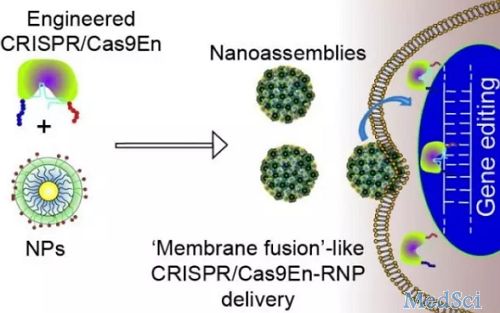
每个月都有一大波新的CRISPR工具来袭。对于这些热门的技术,我们要不要追?怎么追?对此,《The Scientist》杂志请来一些开发人员,对实验室如何采用这些最新技术提出了一些建议。看点1Cas9的“死亡开关”研究人员:加州大学旧金山分校的研究员Joseph Bondy-Denomy背景:尽管Cas9核酸内切酶颇受欢迎,但由于它们有时在细胞内逗留得太久,而引发脱靶效应,故研究人员正在研究C
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CRISPR#
34
#Crispr技术#
31