哈尔滨工程大学杨飘萍团队JACS封面文章:“ETC”策略放大的温和光热疗法和缺陷工程促进多酶活性协同肿瘤个性化抑制
2023-05-05 BioMed科技 BioMed科技 发表于陕西省
本研究首次提出并验证了整合线粒体代谢调控、肿瘤特异性激活诊疗功能和协同辅助治疗的特性,可以安全有效地克服传统温和PTT治疗的局限性。
传统光热疗法(PTT)要在复杂的肿瘤微环境(TME)中实现肿瘤的有效热消融,需要需要将肿瘤温度严格升高超过其耐受阈值(>50 °C)。然而,过度热疗引起的热扩散不可避免地会对周围健康组织造成炎症和热损伤。为了克服这一致命弱点,低温PTT将此温度通常控制在45 ℃以下。然而,一旦出现高于体温5 ℃的热疗条件,癌细胞会异常地过度表达热休克蛋白(HSPs),促进细胞内蛋白质重折叠并进一步加剧其自我保护的耐热性,这极大地损害了治疗效果。为此,哈尔滨工程大学杨飘萍团队报道了一种线粒体靶向的AFCT纳米酶,用(4-羧丁基)三苯基溴化膦(TPP)分子修饰空心介孔Fe掺杂的CeO2(简称为Fe-CeOv)纳米酶,然后担载2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS,一种POD底物),具有TME激活的协同凋亡/铁蛋白诱导能力。通过过渡金属对二氧化铈纳米酶的结构和酶活性的有效调控,一种“ETC干扰和协同辅助治疗”的策略被引入到通过缺陷工程构建的具有多酶活性(类SOD酶、类POD酶和类NADH POD酶)以放大TME特异性激活的的温和PTT抗肿瘤性能。根据密度泛函理论(DFT)计算,验证了其卓越的酶活性源于关键酶活性中心的协同机制,即Fe、Ov和Ce活性位点。在TME的双重刺激(H2O2和弱酸性)时,AFCT纳米酶的类POD酶活性的能够催化类SOD酶活性生成的H2O2产生剧毒的·OH,并将负载的ABTS转化为具有强近红外吸收的氧化形式ABTS·+,特异性地开启其光热和PA成像性能。在低温PTT过程中,由于AFCT纳米酶的类NADH POD酶活性在H2O2的协助下能够催化NADH氧化,进而限制ATP的供应来抑制HSPs的表达,从而大大缓解轻度PTT过程中肿瘤细胞的热耐性,最终改善了温和PTT的疗效。同时,·OH浓度的增加不仅能诱导肿瘤细胞的凋亡,还能进一步促进肿瘤细胞的脂质过氧化(LPO)以启动铁死亡。据我们所知,这是首次将“电子传输链(ETC)干扰和协同佐剂治疗”策略引入到双TME刺激协同激活的纳米酶中,在保证生物安全性的同时实现优良的抗肿瘤效果,该工作为克服传统温和PTT的局限性提供了有效范式。
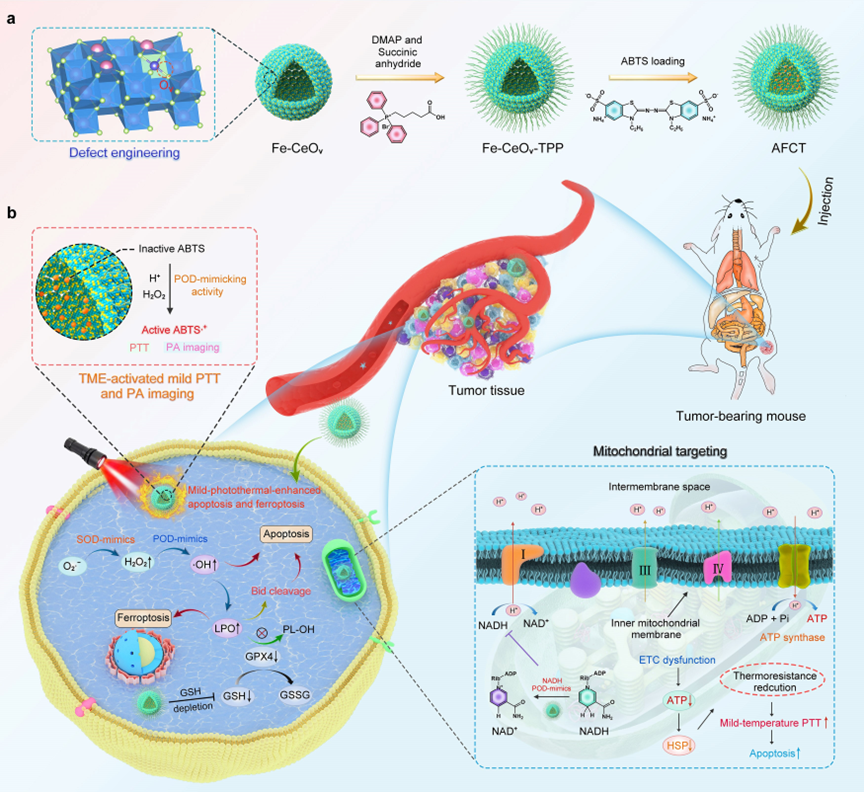
(a)AFCT合成过程示意图及(b)TME激活的细胞凋亡和铁死亡协同抗癌机制
本文要点
(1)基于柯肯达尔效应,合成了中空结构的Fe-CeOv纳米酶,然后将TPP的羧基与Fe-CeOv纳米酶中修饰的氨基偶联获得了Fe-CeOv-TPP纳米酶,赋予其线粒体靶向能力和克服细胞内溶酶体屏障的能力。随后,使用Fe-CeOv-TPP纳米酶为载体进一步担载ABTS,获得AFCT纳米酶。作者对其形貌、晶体结构和化学组成进行了详细的研究。
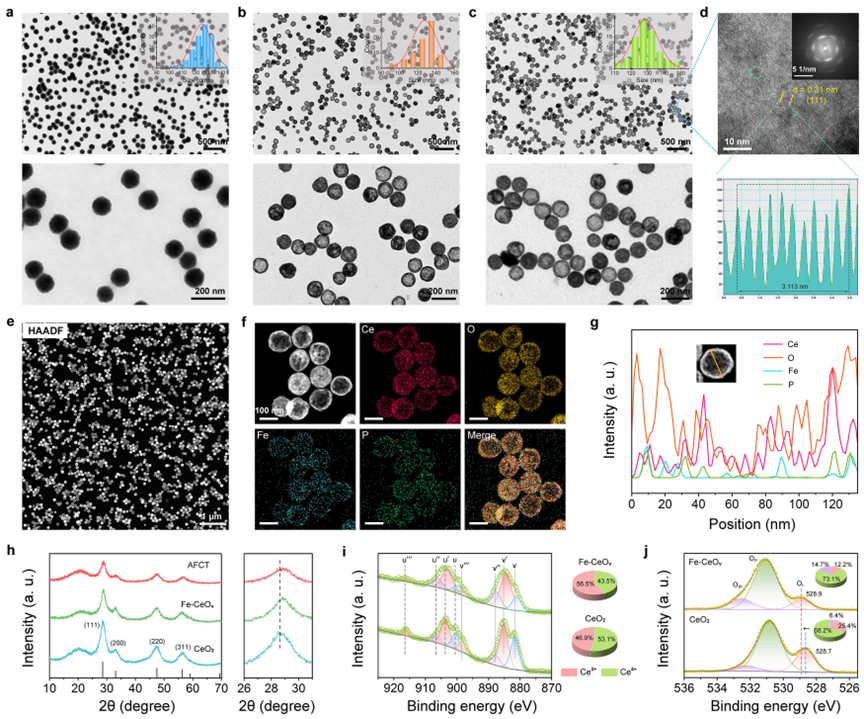
CeO2、Fe-CeOv和Fe-CeOv-TPP纳米酶形貌、晶体结构和化学组成
(2)基于Fe-CeOv纳米酶中丰富的缺陷位点和独特的电子转移特性,作者全面研究了其类酶催化活性。通过体外实验验证了AFCT纳米酶增强的类SOD-,POD-和NADH POD酶活性,并通过DFT计算,阐述了AFCT纳米酶中相关活性位点的协同催化机制:Fe掺杂引起纳米酶的结构重建和随后更多Ov位点的演化;Ov有利于捕获含氧中间体,并同时促进无能量壁垒的HO2·歧化和H2O2解离;Ce位点有利于H2O2*和OH*的脱附。基于Michaelis-Menten稳态动力学,其增强的多酶活性在实验中得到了验证,与理论计算结果一致。
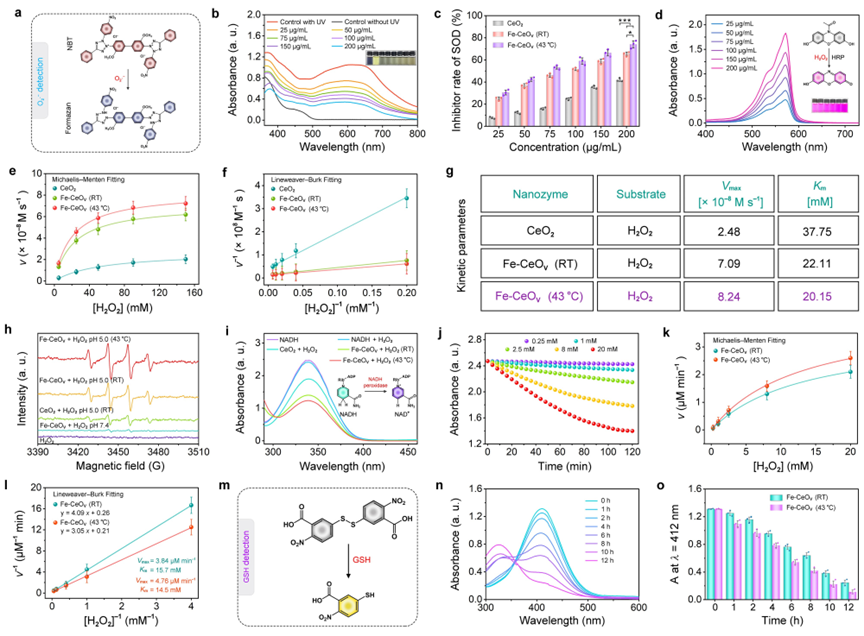
Fe-CeOv纳米酶的多酶催化活性评估。
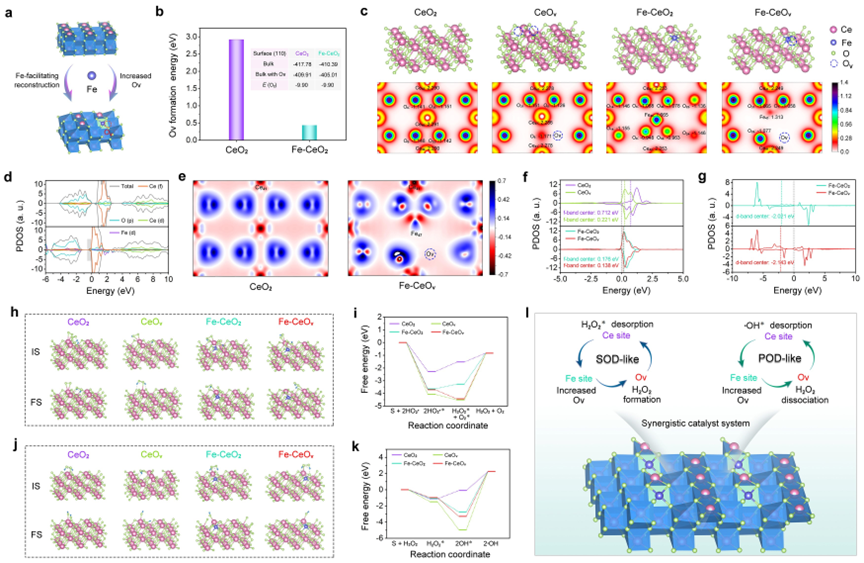
DFT计算和酶的催化机制
(3)AFCT纳米酶在500−900 nm的近红外区域的可激活的光学吸收证实了其H2O2和酸激活的特性,可以作为结合PA成像和光热功能的双刺激(H2O2和弱酸)响应激活的光诊疗剂。作者通过一系列体外光热和PA成像实验,证实了AFCT纳米酶具有H2O2浓度和pH值响应激活的光热性能,且具有良好的光热稳定性。在H2O2和弱酸性的共同刺激下,通过AFCT纳米酶的类POD酶活性可以催化产生的H2O2为剧毒的·OH,同时伴随着将负载的ABTS氧化为具有强近红外吸收的ABTS·+,将非肿瘤区域的非特异性损伤和PA伪信号降到最低。
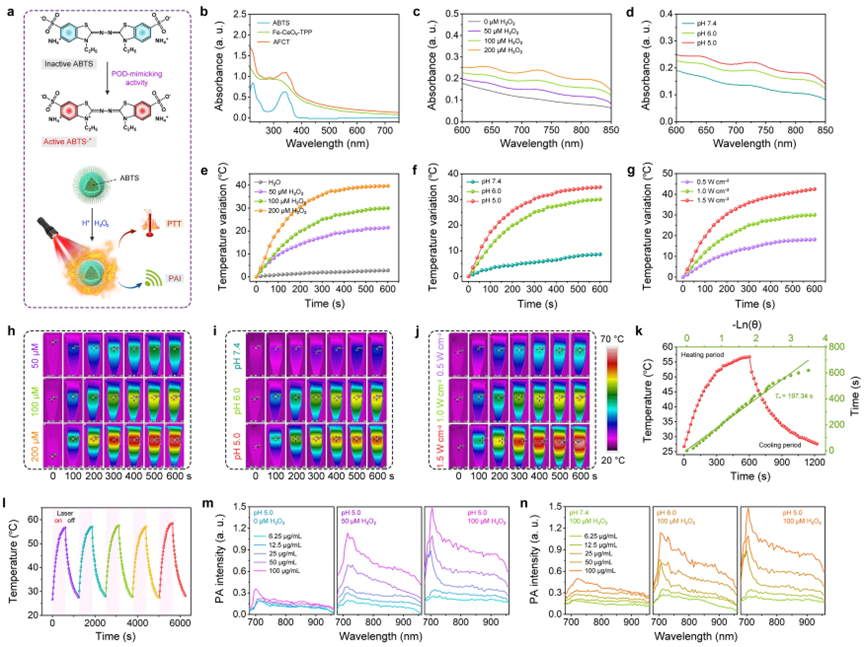
双重刺激激活的AFCT纳米酶的光热特性和PA成像。
(4)作者对AFCT纳米酶的体外协同抗肿瘤特性进行了评估。体外细胞实验评估证实, AFCT纳米酶的类NADH POD酶活性可以在H2O2的协助下催化氧化内源性NADH,通过干扰ETC过程抑制ATP合成,进而导致肿瘤细胞中HSPs的下调以达到放大温和PTT疗效的目的,实现良好的抗肿瘤效果。此外,AFCT纳米酶的GSH消耗活性和TME激活的温和光热效应可以协同抑制4T1细胞中GPX4的表达。同时,生成的·OH不仅可以诱导了肿瘤细胞发生凋亡,而且还能促进LPO的发生,从而启动了铁死亡辅助治疗,特别地是,通过LPO介导的Bid剪切实现了铁死亡和细胞凋亡之间的协同效应。
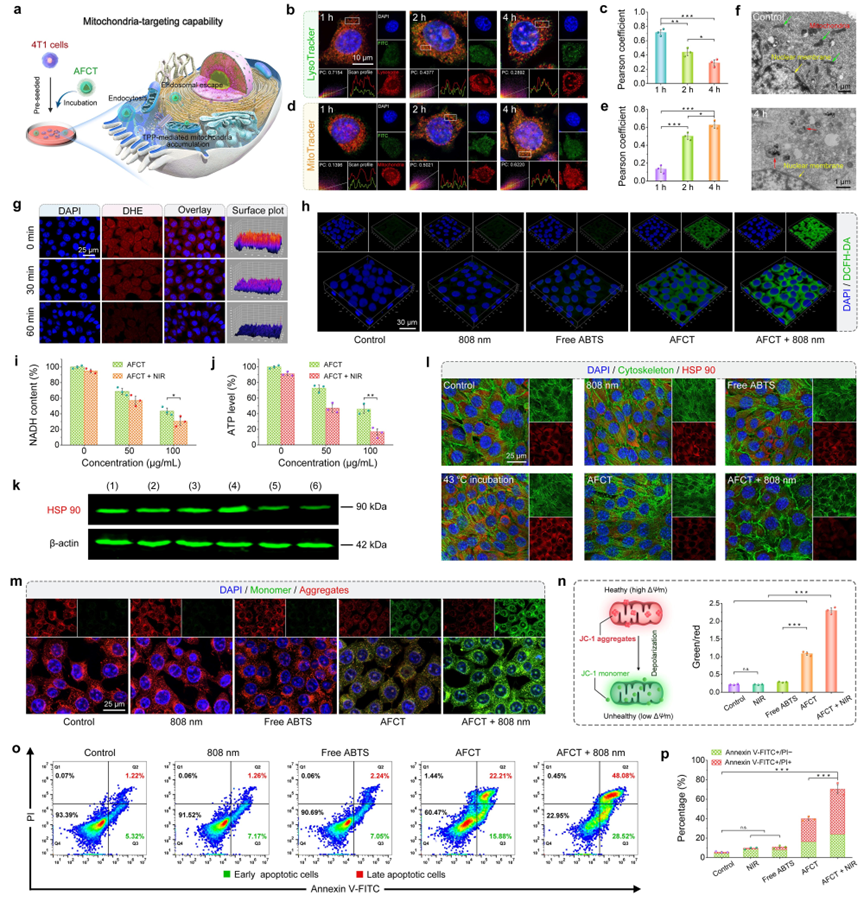
线粒体的积累和体外凋亡的评估。
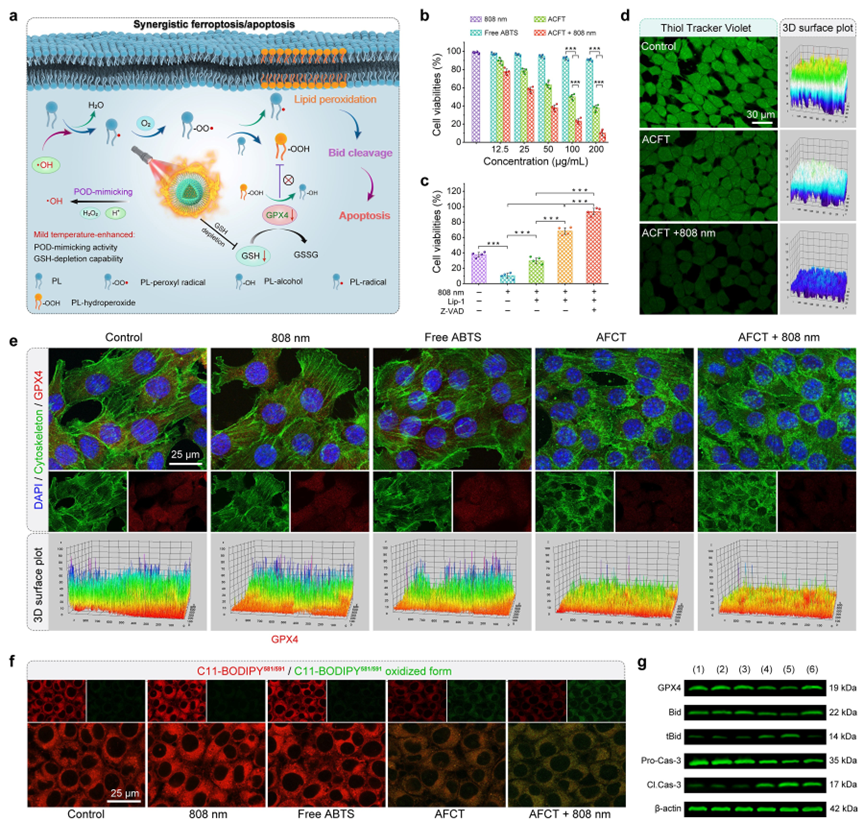
体外协同细胞凋亡和铁死亡
(5)体内抗肿瘤实验验证了TME激活的AFCT纳米酶介导的温和光热增强的协同凋亡/铁死亡治疗可以有效地抑制肿瘤生长,在AFCT + 808 nm组中,肿瘤抑制率高达97.45%,这些结果与细胞水平上的多酶催化活性的评估非常一致。此外,这些AFCT纳米酶可以排出体外,对正常器官组织无毒副作用,具有令人满意的生物相容性,为潜在的体内治疗提供了可能。
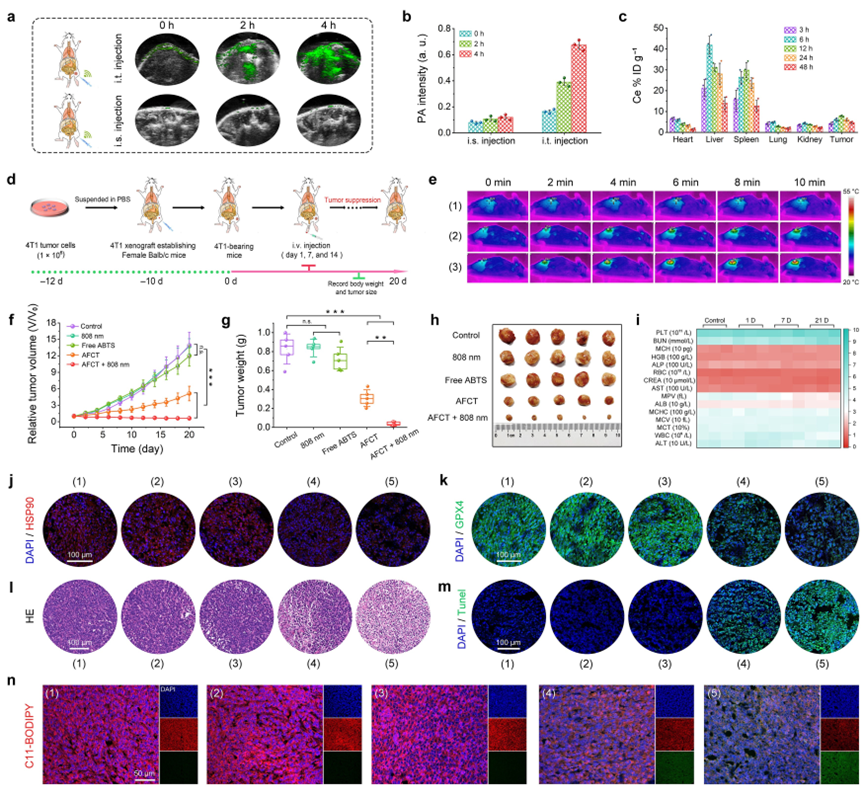
体内TME激活的PA成像引导的协同抗肿瘤治疗
综上所述,本研究首次提出并验证了整合线粒体代谢调控、肿瘤特异性激活诊疗功能和协同辅助治疗的特性,可以安全有效地克服传统温和PTT治疗的局限性。这一成果近期发表在Journal of the American Chemical Society上,并被选为封面文章。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言