【佳作推荐】伊朗德黑兰大学Arash Sadri博士独创JMC综述论文:基于靶标的药物发现真的有效吗?
2023-10-28 ComputArt计算有乐趣 ComputArt计算有乐趣 发表于上海
作者将新药发现效率低下的部分原因归因于TDD的局限性:药物疗效简化为对单一蛋白质的调节的TDD指导思想与生命体调控复杂性相矛盾。
在过去的30年里,基于靶点的药物发现(Target-based drug discovery, TDD)一直是制药行业中首创新药(first-in-class)的主要发现方式。然而,尽管药物筛选技术如高通量筛选(High throughput screening,HTS)等重大技术进步极大加速了活性分子的筛选过程,新药发现的效率仍十分低下。自1950年至2010年,新药研发领域甚至面临“反摩尔定律(Eroom’s Law)”:每10亿美元研发费用对应的FDA批准新药数量每九年下降约一半1。TDD的药物发现模式相较于传统的基于表型的药物发现(Phenotypic drug discovery, PDD)似乎不具优势,并且TDD在现实世界中的真实效率究竟有多高也有待考证。
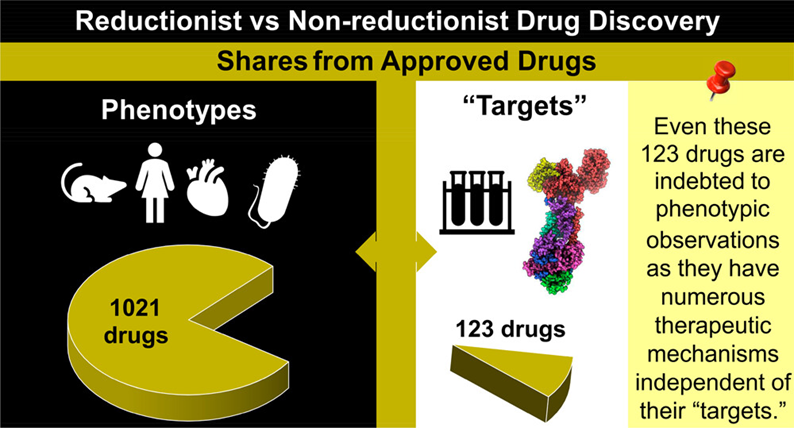
伊朗德黑兰大学的Arash Sadri博士针对这一问题,纯手工系统性地审查了过去150年的约32000篇文章和专利,深入分析了所有获批药物的发现类型。他观察到仅有约9.4%的小分子药物是通过TDD的方式发现,其中仍有不少所谓的“TDD药物”依靠非靶点机制发挥作用。基于此,作者将新药发现效率低下的部分原因归因于TDD的局限性:药物疗效简化为对单一蛋白质的调节的TDD指导思想与生命体调控复杂性相矛盾;并提出以疗效为核心,利用机器学习荟萃分析分子活性的新型药物发现方法的初步建议。近日,该项研究工作发表在了美国化学会出版的药物化学核心期刊Journal of Medicinal Chemistry上(J. Med. Chem. 2023, 66, 18, 12651–12677)2。
通过对药物发现史的系统回顾得知,药物研发起源于基于表型的理性药物发现。该方法利用现有的科学知识来指导对随机物质的筛选,并将它们对表型的影响联系起来。而随着分子生物学、结构生物学以及计算化学等技术的革命与进步,疾病的生物过程被精细剖析,理性药物发现迭代为TDD。这种方法简化了疗效与生命体内复杂网络的关系,期望仅调节一个或几个目标蛋白实现疗效。作者提出了TDD的简化思想是导致药物发现效率低下、新药研发领域衰退的根本原因的假设,并从TDD在获批药物中的占比、TDD药物疗效与靶标蛋白关联性、TDD药物对靶标蛋白的高亲合性与疗效的关系以及TDD理论基础的正确性这几个方面对TDD的方法论进行审视。
对截止2020年底FDA批准药物发现起源的人工筛选表明:在FDA批准的1310种药物中去除内源性生物药物以及其他生物药物后,高达89.25%(1021种,在所有药物中占77.94%)的小分子药物是基于表型发现的,仅有10.75%(123种,在所有药物中占9.4%)的药物是基于靶点发现的。结果表明TDD药物在已批准药物中仅占很小一部分。哪怕在1995年第一个TDD药物沙奎那韦批准以来,TDD药物在获批药物中仍占比偏低,且每年获批的PDD药物均比TDD药物更多(图1)。这表明尽管TDD是药物发现的主导思想,该方法相较于传统的PDD效率更低。
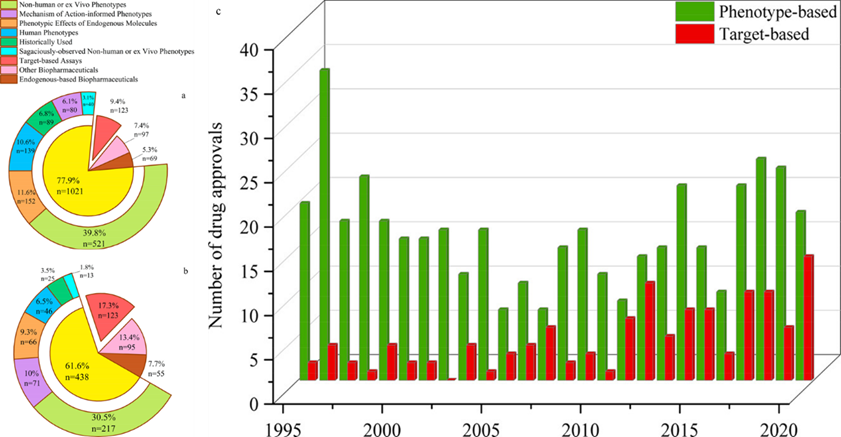
图1、药物发现不同起源占比与数量比较。(a) 所有批准药物中不同起源的比例。(b) 1995年后批准药物不同起源的比例。(c) 1995年后每年批准的PDD药物与TDD药物数量的逐年比较。
尽管TDD药物占比已如此低下,对所筛选出的TDD药物的疗效机制的进一步探究仍发现它们的疗效不能被简单归因于对靶标蛋白的结合。许多“靶向”药物存在诸多“脱靶”的治疗机制。以乙酰胆碱酯酶抑制剂多奈哌齐为例,其存在多达40种的与靶点无关的作用机制;又比如肺癌靶向药克唑替尼,除了对抑制MEK和ALK的抑制作用外,还能对146种其他激酶进行结合。这些结果表明TDD对获批药物的贡献可能远低于9.4%,进一步揭露了TDD效率的低下与理论的漏洞。
在对各靶标蛋白与其ChEMBL配体分子亲合力的统计分析可知,获批药物与靶标的亲合力在配体分子中普遍排名靠前(图2),表明与靶标高亲合力结合和疗效之间存在一定的相关性,但考虑到TDD对药物发现的贡献十分微弱以及存在的众多脱靶机制,只能作为药物研发的一个方面。
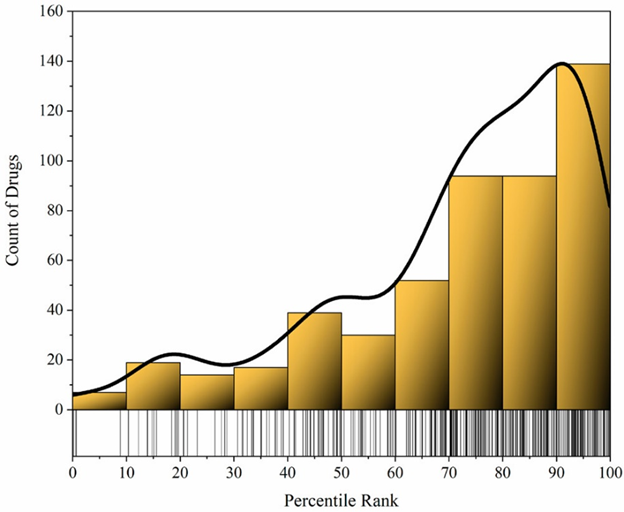
图2、获批药物在其靶标的所有ChEMBL配体中的亲合力百分位等级。
基于靶点的药物发现将人体与机械进行类比,试图通过“替换零件”来实现对机器的“修复”。这样简化致病因素的机械思维忽视了有机生命体功能的复杂性、连续性以及自我调节能力。TDD的简化思想错误地将机体的调控定义为线性的因果关系,在面临非严格线性因果关系时,对整个系统中单个节点施加的刺激并不能对系统整体产生实质性改变。反映到TDD指导的药物研发时,就会出现尽管对靶标具有高亲合力,但疗效仍未能有所改善。基于更高尺度的药物研发指导思想十分必要,它能够带来更高的预测性,例如可通过构建机器学习的模型,通过输入药物对各种蛋白亲合力等低尺度变量,输出治疗效果的高尺度信息(图3)。
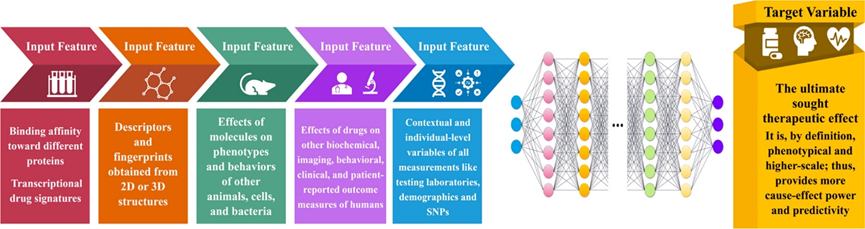
图3、新型药物发现方式的初步构想。
小结:基于靶点的药物发现对部分单基因驱动的疾病十分有效。但在面对复杂病因的疾病时,由于将致病因素过分简化为一个或几个蛋白,对这些蛋白的单独调控往往不能获得期望的疗效,从而造成药物研发效率的低下。作者人工调研了所有获批药物的发现方式,具体探究了TDD应用的实际效率以及其效率低下的方法论原因,并提出了全新的药物发现方式的初步构想。该工作也呼吁广大研究者转变思路以提高药物研发效率。不过,TDD药物发现真正流行起来不过30年历史而已,因此其在所有药物发现中的比例自然偏低,我们也需要辩证地看待作者的统计结论。
参考文献
1 Scannell, J. W., Blanckley, A., Boldon, H. & Warrington, B. Diagnosing the decline in pharmaceutical R&D efficiency. Nature Reviews Drug Discovery 11, 191-200 (2012). https://doi.org:10.1038/nrd3681
2 Sadri, A. Is Target-Based Drug Discovery Efficient? Discovery and “Off-Target” Mechanisms of All Drugs. Journal of Medicinal Chemistry66, 12651-12677 (2023). https://doi.org:10.1021/acs.jmedchem.2c01737
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







