【论著】| 保守手术治疗的10例Ⅰ期胎盘部位滋养细胞肿瘤病例报告及文献复习
2023-10-25 中国癌症杂志 中国癌症杂志 发表于上海
保守手术可以作为部分Ⅰ期PSTT患者的一种替代治疗方法,但需更多研究提供证据。
[摘要]
背景与目的:胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)是罕见的妇科恶性肿瘤,由于PSTT在子宫内独特的浸润方式和对化疗不敏感特性,全子宫切除是首选的手术方式。本研究旨在探讨Ⅰ期PSTT患者保守手术治疗的可行性和安全性。方法:纳入2015年1月—2021年12月复旦大学附属妇产科医院收治的Ⅰ期PSTT病例,同时分别以“placental site trophoblastic tumor”和“case”、“胎盘部位滋养细胞肿瘤”和“例”为关键词在PubMed和中国知网(CNKI)中检索1990年1月—2021年12月发表的接受保守手术治疗的Ⅰ期PSTT个案报道和系统病例报告,收集患者的临床病理学资料,并进行回顾性分析。结果:共纳入复旦大学附属妇产科医院收治的符合标准的病例10例,中位年龄为27岁,最常见的症状为不规则阴道出血(70.0%),中位诊断距离前次妊娠时间间隔(interval since antecedent pregnancy,ISAP)为14.5个月,中位β-绒毛膜促性腺激素(β-human chorionic gonadotrophin,β-hCG)水平为124.51 mU/mL,病灶直径为0.8~8.0 cm。复旦大学附属妇产科医院收治的10例患者经初始治疗后均获得完全缓解,平均随访时间为48.1个月,均未复发。3例患者治疗后自然受孕,其中2例足月妊娠分娩,1例因计划外妊娠行人工流产。文献复习PSTT病例显示出类似的临床病理学分布特征和疾病转归。结论:保守手术可以作为部分Ⅰ期PSTT患者的一种替代治疗方法,但需更多研究提供证据。
[关键词] 胎盘部位滋养细胞肿瘤;保守手术;预后
胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)是一类罕见的妇科恶性肿瘤,发生率为0.01~0.30/10万次妊娠[1-2],占妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN)的2.8%~3.0%[3-4]。PSTT对化疗相对不敏感,手术是其主要治疗方式。由于PSTT在子宫内独特的浸润方式[5-6],全子宫切除是首选的手术方式。
约70%的PSTT患者的病灶局限于子宫(临床Ⅰ期)[3],且患者多为育龄期女性,患者诊断时平均年龄为29~35岁[3,7-8],部分患者有生育意愿。因此,近20年来,PSTT患者保留生育功能的问题受到越来越多的关注,尤其是Ⅰ期患者[3,9-15]。
然而,如何进行保留生育功能的治疗,保留子宫进而保留生育功能的保守手术在Ⅰ期PSTT患者中是否安全可行,目前尚无确切答案。本文通过收集复旦大学附属妇产科医院收治的接受保守手术治疗的Ⅰ期PSTT患者的临床病理学资料,结合文献报道的类似案例,分析患者的临床病理学特征、治疗结局、预后及生育结局,为Ⅰ期PSTT患者保守手术治疗的可行性和安全性提供一定的临床指导。
1 资料和方法
1.1 病例选择
收集复旦大学附属妇产科医院2015年1月—2021年12月收治的PSTT患者的临床病理学资料。纳入标准:① 经两名病理科医师独立阅片诊断为PSTT;② 无子宫外转移。排除标准:① 当前或既往罹患其他恶性肿瘤;② 混合性GTN,如PSTT合并绒毛膜癌;③ 失访;④ 未尝试保守手术。本研究获复旦大学附属妇产科医院伦理委员会批准。复旦大学附属妇产科医院的所有病例在入院时均签署书面知情同意书。同时,在PubMed的“Advanced”检索界面以“(placental site trophoblastic tumor[Title/Abstract]) AND (case[Title/Abstract])”为检索式,检索1990年1月—2021年12月发表的PSTT个案报道和系列病例报告;在中国知网的“高级检索”界面以 “(篇关摘:胎盘部位滋养细胞肿瘤(精确)) AND(篇关摘:例(精确))”为检索式,收集1990年1月—2021年12月发表的Ⅰ期PSTT个案报道和系列病例报告。
1.2 数据收集
收集的数据包括年龄、主诉、孕次、产次、前次怀孕、诊断距离前次妊娠时间间隔(interval since antecedent pregnancy,ISAP)、血清β-绒毛膜促性腺激素(β-human chorionic gonadotrophin,β-hCG)、子宫病灶大小和部位、病理学特征(如核分裂象、肌层浸润深度及有无出血坏死)、治疗方式(如手术方式、是否化疗及化疗方案)、初始治疗结局、预后及生育结局 等。
1.3 治疗方式
初始治疗:在病理学诊断为PSTT后,进一步接受的手术,如子宫局部病灶切除术、刮宫术,术后辅助化疗或不化疗。如诊断后经评估,未行进一步手术,则诊断时所采用的手术被认为是初始治疗的术式。保守手术:保留子宫的手术,包括子宫局部病灶切除术、刮宫术等。初始缓解定义为:在初始治疗后,患者血清β-hCG水平降至正常范围内,影像学检查未见确切病灶,病理学上无残留(如有治疗后手术评估者)。疾病复发:初始治疗获得缓解,随访中除外妊娠,血清β-hCG水平再次升高,或影像、病理学检查发现新发病灶。
1.4 统计学处理
采用SPSS 25.0对数据进行分析。受样本量限制,本研究只对数据进行统计描述,未进行统计推断。采用Shapiro-Wilk检验对数据进行正态性检验;正态分布变量采用x±s表示;偏态分布变量采用中位数和四分位数范围(first quartile~third quartile,Q1~Q3)表示。
2 结 果
2.1 临床病理学特征
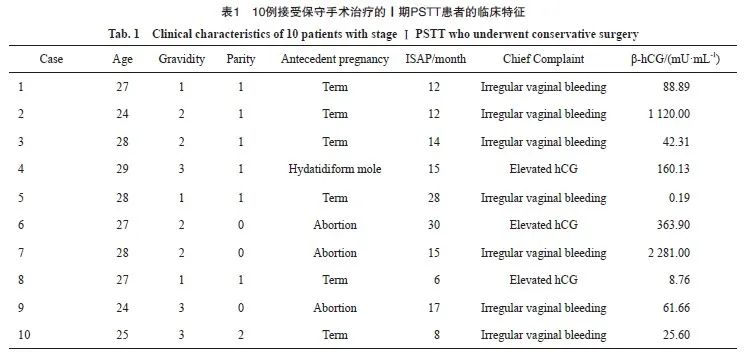
复旦大学附属妇产科医院收治的Ⅰ期PSTT患者中,10例接受保守手术治疗,患者的临床特征见表1。诊断时患者的年龄范围为24~29岁,中位年龄为27岁,不规则阴道出血是主要的临床表现,占70%。6例患者继发于足月妊娠,3例患者继发于流产,1例患者继发于葡萄胎妊娠。ISAP为6~30个月,中位ISAP为14.5个月,治疗前患者血清β-hCG水平为0.19~2 281.00 mU/mL,中位β-hCG水平为124.51 mU/mL。3例患者尚未生育,另有6例仅生育一胎。
PSTT通常有其独特的超声特征。借鉴子宫肌瘤的分类方法,根据PSTT病灶与子宫壁的关系,将PSTT大致分为以下3种类型:Ⅰ型,局限于子宫腔内;Ⅱ型,同时位于子宫腔和肌层;Ⅲ 型,完全位于子宫肌层内。
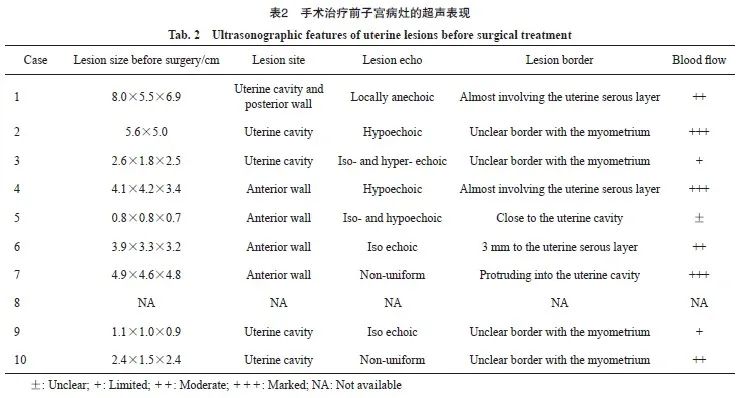
手术治疗前子宫病灶的超声表现见表2。PSTT病灶直径大小为0.8~8.0 cm。4例患者子宫病灶位于子宫腔内,与子宫肌层分界不清,3例患者病灶靠近子宫浆膜层。一半以上的患者病灶内和(或)病灶周围血供丰富伴子宫肌层血管扩张。
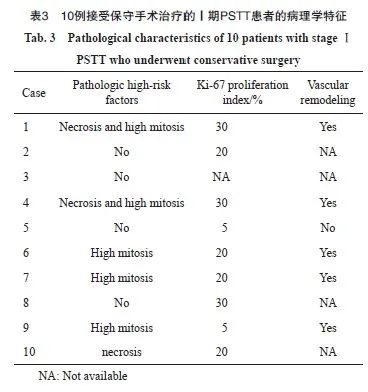
10例接受保守手术治疗的Ⅰ期PSTT患者的病理学特征见表3,其中6例患者术后病理学检查提示有高危因素,最常见的是高分裂象。Ki-67增殖指数为5%~30%,其中83.3%(5/6)的患者出现血管重塑(血管平滑肌或内皮细胞被肿瘤细胞取代)。其中4例患者系在外院行活检转诊至复旦大学附属妇产科医院后经病理学会诊明确诊断。
2.2 治疗结局及预后
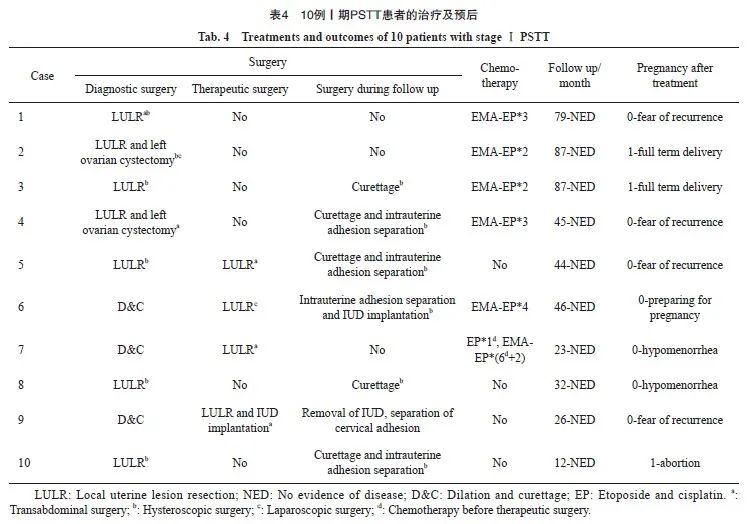
所有患者均接受了保守手术治疗,患者的治疗信息见表4。3例(第3、8和10例)患者病灶局限于子宫腔内,接受了宫腔镜下子宫病灶切除术。其余7例患者均行经腹部子宫病灶切除,其中4例(第1、2、4、7例)患者术前子宫病灶大于4 cm。6例(6/10)患者术后接受了2~4个疗程的EMA-EP方案(依托泊苷-甲氨蝶呤-放线菌素联合依托泊苷-顺铂)辅助化疗,含2次巩固化疗,其中1例患者(第7例)由于术前β-hCG水平较高,接受了6个疗程的EMA-EP方案新辅助化疗。初始治疗后,所有患者均获得缓解。
经过12~87个月(平均48.1个月)的随访,所有患者均未出现复发或死亡。7例患者在治疗后3~12个月内再次接受了宫腔镜手术评估,5例患者评估中发现轻度至中度子宫或宫颈粘连,5例患者在宫腔镜随访过程中进行了活检,未发现残留病灶。
3例(3/10)患者自然受孕,其中2例足月妊娠阴道分娩,1例计划外妊娠于妊娠8周时行人工流产术。4例(4/10)患者因害怕肿瘤复发不敢备孕,1例积极备孕中,另2例患者有备孕计划,但由于子宫腔粘连、月经过少积极治疗中。
2.3 文献病例分析
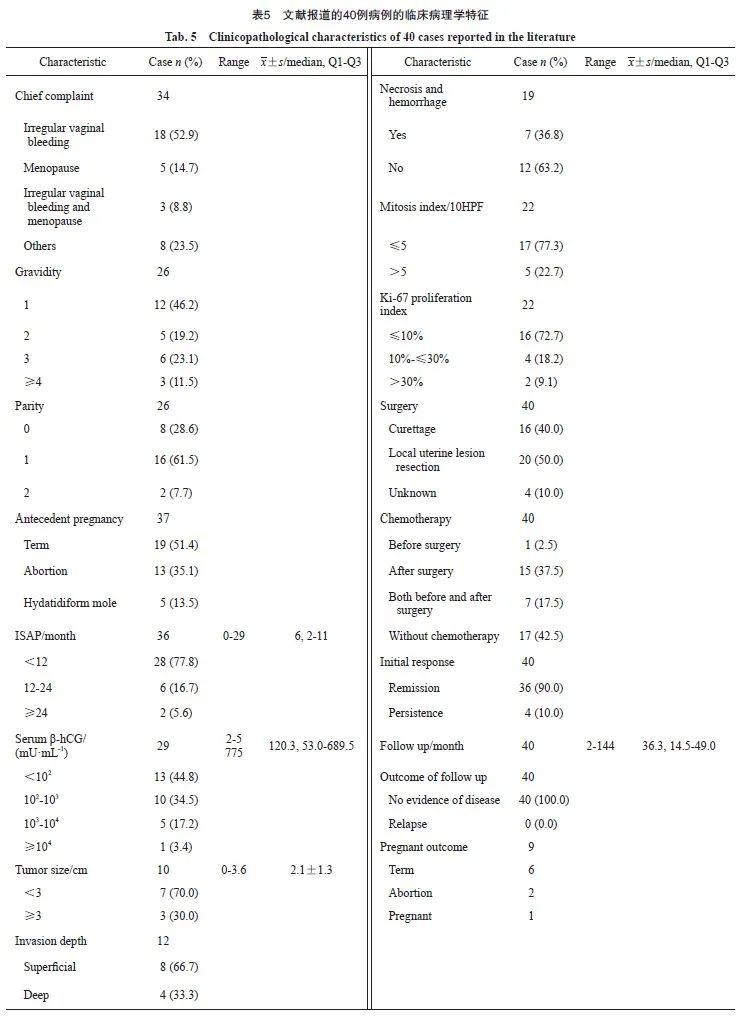
通过检索PubMed和中国知网,收集1990年1月—2021年12月发表的Ⅰ期PSTT中英文个案报道和系列病例报告,共40例病例纳入研究(表5)[6,11-31]。40例PSTT患者的年龄范围为21~39岁,平均年龄为28.2岁。临床表现以不规则阴道出血为主(52.9%),继发于足月妊娠者占51.4%。确诊时血清中位β-hCG为95 mU/mL,平均病灶大小为2.1 cm,中位ISAP为6个月。33.3%(4/12)的患者病灶累及子宫深层肌层,36.8%(7/19)的患者病灶存在出血坏死,22.7%(5/22)的患者病理学检查提示核分裂象>5 个/10高倍视野(high power field,HPF)。所有患者均接受了保守手术治疗,其中50%(20/40)的患者接受了子宫局部病灶切除术,40%(16/40)仅行刮宫术,其余4例患者接受了保留子宫的治疗,但具体术式不详。57.5%(23/40)的患者接受了术前和(或)术后化疗。
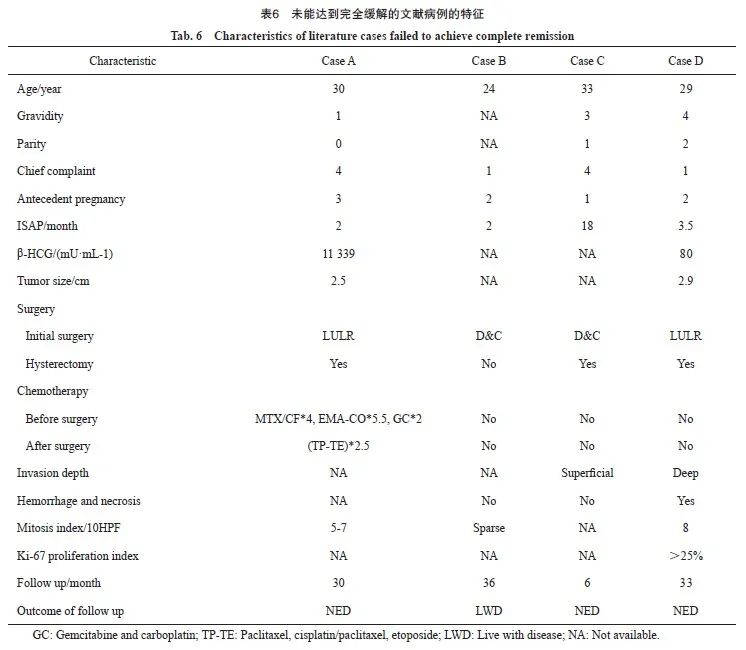
经过治疗,90.0%(36/40)的患者获得缓解,10.0%(4/10)的患者肿瘤未获得完全缓解(表6),其中3例再次行全子宫切除术后获得缓解,1例患者拒绝切除子宫,带病生存3年,随访中无疾病进展证据。
文献报道的40例患者,经过2~144个月的随访,无复发进展病例。6例(15%)患者治疗后成功妊娠,其中1例患者通过促排卵妊娠,1例患者术后有过2次自然流产,最终成功妊娠并分娩。5例成功分娩健康婴儿,1例尚处妊娠期。2例患者在随访中尚无备孕计划。其余患者治疗后生育状况在报道中未提及。
3 讨 论
PSTT是一种罕见的妊娠滋养细胞肿瘤,一经病理学检查确诊,则建议行全子宫切除术。肿瘤期别晚、ISAP≥48个月是PSTT患者预后不良的独立危险因素[3,7,32]。然而,PSTT多为育龄期女性,且70%的PSTT患者为早期病例,病灶局限于子宫。这类患者能否进行保留子宫进而保留生育功能的治疗是当前诊疗的难点。由于PSTT发病率低,目前为止尚缺乏有力证据。本研究中,经过12~87个月(平均48.1个月)的随访,无一例复发,Ⅰ期PSTT患者保守治疗成功率为100%,与文献报道的25%~100%相似[8-9,12,25]。因此,经过筛选的Ⅰ期PSTT患者保守手术治疗短期内是安全可行的,结合文献报道病例,即使有发生残留复发,经过严密随访和及时治疗,患者生存结局良好。
PSTT病变切除的具体术式主要取决于子宫病变的大小、个数和位置。弥漫性病变的患者不是保守手术治疗的理想对象[3,9,12]。子宫腔内的息肉样病变可通过宫腔镜切除[9],子宫腔内的浅表病变可通过刮宫治疗,累及肌层的病变可通过腹腔镜手术或开腹手术治疗以确保安全切缘,否则,应考虑全子宫切除术[3,9]。因此,术前影像学评估起着至关重要的作用。术前应进行盆腔超声和磁共振成像等影像学检查,以全面了解子宫病变的特征,包括病变大小、血供、侵犯深度和部位。正电子发射计算机体层成像主要用于排除转移[33]。然而,由于PSTT独特的方式—肿瘤细胞片状或条索状分离子宫平滑肌,浸润子宫肌层,取代子宫血管壁[5-6,34],影像学表现可能具有误导性。改善术前影像学评估的有效性和准确性可能是未来研究的重点。
有报道[25]推荐术中在距病变外缘1 cm处使用冷刀进行全层切除,但术中冷冻切缘检查并不一定可靠。在因切缘不够安全而接受全子宫切除术的5例患者中,有2例没有残留病变[25]。表6中患者A接受了保守手术治疗,术中快速冷冻切片病理学检查显示切缘安全,术后病理学检查提示在病灶切缘3~5 mm内未见肿瘤,然而后续化疗后患者血清β-hCG再次升高。经过再次影像学评估排除肿瘤远处转移后,考虑子宫病灶残留,进一步行全子宫切除术,术后随访30个月,未发现疾病复发或进展。术中肿瘤距离切缘多少为安全距离,尚无一致结论,需要进一步研究。
既往研究及美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南认为Ⅰ期PSTT患者在接受全子宫切除术后,如存在以下因素,建议进行辅助化疗:肿瘤浸润子宫深肌层、肿瘤广泛出血坏死、肿瘤核分裂数>5/10HPF[8,35]。也有研究认为Ⅰ 期PSTT患者术后辅助化疗似乎并不能使患者获益[7],单纯全子宫切除术后也可获得满意的疗效[32],可以不化疗[3]。另外,对于Ⅰ期保守手术治疗的患者而言,这一病理学评判体系存在一个问题:难以评估接受微创手术(如宫腔镜下病灶切除术、诊刮术)患者的病理学特征,如肿瘤浸润深度等。因此,依据上述病理学高危因素对 Ⅰ期PSTT患者术后辅助化疗进行指导可能存在一定局限性。
本研究病例中有3例(30%)在治疗后自然受孕,文献复习40例患者中15%成功妊娠,与既往报道的16.7%~30.4%[3,12]基本一致。通过分析本研究报道的病例生育情况,尚未妊娠的患者主要是担心肿瘤复发或存在子宫宫颈粘连、甚至闭经。因此,患者治疗后的生育咨询与指导应该得到更多的重视。
本研究还存在一定的局限性:首先,本研究为回顾性分析,样本量小,随访时间短;其次,文献报道的临床病理学信息及影像学信息部分缺失。
综上所述,保守手术可能成为Ⅰ期PSTT患者的替代治疗方案,但首先要保证安全性:术前充分评估,术中尽量去除病灶,治疗后严密随访;同时要重视有生育愿望患者治疗后的生育咨询和指导。但上述结论仍需要多中心临床研究进一步验证。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]YAMAMOTO E, NISHINO K, NIIMI K, et al. Epidemiologic study on gestational trophoblastic diseases in Japan[J]. J Gynecol Oncol, 2022, 33(6): e72.
[2]LYBOL C, THOMAS C M, BULTEN J, et al. Increase in the incidence of gestational trophoblastic disease in the Netherlands[J]. Gynecol Oncol, 2011, 121(2): 334-338.
[3]ZHAO J, LV W G, FENG F Z, et al. Placental site trophoblastic tumor: a review of 108 cases and their implications for prognosis and treatment[J]. Gynecol Oncol, 2016, 142(1): 102-108.
[4]LIU W, ZHAO W, HUANG X. Outcomes and prognostic factors of placental-site trophoblastic tumor: a retrospective study of 58 cases[J]. Arch Gynecol Obstet, 2022, 306(5): 1633-1641.
[5]SHIH I M, KURMAN R J. The pathology of intermediate trophoblastic tumors and tumor-like lesions[J]. Int J Gynecol Pathol, 2001, 20(1): 31-47.
[6]BAERGEN R N, RUTGERS J L, YOUNG R H, et al. Placental site trophoblastic tumor: a study of 55 cases and review of the literature emphasizing factors of prognostic significance[J]. Gynecol Oncol, 2006, 100(3): 511-520.
[7]GADDUCCI A, CARINELLI S, GUERRIERI M E, et al. Placental site trophoblastic tumor and epithelioid trophoblastic tumor: clinical and pathological features, prognostic variables and treatment strategy[J]. Gynecol Oncol, 2019, 153(3): 684-693.
[8]ALEXANDER A L, STROHL A E, MANIAR K P, et al. Placental site trophoblastic tumor: successful treatment of 13 cases[J]. Gynecol Oncol Rep, 2020, 32: 100548.
[9]CHIOFALO B, PALMARA V, LAGANÀ A S, et al. Fertility sparing strategies in patients affected by placental site trophoblastic tumor[J]. Curr Treat Options Oncol, 2017, 18(10): 58.
[10]ASHTON E, SZUTOWSKA M, SHAFER A, et al. Attempted conservative management of a placental site trophoblastic tumor: a case report[J]. Conn Med, 2014, 78(8): 475-477.
[11] TAYLOR J S, VIERA L, CAPUTO T A, et al. Unsuccessful planned conservative rep of placental site trophoblastic tumor[J]. Obstet Gynecol, 2013, 121(2 Pt 2 Suppl 1): 465-468.
[12] SHEN X Y, XIANG Y, GUO L N, et al. Fertility-preserving treatment in young patients with placental site trophoblastic tumors[J]. Int J Gynecol Cancer, 2012, 22(5): 869-874.
[13] LISZKA L, WILK M, WODOLAZSKI A, et al. Successful treatment of placental site trophoblastic tumor in twin pregnancy without hysterectomy[J]. Tumori, 2009, 95(1): 108-111.
[14] PFEFFER P E, SEBIRE N, LINDSAY I, et al. Fertility-sparing partial hysterectomy for placental-site trophoblastic tumour[J]. Lancet Oncol, 2007, 8(8): 744-746.
[15] NUMNUM T M, KILGORE L C, CONNER M G, et al. Fertility sparing therapy in a patient with placental site trophoblastic tumor: a case report[J]. Gynecol Oncol, 2006, 103(3): 1141-1143.
[16] LEISEROWITZ G S, WEBB M J. Treatment of placental site trophoblastic tumor with hysterotomy and uterine reconstruction[J]. Obstet Gynecol, 1996, 88(4 Pt 2): 696-699.
[17] 苏代芬, 胡玉泉, 刘劭华, 等. 宫角妊娠合并胎盘部位滋养细胞瘤1例[J]. 中国计划生育学杂志, 1998, 6(3): 135-136.
[18] SU D F, HU Y Q, LIU S H, et al. A case of cornual pregnancy complicated with placental site trophoblastoma[J]. J Cap Univ Med Sci, 1998, 6(3): 135-136.
[19] 张平. 胎盘部位滋养细胞肿瘤2例病理报告[J]. 宁夏医学杂志, 1999, (12): 753. ZHANG P. Placental site trophoblastic tumor: a pathological report of 2 cases[J]. Ningxia Med J, 1999, (12): 753.
[20] TSUJI Y, TSUBAMOTO H, HORI M, et al. Case of PSTT treated with chemotherapy followed by open uterine tumor rep to preserve fertility[J]. Gynecol Oncol, 2002, 87(3): 303-307.
[21] MACHTINGER R, GOTLIEB W H, KORACH J, et al. Placental site trophoblastic tumor: outcome of five cases including fertility preserving management[J]. Gynecol Oncol, 2005, 96(1): 56-61.
[22] 虞海燕. 足月妊娠合并胎盘部位滋养细胞肿瘤3例误诊分析[J]. 实用妇产科杂志, 2006, 22(9): 548-549.
YU H Y. Misdiagnosis analysis of 3 cases of full-term pregnancy complicated with placental trophoblastic tumors[J]. J Prac Obste Gynecol, 2006, 22(9): 548-549.
[23] NAGAI Y, KAMOI S, MATSUOKA T, et al. Impact of p53 immunostaining in predicting advanced or recurrent placental site trophoblastic tumors: a study of 12 cases[J]. Gynecol Oncol, 2007, 106(3): 446-452.
[24] 厉霞玲, 钱建华. 胎盘部位滋养细胞肿瘤12例临床分析[J]. 现代妇产科进展, 2007, 16(12): 948-950.
LI X L, QIAN J H. Clinical analysis of 12 cases of trophoblastic tumor in placenta[J]. Prog Obstet Gynecol, 2007, 16(12): 948-950.
[25] 刘 红, 张国楠, 樊 英. 胎盘部位滋养细胞肿瘤保留生育功能治愈1例[J]. 实用妇产科杂志, 2009, 25(4): 245-246.
LIU H, ZHANG G N, FAN Y. A case of placental trophoblastic tumor with preserved fertility function cured[J]. J Prac Obste Gynecol, 2009, 25(4): 245-246.
[26] SASO S, HADDAD J, ELLIS P, et al. Placental site trophoblastic tumours and the concept of fertility preservation[J]. BJOG, 2012, 119(3): 369-374.
[27] ZHENG Y X, BAO L J, NING Y, et al. Retrospective analysis of the clinicopathologic and prognostic characteristics of stage I placental site trophoblastic tumor in China[J]. Int J Gynaecol Obstet, 2015, 129(1): 67-70.
[28] CHOI M C, JUNG S G, PARK H, et al. Placental site trophoblastic tumors: analysis of the clinicopathologic characteristics of 20 cases in Korea[J]. Int J Gynecol Cancer, 2016, 26(8): 1515-1520.
[29] 陈思思, 张 虹. 中间型滋养细胞肿瘤8例并文献回顾[J]. 国际妇产科学杂志, 2017, 44(6): 709-712. ZHANG S S, ZHANG H. Diagnosis, treatments and prognosis of intermediate trophoblastic tumors[J]. J Int Obstet Gynecol, 2017, 44(6): 709-712.
[30] ZHANG Y, ZHANG S Q, HUANG W Q, et al. Intermediate trophoblastic tumor: the clinical analysis of 62 cases and prognostic factors[J]. Arch Gynecol Obstet, 2019, 299(5): 1353-1364.
[31] 刘 佳, 李 丽. 胎盘部位滋养细胞肿瘤九例临床病理报告[J]. 中华肿瘤防治杂志, 2019, 26(23): 1805-1809.
LIU J, LI L. Clinicopathologic report of nine placental site trophoblastic tumors[J]. Chin J Cancer Prev Treat, 2019, 26(23): 1805-1809.
[32] 赵小晓, 石玉香, 倪海春, 等. 胎盘部位滋养细胞肿瘤一例报告[J]. 新医学, 2020, 51(3): 231-234.
ZHAO X X, SHI Y X, NI H C, et al. Placental site trophoblastic tumor: a case report[J]. New Med, 2020, 51(3): 231-234.
[33] LEE H J, SHIN W, JANG Y J, et al. Clinical characteristics and outcomes of placental site trophoblastic tumor: experience of single institution in Korea[J]. Obstet Gynecol Sci, 2018, 61(3): 319-327.
[34] MANGILI G, BERGAMINI A, GIORGIONE V, et al. [18F] fluorodeoxyglucose positron emission tomography/computed tomography and trophoblastic disease: the gynecologist perspective[J]. Q J Nucl Med Mol Imaging, 2016, 60(2): 103-116.
[35] KAUR B. Pathology of gestational trophoblastic disease (GTD)[J]. Best Pract Res Clin Obstet Gynaecol, 2021, 74: 3-28.
[36] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) gestational rophoblastic neoplasia version 1.2023[EB/OL]. (2023-08-30)[2022-12-20]. https://www.nccn.org/professionals/physician_gls/pdf/gtn.pdf.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







