突破传统观念,高金明团队最新Nature NBE:肿瘤或许比你想得更酸!
2024-03-06 BioMed科技 BioMed科技 发表于上海
研究认为,严重的空间极化肿瘤酸度有望用于癌症的诊断和治疗。
至关重要的pH
质子浓度或pH是影响酶活性、细胞代谢和组织稳态的基本生理参数。例如,系统酸碱平衡是呼吸和肾脏系统最严格调节的过程之一,以实现7.36至7.44之间的狭窄动脉pH范围。人体肌肉的平均间质pH值也受到了严格控制(7.38 ± 0.02)。在运动过程中,骨骼肌细胞产生乳酸,乳酸通过单羧酸转运蛋白(MCTs)输出,因此在剧烈运动中,间质pH可低至7.04。在各种疾病状态下,如缺血、炎症和癌症,细胞外酸化已被证明与病理生理学息息相关。

在实体瘤中,癌症细胞的高代谢活性和较差的血管灌注是肿瘤微环境中H+离子积累的原因。肿瘤酸性可激活金属蛋白酶以增加癌症转移并抑制免疫细胞以进行肿瘤免疫逃避。在广泛的癌症类型中,平均细胞外pH(pHe)为6.83(范围6.72–7.01),而在各种动物肿瘤模型中,pHe约为6.4–7.3。然而,常用的电极/磁共振光谱成像方法测量pH的一个主要限制是缺乏空间分辨率(~10 mm3),这可能导致细胞或亚细胞酸化区中的细胞外酸度被低估。
测定肿瘤pH的新型策略
近期,德克萨斯大学西南医学中心高金明教授等人通过利用在pH为5.3时具有类晶体管激活行为的荧光pH纳米探针发现,在癌症细胞中,水合氢离子会被排出到较小的细胞外区域。这种严重极化的酸性(pH<5.3)主要是由质子和乳酸盐的定向共输出引起的。研究还观察到,在离体染色的快速冷冻人类鳞状细胞癌组织中,这种点域酸化(spot acidification)与单羧酸转运蛋白的表达和细胞毒性T细胞排斥相关。因此,研究认为,严重的空间极化肿瘤酸度有望用于癌症的诊断和治疗。相关工作以“Severely polarized extracellular acidity around tumour cells”为题发表在Nature Biomedical Engineering。

【文章要点】
此前,作者团队就已经开发了一个具有可调pH转换和荧光激活的超pH敏感(UPS)纳米探针库(J. Am. Chem. Soc. 136, 11085–11092 (2014))。与小分子pH示踪剂不同的是,UPS纳米探针是阈值、不可逆和数字传感器,它以亚细胞空间分辨率以二进制输出报告pH信号。UPS纳米探针中的荧光团在正常生理pH(7.4)下保持猝灭。到达肿瘤后,肿瘤酸度在低于其pH转换阈值时激活纳米探针,从而在肿瘤中进行荧光发射。此前,作者在癌症图像引导手术的I/II期临床试验中证明了pegsitacianine的安全性,这是一种吲哚青绿(ICG)编码的UPS纳米探针,pH转变为5.3(UPS5.3-ICG)。患者数据还显示了多种癌症类型的广泛成像效果,对肿瘤检测的灵敏度也非常高。这些结果也暗示了,肿瘤微环境可能比以往认为的更具酸性。
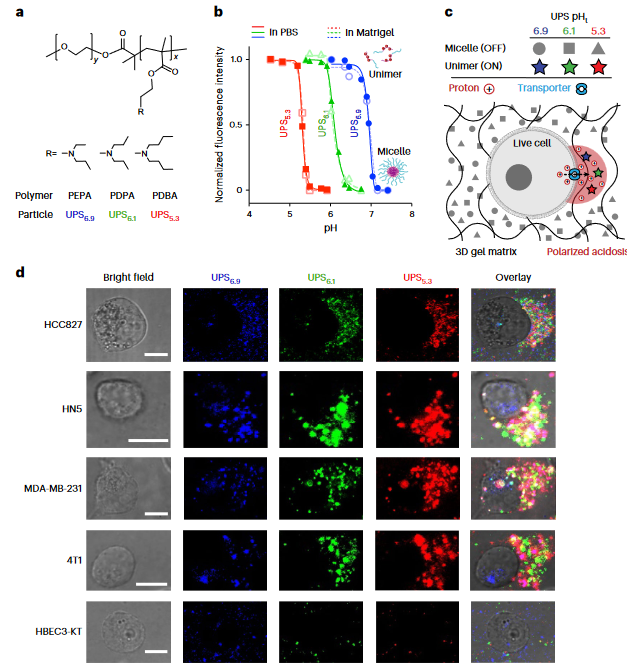
图1 UPS探针揭示肿瘤细胞酸性
因此,在这篇文章中,作者使用UPS纳米探针研究了pH=5.3以下的严重肿瘤酸度的细胞来源。令人惊讶的是,成像数据揭示了各类不同癌症细胞均具有亚细胞分辨率的极化细胞外酸性,并且通过MCTs分泌乳酸会导致严重的肿瘤酸中毒。同时,作者将严重极化的细胞外酸性区(SPEAR)定义为癌症细胞的一个未被识别的物理靶点,有望在针对癌症的广泛诊断和治疗应用中得到进一步利用。
具体而言,当环境pH降至临界阈值pH(pHt)以下时,UPS聚合物会经历从胶束到单分子状态的相变。在中性pH下,UPS聚合物则保持胶束形式,由于Förster共振能量转移(FRET),导致共轭染料的荧光信号(“OFF”状态)猝灭。随着环境质子浓度的增加,UPS胶束抵抗质子化,直到pH达到转变点。在转变pH条件下,UPS聚合物经历全质子化或全无质子化行为,其中单体被质子化并从胶束中释放,导致荧光的部分恢复。当环境pH达到pHt以下时,UPS聚合物完全质子化,荧光完全恢复(图1)。
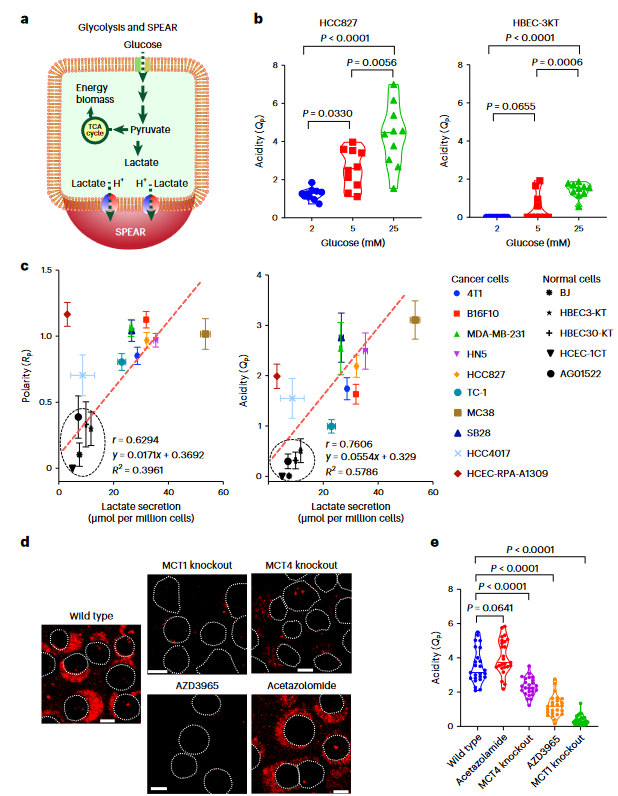
图2 糖酵解介导的乳酸分泌驱动SPEAR的形成
这项研究的结果表明,即使在单细胞水平上,也存在严重的肿瘤酸性,即癌症细胞中存在严重极化的细胞外酸性区(SPEAR)。沿着特定的轨迹,质子输出优先发生在一个方向上,这提供了一个比以前所认为的高一个数量级的高度浓缩的酸性区(pHe<5.3)。SPEAR的形成与较高的糖酵解和乳酸分泌速率相关,而MCTs的基因敲除或抑制消除了UPS5.3的激活,进一步说明MCT介导的乳酸分泌可驱动SPEAR的形成(图2)。目前的数据表明,SPEAR异质性是细胞固有的特性。单个细胞中SPEAR的体外观察不仅揭示了癌症细胞和非癌细胞之间的差异,还突出了每个癌症细胞系的内部差异。除了固有的可变性之外,营养和氧气供应、细胞-细胞接触、通过血液灌注或淋巴引流的质子冲洗、通过局部乳酸穿梭的乳酸消耗等因素也可能有助于患者肿瘤组织中SPEAR的形成。
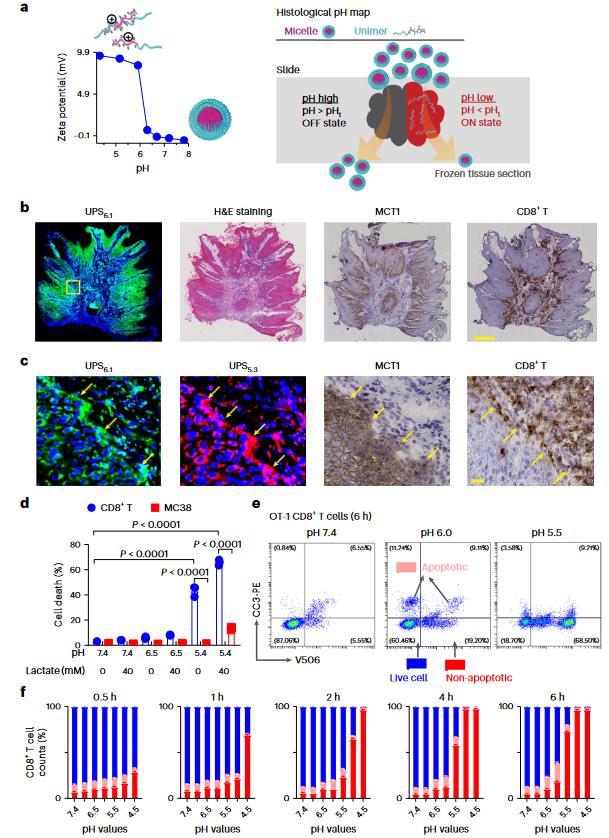
图3 在人类肿瘤样本中成像肿瘤中毒和T细胞排斥
轻度肿瘤酸性(pHe=6.5–6.8)是公认的免疫抑制因素,可阻止细胞毒性淋巴细胞、细胞因子信号传导和抗癌症细胞的抗体反应。这项研究则进一步发现,SPEAR表型可进一步恶化免疫细胞。例如,细胞毒性T细胞在pH 5.5或更低时转变发生快速非凋亡细胞死亡。患者肿瘤组织的离体染色显示,在pH 5.3以下的基质-肿瘤组织界面处可形成酸性壁,发挥排斥CD8+T细胞的作用。研究推测,乳酸的极化分泌会产生排斥区,在细胞与细胞接触时消灭CD8+T细胞,这为具有强嗜酸特性的癌症细胞提供了生存优势(图3)。
结论与展望
在该项研究中,作者发现了癌症细胞中一种以前未被识别的极化细胞外酸性现象。癌症细胞表面的严重酸性代表了由癌症细胞的有氧糖酵解驱动的新的代谢特征。同时,作者使用临床证据也表明,使用UPS探针进行SPEAR靶向也是可行的。因此,作者认为,在未来的研究中,对于利用酸性pH进行治疗或药物递送的肿瘤靶向策略来说,应进一步考虑更低的pH阈值(例如,pH<5.5)。
文献链接:
https://www.nature.com/articles/s41551-024-01178-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肿瘤酸性# #癌症细胞#
13