肺癌丨阿替利珠单抗(T药)系列研究汇总
2022-11-18 e药安全 e药安全
阿特珠单抗(Atezolizumab,Tecentriq)是一种人源化单克隆抗PD-L1抗体,它能够抑制PD-L1—PD-1和PD-L1—B7-1信号传导,并恢复肿瘤特异性T细胞免疫。
阿特珠单抗(Atezolizumab,Tecentriq)是一种人源化单克隆抗PD-L1抗体,它能够抑制PD-L1—PD-1和PD-L1—B7-1信号传导,并恢复肿瘤特异性T细胞免疫。小编整理了阿替利珠单抗在非小细胞肺癌(Non Small Cell Lung Cancer,NSCLC)和小细胞肺癌(Small Cell Lung Cancer,SCLC)中的系列研究,有助于我们更深入的认识PD-L1抗体—阿特珠单抗。
系列研究概要
非小细胞肺癌
新辅助免疫治疗
1. LCMC3研究:EGFR/ALK(-),T药,MPR达21%
辅助治疗
2. IMpower010研究:III期,化疗+T药 vs 化疗+BSC,OS有获益趋势
晚期一线治疗
单独免疫治疗
3. BIRCH&FIR: 两项II期研究,数据亮眼
4. IMpower110:免疫单药用于PD-L1高表达
免疫+化疗
5. IMpower130:获批非鳞癌一线
6. IMpower132:非鳞癌,改变化疗方案,OS不具统计意义
7. IMpower131:鳞癌一线失利
免疫+免疫
8. CITYCYPE研究:Tiragolumab+T药 vs T药,ORR为42% vs 23%
免疫+化疗+抗血管
9. IMpower150:“豪华”方案获批,唯一可用于突变患者的免疫方案
irAE-疗效
10. T药汇总分析:一线,阿替利珠单抗组出现irAE,OS延长(1/2级延长明显)
晚期二线治疗
11. POPLAR & OAK:一举拿下适应症,4年OS率翻倍
小细胞肺癌
12. IFCT-1603:二线治疗败北
13. IMpower133:改写ES-SCLC一线治疗历史
14. SKYSCRAPER-02研究:一线,III期,阿替利珠单抗+化疗±Tiragolumab,错过PFS终点TIGIT首尝失败
非小细胞肺癌
新辅助免疫治疗
LCMC3研究
2020年WCLC大会上,研究者公布了II期LCMC3研究结果,该研究旨在评估阿替利珠单抗用于初治IB-IIIB期可切除非小细胞肺癌(NSCLC)患者新辅助治疗的疗效和安全性。
LCMC3研究评估了未经治疗的IB-IIIB期可切除NSCLC术前使用Atezolizumab(抗PD-L1)治疗的效果。LCMC3分为两部分:第一部分患者接受Atezolizumab 1200 mg每3周静脉滴注,疗程≤2个周期,然后手术切除(40±10天);第二部分是探索性研究,第一部分临床获益的患者可继续使用PD-L1抑制剂Atezolizumab辅助治疗≤12个月。
主要终点是无EGFR/ALK突变NSCLC患者的主要病理缓解(MPR, 手术时≤10%存活肿瘤细胞)。次要终点包括不同PD-L1水平患者的MPR、肿瘤突变负荷(TMB)和不良事件(AEs)。生物标志物分析包括多重免疫荧光(mIF)图像分析、全外显子组测序、RNA测序和多参数流式细胞术。
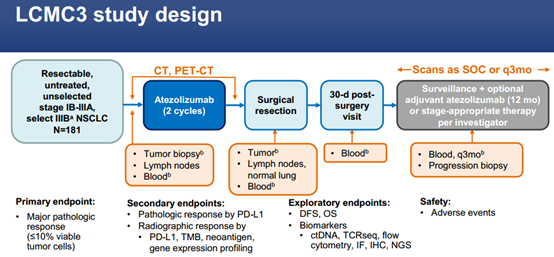
研究设计
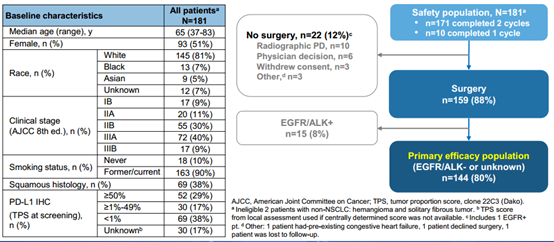
患者基线特征
此次报告分析了所有入组和给药NSCLC患者的术后随访数据(n=181)。基线特征为:平均年龄65.1岁,女性占51%,目前吸烟者19%,非鳞NSCLC 62%,IB期16例,IIA期20例,IIB期60例,IIIA期71例,IIIB期14例。
研究结果:1)在接受手术的无EGFR/ALK突变的患者中,MPR率为21%(30/144),病理完全缓解率(pCR)为7% (10/144; 95% CI: 3%-12%)。43%(66/155)患者接受阿替利珠单抗新辅助单抗治疗后实现降期,19%(29/155)患者的病理分期上升。
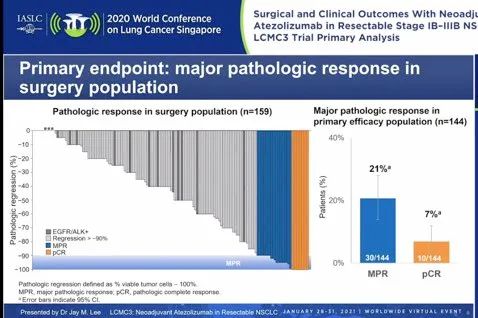
MPR和pCR

患者降期
2)阿替利珠单抗治疗后,术前和术中分别发现12%(22/181)和4%(7/159)患者不可切除。大部分患者95%(151/159)接受了解剖性切除术,101例患者接受微创手术,其中仅15%(15/101)患者接受了开胸手术。仅12%(19/159)患者在窗口期以外进行了手术。仅3%(5/159)患者有术中并发症。92%(145/159)患者达到完全切除(R0)。
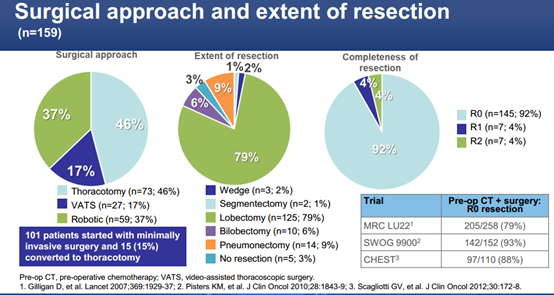
手术方案和疗效

TRAE、irAE
3)安全性:治疗相关不良反应(TRAE)和免疫相关不良反应(irAE):术前和术后≥3级TRAE分别为6%和14%;术前和术后≥3级irAE发生率为2%和9%。30天和30-90天术后死亡率皆为1/159(0.6%)。
4)此部分数据摘录自官网公布的摘要:a. MPR与PD-L1状态相关,TPS<1%患者的MPR为16%,TPS≥1%患者MPR为29% (P=0.117);TPS<50%时MPR为14%,TPS≥50%时MPR为37%(P=0.009)。b.生物标志物分析:①mIF图像分析显示,治疗增加CD3+/CD8+、GZMB+/CD8+T细胞相对CD3+/FOXP3+细胞的比值,提示T细胞激活的转变;②在已知EGFR/ALK阳性患者中未观察到MPR;③中位TMB为7.2个突变/Mb(0.8-43.5)(n=53),高TMB患者有更好的病理反应;④STK11/LKB1和KEAP1突变在非MPR患者中更为常见。
研究结论:1)研究达到主要终点,获得21%的MPR,与新辅助顺铂治疗相当,pCR达到7%;2)可切除的IB-IIIB期NSCLC中,Atezolizumab新辅助治疗的耐受性良好,没有新的安全信号;3)Atezolizumab新辅助治疗后:a.手术切除安全,围手术期发病率和死亡率低;b.很少在治疗方案窗口外进行;c.完全切除率高(92%)。该研究为正在进行的III期IMpower030研究提供了更多支持证据。

2020WCLC发布的摘要,个别数据与公布PPT有差别
辅助治疗
IMpower010研究
Lancet丨肺癌,T药术后辅助治疗延长“无癌生存”
IMpower010研究:是一项多中心、开放标签、III期随机对照研究,研究在22个国家和地区的227个地点进行。共有1280名IB期(肿瘤≥4 cm)至IIIA期NSCLC患者在完全切除后入组,通过区组随机化的方法(4 个区组大小)将接受辅助铂类化疗(1到4个周期)后的患者随机分配(1:1)接受辅助阿替利珠单抗(每 21 天 1200 mg;16 个周期或 1 年)或最佳支持治疗(观察和定期监测疾病复发)。
研究主要终点为研究者评估的DFS,次要终点为总生存(OS),进行分层分析:首先分析PD-L1 TC≥1%(SP263)的II-IIIA期NSCLC患者亚组,然后评估所有随机II-IIIA患者的DFS,然后在分析所有意向治疗(ITT)人群(IB-IIIA患者)的DFS和最终OS。疗效评估是基于随机的患者。安全性在可评估人群中(接受≥1剂阿替利珠单抗或BSC组接受≥1次基线后安全性评估的患者)进行。
之前第一次DFS期中分析(中位随访32.2个月后),与最佳支持治疗相比,阿替利珠单抗显著延长了无病生存。PD-L1表达≥1%的II-IIIA期患者:疾病进展或死亡风险降低34%(分层HR 0.66),3年无病生存率更高(60% vs 48%)。所有II-IIIA期患者:疾病进展或死亡风险降低21%(分层HR 0.79),3年无病生存率更高(56% vs 49%)。本次会议公布了第一个预先指定的OS期中分析和安全性分析,中位随访期为45.3个月,数据截止日期为2022年4月18日。

研究设计&统计学方法
研究结果:OS期中分析显示,1)在PD-L1≥1%的II~IIIA期人群中,阿替利珠单抗组和BSC组的中位OS均未达到(HR:0.71,0.49-1.03),36个月、60个月的OS率分别为82.1% vs 78.9%,76.8% vs 67.5%。2)在所有随机化人群中(II~IIIA期),阿替利珠单抗组和BSC组的中位OS均未达到(HR:0.95,0.74-1.24)。3)在所有意向治疗(ITT)人群(IB-IIIA患者)中,阿替利珠单抗组和BSC组的中位OS均未达到(HR:0.995,0.78-1.28,P=0.9661)。



4)此外,在PD-L1≥50%(II~IIIA期,排除EGFR/ALK+)人群中,阿替利珠单抗组和BSC组的中位OS均未达到(HR:0.42,0.23-0.78),36个月、60个月的OS率分别为89.1% vs 77.5%,84.8% vs 67.5%。
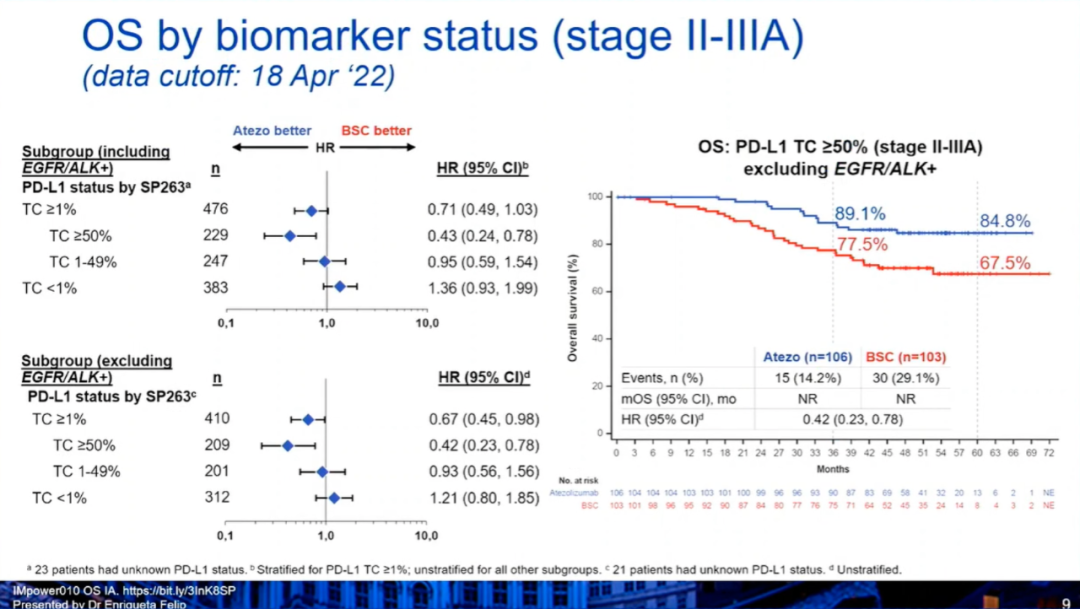
OS:PDL1≥50%
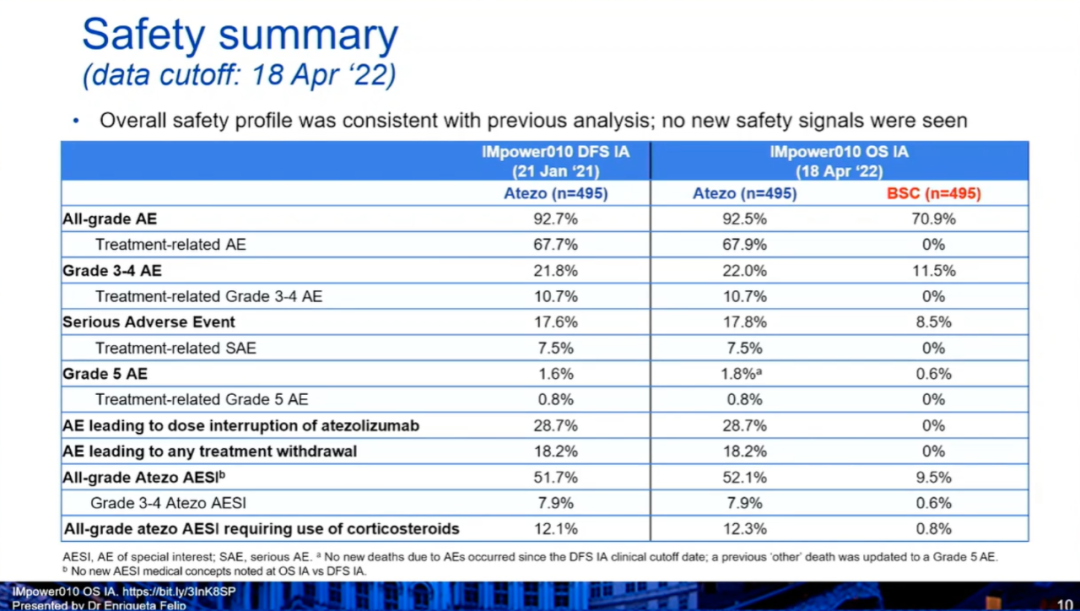
安全性
与2021年1月21日时的评估结果相似,阿替利珠单抗组治疗相关AE的发生率为67.9%,治疗相关3~4级AE的发生率为10.7%,治疗相关5级AE的发生率为0.8%。
小 结:在第一次预先指定的OS期中分析中,在PD-L1≥1%的II~IIIA期患者中,阿替利珠单抗组可以看到OS的获益趋势。但是在所有随机化人群和ITT人群中,没有显示出OS的获益趋势。安全性数据与之前相似,没有出现新的安全性信号。期待IMpower010研究的最终DFS分析以及后续的OS分析。(2022WCLC)
晚期一线治疗
单独免疫治疗
BIRCH&FIR:两项II期研究
BIRCH研究[1]是为了检测atezolizumab在晚期非小细胞肺癌各线治疗中的疗效, 纳入659名进展期PD-L1至少5%(TC2/3或IC2/3)无脑转移的NSCLC患者,包括一线(队列1:n=139)、二线(队列2:n=268)和三线及以上(队列3:n=252)。主要终点是ORR、次要终点OS、PFS等。三个队列的ORR分别是24%,19%和19%。高PD-L1表达(TC3/IC3)的患者ORR分别是32%,25%和30%。一线和二/三线的中位OS分别是20.1个月和14.7个月。
FIR研究[2]是为了观察atezolizumab在PD-L1选择性NSCLC患者中的临床活性和安全性,共纳入138例患者,纳入条件类似BIRCH研究。研究结果显示,一线治疗患者(n=31)的ORR是32%,经治的无脑转移患者(n=93)ORR是21%,经治有脑转移的患者(n=13)ORR是23%。TC3/IC3患者反应率更高。
IMpower110研究:免疫单药用于PD-L1高表达
IMpower110研究[3],是一项阿替利珠单抗单药(1200mgq3w)对比铂类为基础的化疗(非鳞癌培美曲塞+卡铂/顺铂,鳞癌吉西他滨+卡铂/顺铂)一线治疗PD-L1阳性转移性NSCLC的3期研究。纳入了572名TC或IC的PD-L1≥1%(使用SP142)鳞癌及非鳞癌患者,研究主要终点是排除EGFR突变或ALK易位患者,并且根据PD-L1选择的人群的总生存期。

研究结果:PD-L1表达高(TC3/IC3)的患者中,阿替利珠单抗的疗效显著超过化疗,中位OS分别是20.2个月 vs 13.1个月(HR 0.59,P=0.01)。PD-L1表达高或中表达患者中,OS未跨过预设的α界值(18.2个月 vs 14.9个月,HR 0.72,P=0.04),因此,任何PD-L1表达患者的OS未行正式检验。分子标志物分析发现,血检肿瘤突变负荷高(TMB,bTMB≥16)的患者具有更好的PFS和OS,分别为6.8 vs 4.4个月, 13.9 vs 8.5个月。安全性方面,3-4级AE发生率30.1% vs 52.5%。

阿替利珠单抗组和化疗组的总生存期
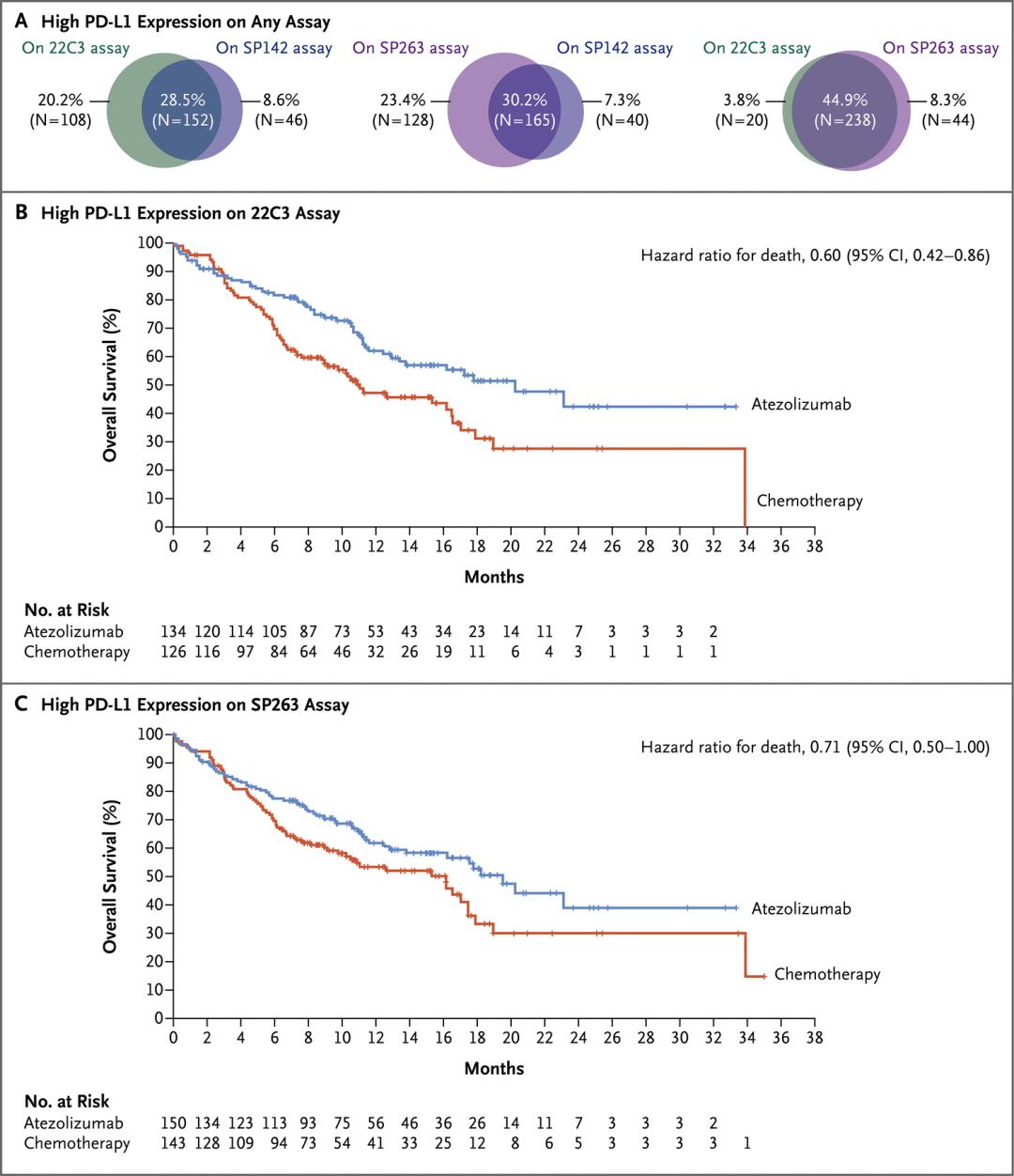
PD-L1表达高的患者的总生存期
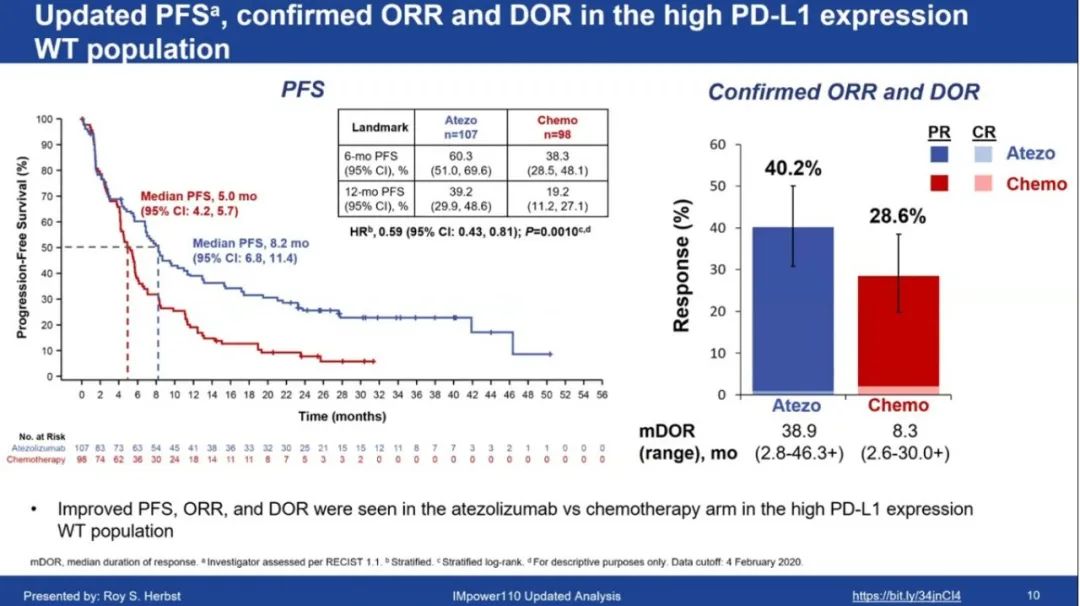
2020WCLC公布最新结果:数据截止2020年2月4日,中位随访31.3个月,在高PD-L1表达的WT组中,1)OS:阿替利珠单抗组vs化疗组的中位OS为20.2个月(n=107) vs 14.7个月(n=98);6个月OS率分别为76.5% vs. 70.4%;12个月OS率分别为66.1% vs. 52.3%(HR=0.76;95%CI:0.54-1.09)。2)PFS:替利珠单抗组vs化疗组的中位PFS为8.2 vs 5.0个月;6个月PFS率分别为60.3% vs. 38.3%;12个月PFS率分别为39.2% vs. 19.2% (HR=0.59;95%CI:0.43-0.81;P=0.0010)。3)ORR/DOR:阿替利珠单抗组的确认ORR为40.2%,化疗组为28.6%,两组的中位DOR分别为38.9个月vs. 8.3个月。

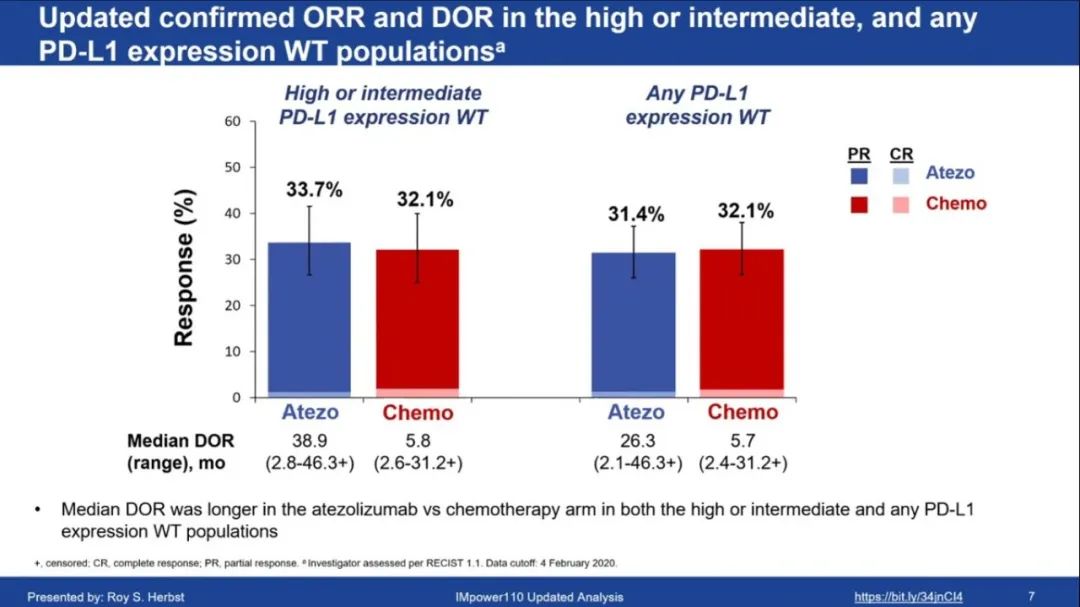
安全性:IMpower110研究更新后的安全性分析与最初分析结果一致,在较长的随访中没有观察到阿替利珠单抗新的安全信号。阿替利珠单抗组中有33.9%患者出现3级或4级AEs,而化疗组这一数据为53.2%,其中3级和4级治疗相关AEs(TRAEs)在两组分别为14.3%和44.9%。严重AEs发生率分别为31.8%和29.3%,其中9.4%和15.6%与治疗有关;停药患者分别占7.3%和17.1%。
2020年5月18日,美国FDA主要基于IMpower110研究批准阿替利珠单抗单药一线治疗EGFR/ALK阴性、PD-L1高表达(TC≥50%或IC≥10%)的转移性NSCLC患者。
备注:PD-L1高表达定义为肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)。
免疫+化疗
IMpower130研究:获批非鳞癌一线
IMpower130是一项多中心、随机、开放标签的III期临床研究[4],对比免疫联合化疗(atezolizumab+卡铂+白蛋白紫杉醇)与单独化疗(卡铂+白蛋白紫杉醇)在晚期非鳞NSCLC患者的疗效。共纳入724名患者,免疫联合化疗组451例,化疗组240例。研究的共同主要终点为EGFR/ALK 野生型患者(n=679)中,研究者评估的PFS和OS;次要终点包括意向性人群(ITT人群)中研究者评估的PFS和OS等。
研究结果:免疫联合化疗组对比化疗组可以显著改善结局,两组的中位PFS 7.0月 vs 5.5月(HR 0.64),中位OS 18.6月 vs 13.9月(HR 0.79)。对ITT人群进行分析,阿替利珠单抗依旧可以带来获益,两组的PFS 7.0月 vs 5.6月(HR 0.65),OS 18.1月 vs 13.9月(HR 0.80)。然而行亚组分析,具有EGFR/ALK基因改变(n=44)、肝转移和不吸烟者的PFS、OS无改善。两组的3-4级AE发生率为81% vs 71%,免疫相关AE发生率45%,多为1-2级,常见的AE包括皮疹、甲状腺功能减退和肝炎。
<< 滑动查看下一张图片 >>
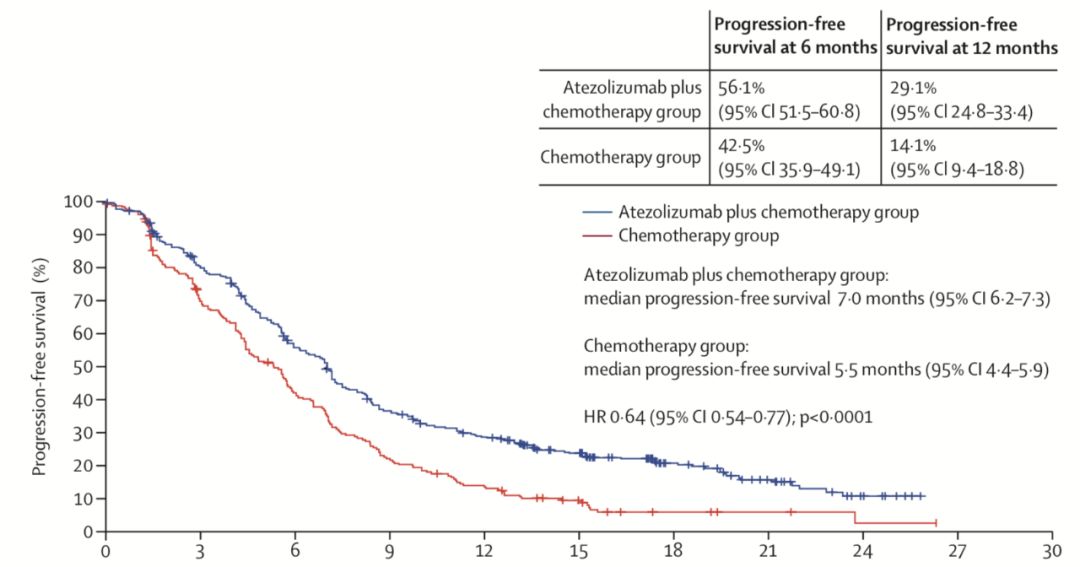
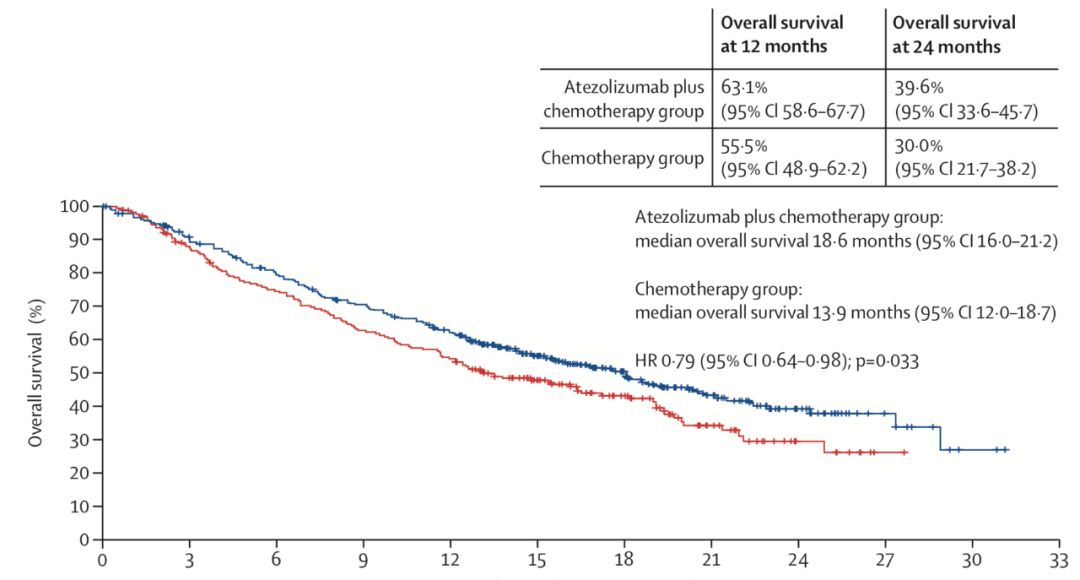

2019年12月,FDA基于此结果批准“atezolizumab+卡铂+白蛋白紫杉醇”用于无EGFR/ALK改变的非鳞癌NSCLC患者的一线治疗。
IMpower132:非鳞癌,改变化疗方案,OS不具统计意义
IMpower 132研究[5]: 是一项对比Atezolizumab联合培美曲塞铂类(APP组)与培美曲塞铂类(PP组)在晚期非鳞NSCLC患者的疗效。研究入组了578例EGFR/ALK野生型的初治晚期非鳞NSCLC患者,1:1随机分配接受,在完成4-6个周期的诱导治疗后,分别给予Atezolizumab联合培美曲塞或培美曲塞单药维持治疗。主要研究终点为研究者评估的PFS和OS。
<< 滑动查看下一张图片 >>
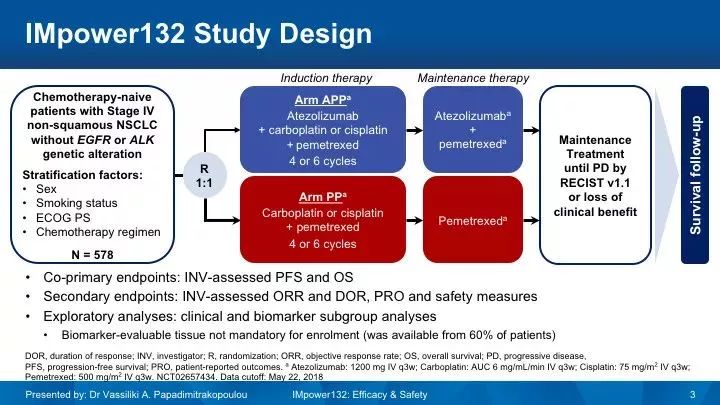
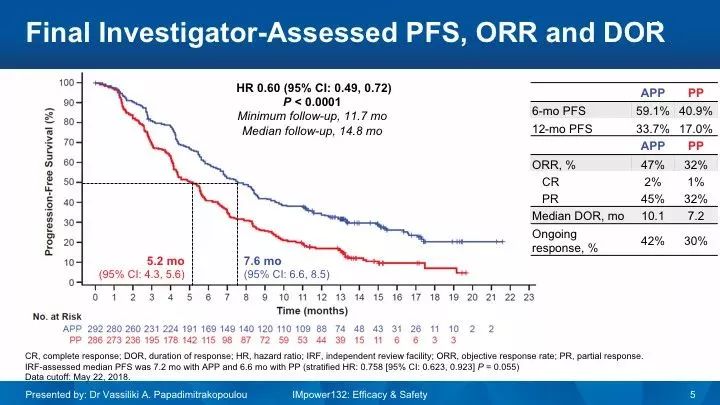
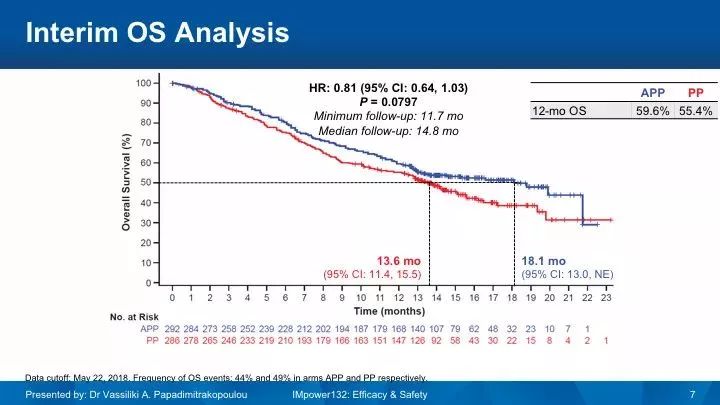
2018年WCLC公布的结果显示,联合组的PFS优于化疗组,中位PFS分别是7.6个月 vs 5.2个月(HR 0.60),然而两组的中位OS中期分析未达到统计学意义,中位OS分别是18.1个月 vs 13.6个月(HR 0.81,P=0.0797)。两组3-4级TRAE发生率分别是54% vs39%。
PFS的亚组分析,结果显示接受4个周期化疗的患者相比于6个周期化疗的患者,从Atezolizumab的联合治疗中获益更多,这是一个有趣的现象,这也提示我们免疫联合化疗的周期数有待探索;此外,和既往研究不同的是,非吸烟者也从阿替利珠单抗联合治疗中获益更多。期待最终的研究结果。
IMpower131:鳞癌一线失利
IMpower 131是随机对照的Ⅲ期临床试验[6],纳入1021例Ⅳ期鳞状NSCLC患者,患者既往未接受过一线化疗(EGFR或ALK基因突变患者已接受靶向治疗)。其中343例患者接受T药+化疗(卡铂+白蛋白紫杉醇),对照组340例患者单纯接受化疗(卡铂+白蛋白紫杉醇)。给药周期均为4或6周期,用药至病情进展(PD)。
<< 滑动查看下一张图片 >>

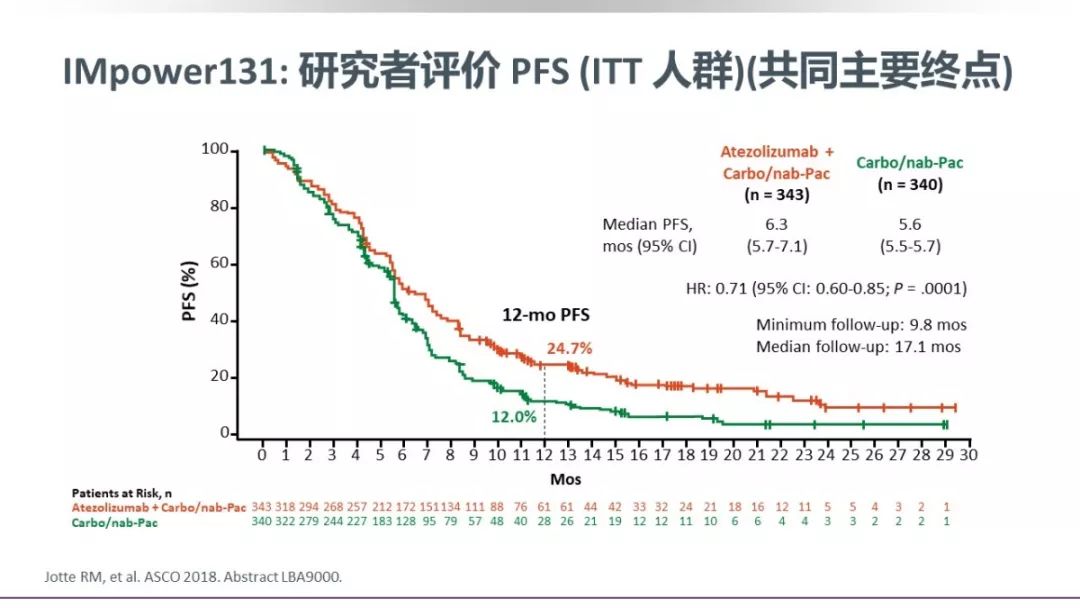

研究结果显示:T药+化疗相比单纯化疗可以显著改善PFS,两组的中位PFS分别是6.3个月 vs 5.6个月(HR0.71,P=0.0001);然而遗憾的是,OS并未达到预期,分别是14.2个月 vs 13.5个月(HR 0.88,P=0.16)。不过,在PD-L1高表达的TC3/IC3组,ACnP方案获益明显,中位PFS分别是10.1个月 vs 5.1个月(HR 0.41),中位OS分别是23.4个月 vs 10.2个月(HR 0.48)。

安全性:两组的3-4级AE发生率为68.0%VS57.5%,严重AEs发生率为47.9%VS 28.7%。
免疫+免疫
CITYCYPE研究:TIGIT靶点增敏免疫+T药,疗效翻倍,但需依赖PD-L1表达
2020ASCO丨肺癌,免疫治疗最新进展汇总
CITYCYPE研究:旨在探讨TIGIT单抗Tiragolumab+阿替利珠单抗和阿替利珠单抗单药一线治疗PD-L1阳性、局部晚期不可切除或转移性NSCLC的疗效和安全性的II期临床研究。2020ASCO年会上,公布数据初步证实了联合方案的有效性。2020年WCLC大会报道为标志物分析。探索性分析了PD-L1(22C3和SP263检查方法)、TIGIT及PVR作为tira+atezo治疗的预测生物标志物的价值。研究结果如下:
①联合方案在不同PD-L1表达亚组疗效
1)数据显示,PD-L1各亚组患者比例在两种免疫组化检测中具有可比性。
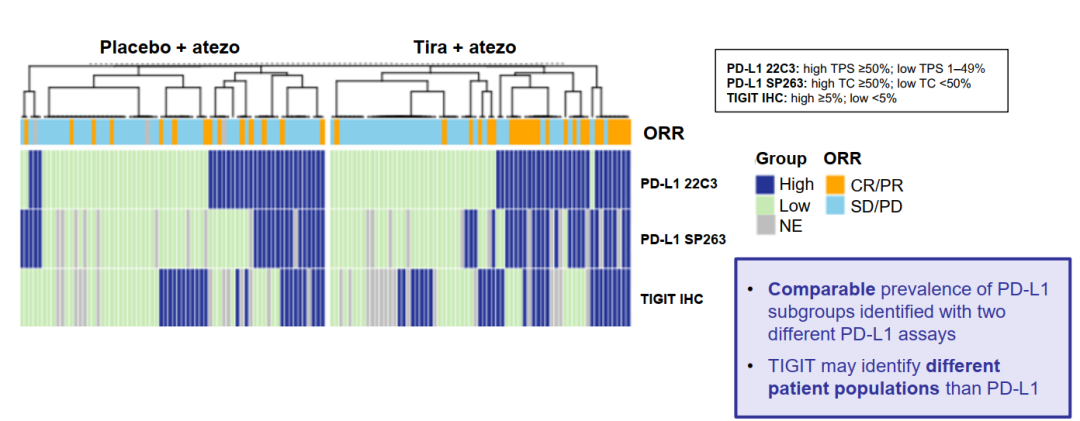
2)22C3 TPS≥1%的患者和SP263 TC≥1%的患者接受tiragolumab联合阿替利珠单抗治疗的客观缓解率(ORR)均优于阿替利珠单抗单药组,两者结果一致。联合组无进展生存期(PFS)延长;在PD-L1高表达人群中,联合组所带来的PFS获益更加显著。

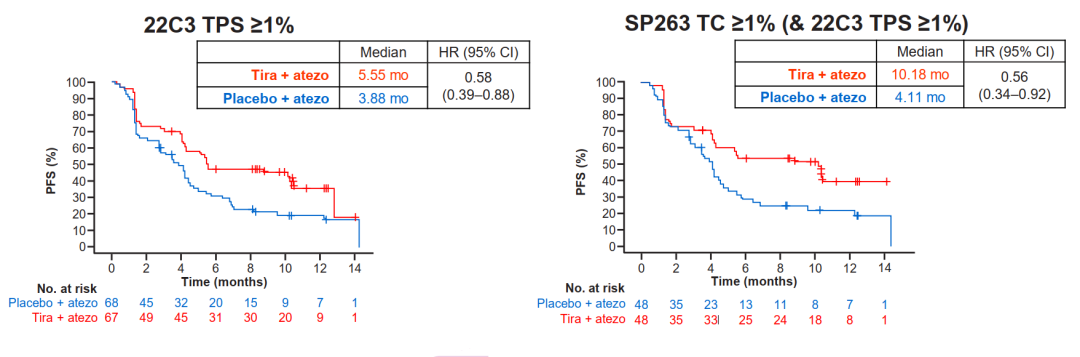
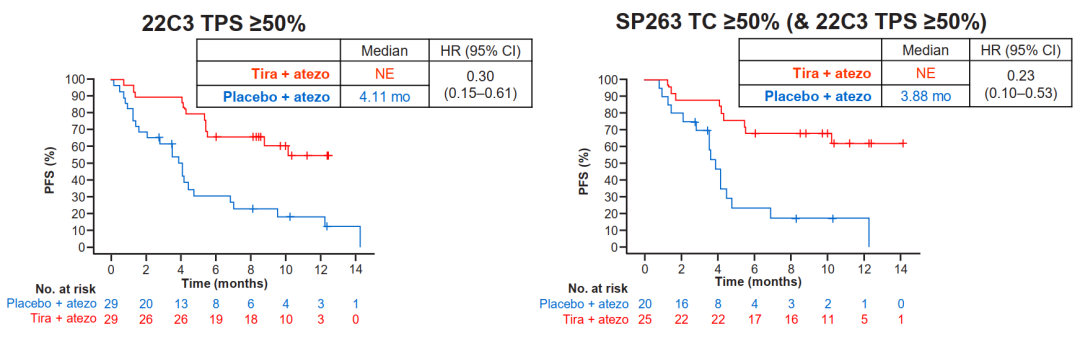
上述结果表明,无论是22C3或SP263 IHC评估,PD-L1高表达可能是tiragolumab联合阿替利珠单抗一线治疗转移性NSCLC的重要预测标志物。
②TIGIT、PVR表达与PFS无明显关联
另一方面,在TIGIT和PVR亚组中,高、低表达亚组人群的PFS大体相似。未发现TIGIT或PVR高表达与临床结局相关。然而,鉴于分析的样本量较少,将在后续大型研究中进一步证实结果。

TIGIT、PVP各表达亚组的PFS
免疫+化疗+抗血管
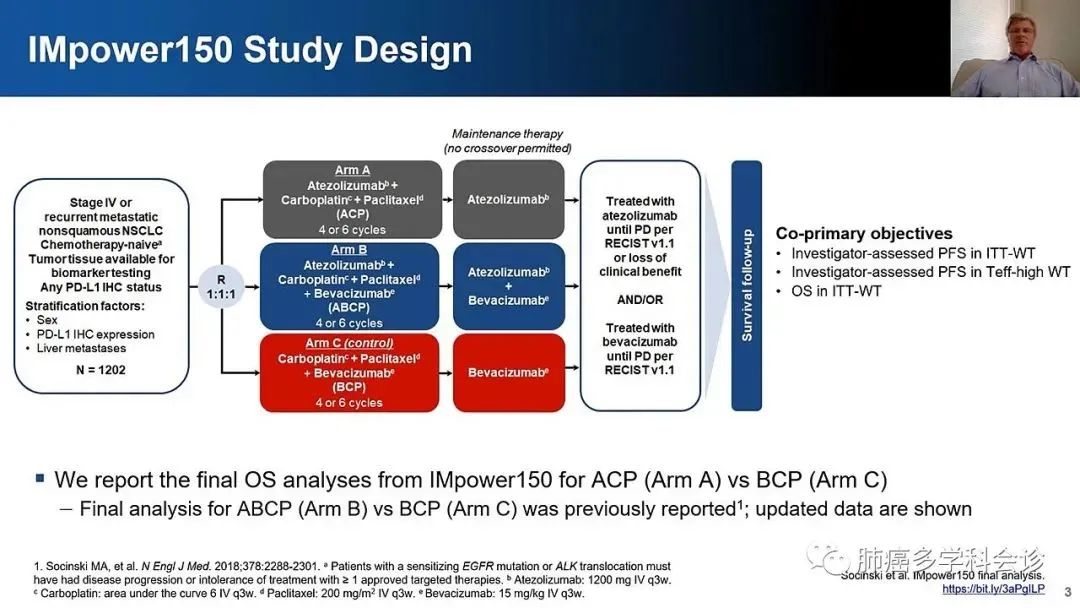
IMpower150:豪华方案获批,唯一可用于突变患者的免疫方案
IMpower150研究是一项探索阿替利珠单抗联合贝伐珠单抗及卡铂紫杉醇(ABCP)一线治疗晚期非鳞NSCLC的随机对照Ⅲ期临床试验,主要研究终点为意向性治疗人群野生型(ITT-WT)患者和Teff-high WT患者的无进展生存(PFS),以及ITT-WT人群的OS。
既往报告的数据显示[7、8],在ITT-WT患者中,ABCP组的PFS显著长于BCP组,两组分别为8.3月 vs 6.8月(HR 0.61,P<0.001),OS分别是19.2月 vs 14.7月(HR 0.78,P=0.02)。ORR和DoR,ABCP组均优于BCP组(ORR:63.5% vs.48.0%;DoR:9.0个月 vs. 5.7个月)。
2020AACR年会上更新了IMpower150研究各组总生存结果[9],阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇(ABCP组)和阿替利珠单抗+卡铂+紫杉醇(ACP组)分别对比贝伐珠单抗+卡铂+紫杉醇(BCP组),一线治疗晚期非鳞非小细胞肺癌(NSCLC)的最终总生存时间(OS)结果,并对EGFR敏感突变、肝转移以及PD-L1表达状态进行了亚组分析。
<< 滑动查看下一张图片 >>
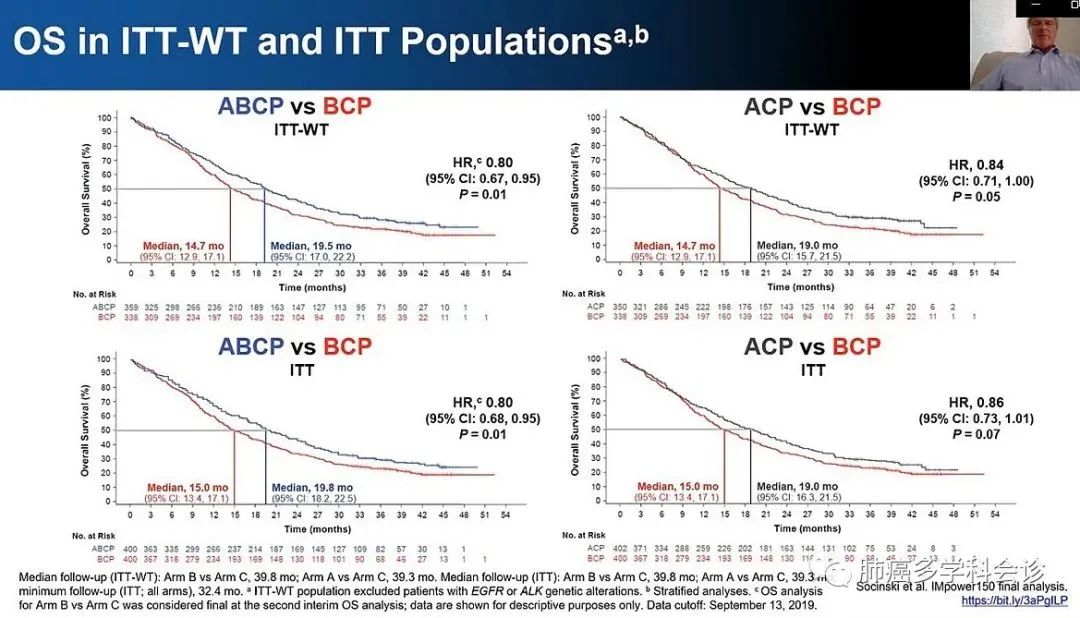
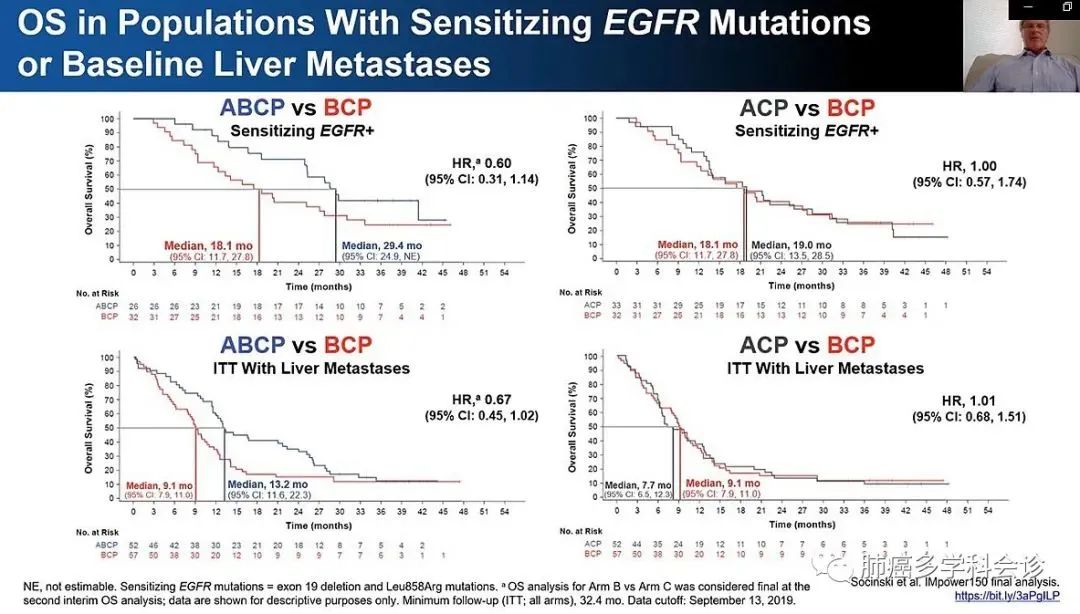
结果显示:中位随访约40个月,ABCP组对比BCP组的OS获益与中期分析时保持一致,两组的中位OS分别为19.5个月和14.7个月(HR 0.80,P=0.01)。【目前大多数免疫治疗相关研究设计的对照组方案以含铂双药化疗为主,实际上BCP方案也是无驱动基因突变晚期非鳞NSCLC的标准一线治疗方案,且能使患者获益更多。因此,IMpower150研究选择BCP方案作为对照组,ABCP方案仍显著改善OS,提示ABCP方案更具有临床意义。】
ITT-WT人群中ACP组的中位OS较BCP组延长了4.3个月,19.0个月 vs. 14.7个月(HR 0.84,P=0.05)。随着更长时间的随访,BCP组在后续治疗过程中有高达46.4%的患者接受了至少一次免疫治疗,这可能延长了BCP组患者的OS。
该研究还更新了EGFR敏感突变患者的中位OS数据。在EGFR敏感突变的患者中,ABCP组对比BCP组,中位OS提高了11.3个月,29.4个月 vs. 18.1个月,HR=0.6(95%CI0.31~1.14)。各组间较少的入组人数及占比可能影响了统计学效能(ABCP组26例,BCP组32例)。从ABCP组与BCP组的生存曲线可以明显看到,两组在治疗初期生存曲线就有清晰的分离,提示有明显的获益趋势。此外,在EGFR敏感突变的患者中,ACP组较BCP组未观察到OS获益。
亚组分析提示,IMpower150研究是目前唯一免疫联合治疗在EGFR敏感突变亚组NSCLC患者中OS获益的随机前瞻性Ⅲ期临床试验。对于EGFR TKI治疗失败的后线治疗,在贝伐珠单抗+化疗的标准疗法基础上联合阿替利珠单抗,将成为一种新的治疗选择。
IMpower系列中数项研究均预设肝转移作为分层因素。在IMpower150研究肝转移亚组中,ABCP组较BCP组OS延长了4.1个月,分别为13.2个月和9.1个月(HR=0.67,95%CI 0.45~1.02)。从生存曲线上可观察到,在治疗初期,两条OS曲线就已明显分开。而ACP组对比BCP组,未见显著OS差异(9.1个月 vs 7.7个月,HR=1.01,95%CI 0.68~1.51)。
在ITT-WT人群中,基于IHC检测的PD-L1表达水平分层,无论患者PD-L1的表达状态如何,ABCP组较BCP组均有不同程度OS的改善。IMpower150研究中ABCP方案,即阿替利珠单抗联合贝伐珠单抗及紫杉醇卡铂方案,目前已是NCCN指南推荐的一线非鳞NSCLC的标准治疗方案,已在包括美国在内的十余个国家获批用于一线治疗非鳞NSCLC,无论PD-L1表达状态如何。
同样在TC1/2/3或IC1/2/3的患者中,ACP方案对比BCP方案也具有显著的临床获益,24.4个月 vs. 16.0个月(HR=0.71,95%CI0.55~0.91);而TC0/IC0患者使用ACP方案或BCP方案,无显著OS差异。提示对于PD-L1表达阳性的患者,阿替利珠单抗联合紫杉醇卡铂化疗方案是我们新的临床治疗选择。在PD-L1表达阴性患者中,贝伐珠单抗联合化疗方案仍是一线非鳞NSCLC的治疗基石。
IMpower150研究是首个也是目前唯一一个证实免疫治疗联合抗血管生成药物和化疗方案在一线治疗转移性非鳞NSCLC中,PFS及OS均得到显著获益阳性结果的临床Ⅲ期研究。阿替利珠单抗联合贝伐珠单抗及紫杉醇卡铂方案一线治疗转移性非鳞NSCLC,无论患者PD-L1的表达状态如何,OS均有不同程度的改善。
对于EGFR TKI治疗失败的EGFR敏感突变NSCLC患者,以及肿瘤侵袭性较强,高肿瘤负荷或肿瘤体积较大,亟需疾病缓解的NSCLC患者(如伴肝转移),ABCP方案亦能带来持续的OS获益,并且安全耐受,ABCP方案或将成为一线非鳞NSCLC患者的临床治疗新选择。此外,对于PD-L1表达阳性的非鳞NSCLC 患者,一线阿替利珠单抗联合紫杉醇卡铂亦为我们提供了新的治疗选择。对于PD-L1表达阴性的患者,临床上贝伐珠单抗联合化疗方案仍是目前的标准治疗。
目前正在中国人群中开展的IMpower151研究,旨在探索阿替利珠单抗联合贝伐珠单抗及紫杉醇/培美曲塞卡铂方案,在未接受化疗的Ⅳ期非鳞NSCLC患者的疗效及安全性。
在年龄≥65岁的患者中,TIS的安全性特征与所有年龄≥18岁的患者相似。
T药汇总分析
汇总分析:PD-L1/PD-1抑制剂改变了晚期NSCLC的治疗。有证据表明,使用这些药物时irAE的发生可预测癌症(如NSCLC)的结局改善。III期IMpower130、IMpower132和IMpower150试验评价了阿替利珠单抗+化疗±贝伐珠单抗作为NSCLC的一线治疗。研究者在这些试验中探索irAE与疗效之间的相关性。

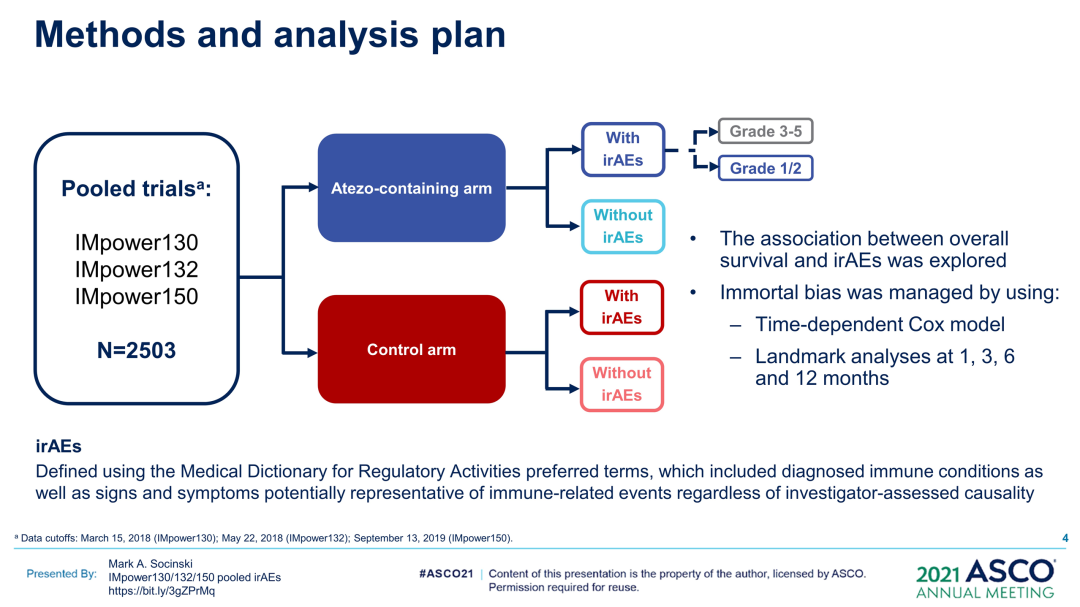
研究方法:每项试验均入组了未接受过治疗的IV期非鳞状NSCLC患者。患者被随机分配接受:IMpower130中的卡铂+白蛋白结合型紫杉醇单药或联合阿替利珠单抗;IMpower132中的卡铂或顺铂单药或联合阿替利珠单抗;IMpower150中的阿替利珠单抗(A)+贝伐珠单抗(B)+卡铂+紫杉醇(CP)、ACP或BCP。汇总数据(数据截止日期:2018年3月15日[IMpower130];2018年5月22日[IMpower132];2019年9月13日[IMpower150]),并按治疗(含阿替利珠单抗vs对照)和irAE状态进行分析。使用时间依赖性Cox模型和1、3、6和12个月时的界标分析控制永生偏倚。研究方案要求,如果发生≥3级irAE(Gr),则应中断/停止阿替利珠单抗治疗。
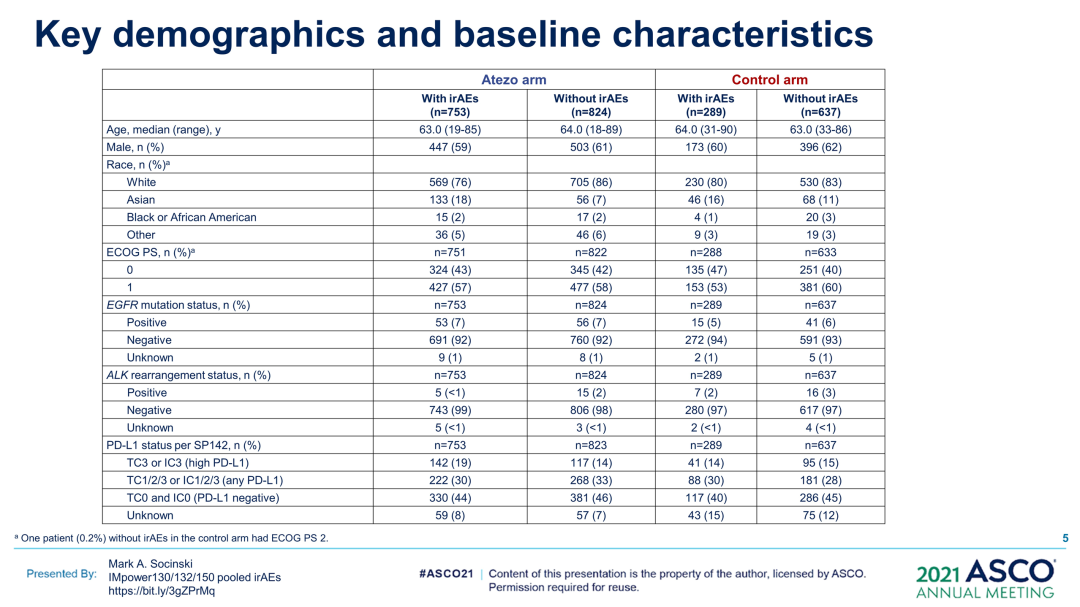
研究结果:2503例患者被纳入分析(阿替利珠单抗,n=1577;对照,n=926)。在两组中,发生irAE(阿替利珠单抗,n=753;对照,n=289)和未发生irAE(阿替利珠单抗,n=824;对照,n=637)的患者之间的基线特征大体平衡。48%(阿替利珠单抗)和32%(对照)的患者发生任何Gr irAE;11%(阿替利珠单抗)和5%(对照)发生3-5级irAE。最常见的irAE(阿替利珠单抗组vs对照组)为皮疹(28%vs18%)、肝炎(实验室异常;15%vs10%)和甲状腺功能减退症(12%vs4%)。至首次发生irAE的中位时间为1.7个月(阿替利珠单抗组)vs1.4个月(对照组)。
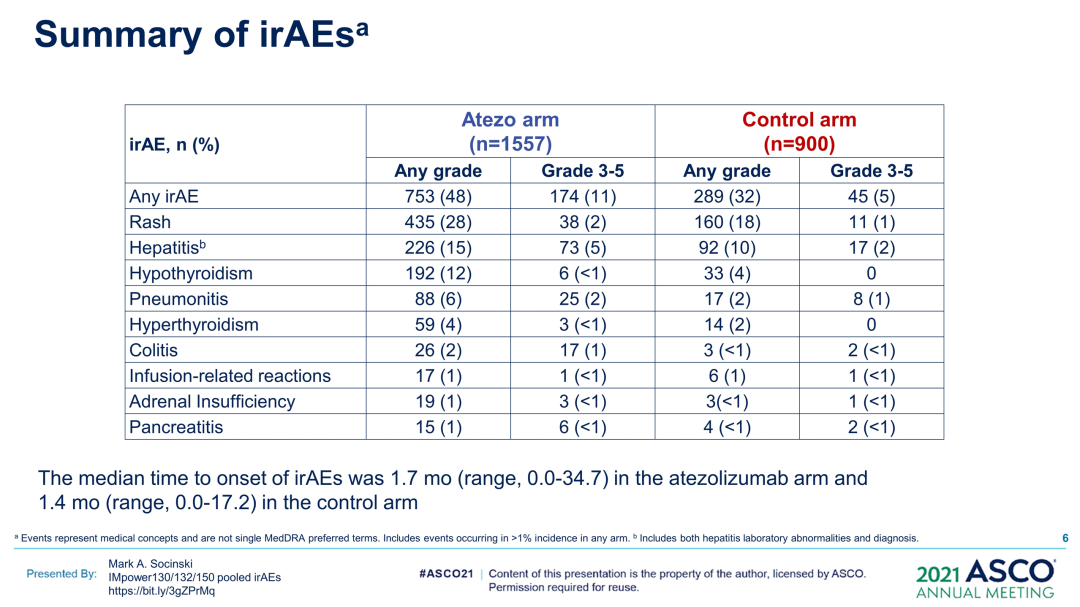
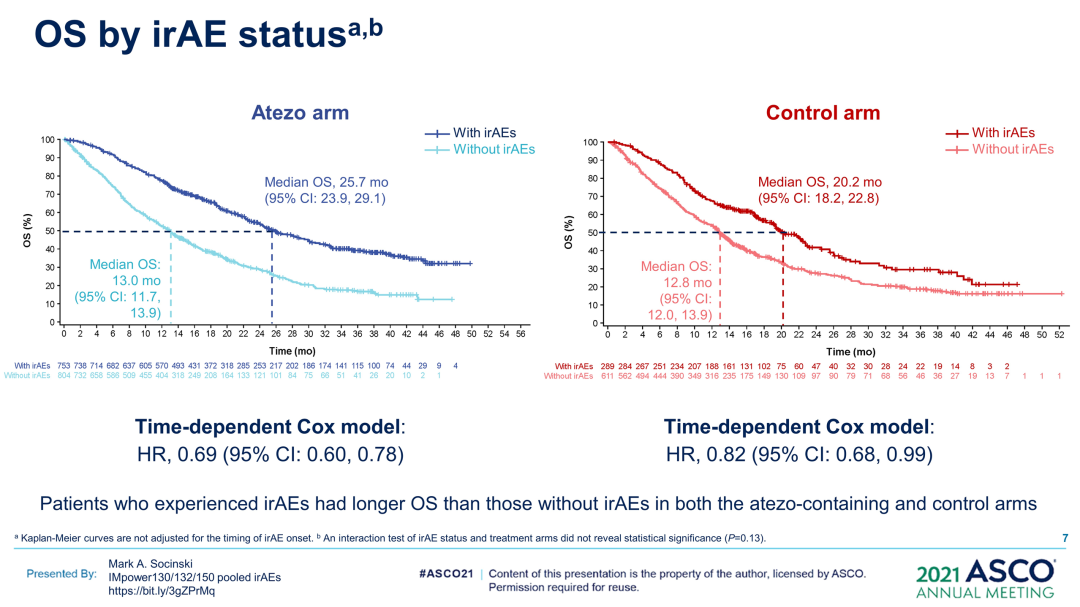
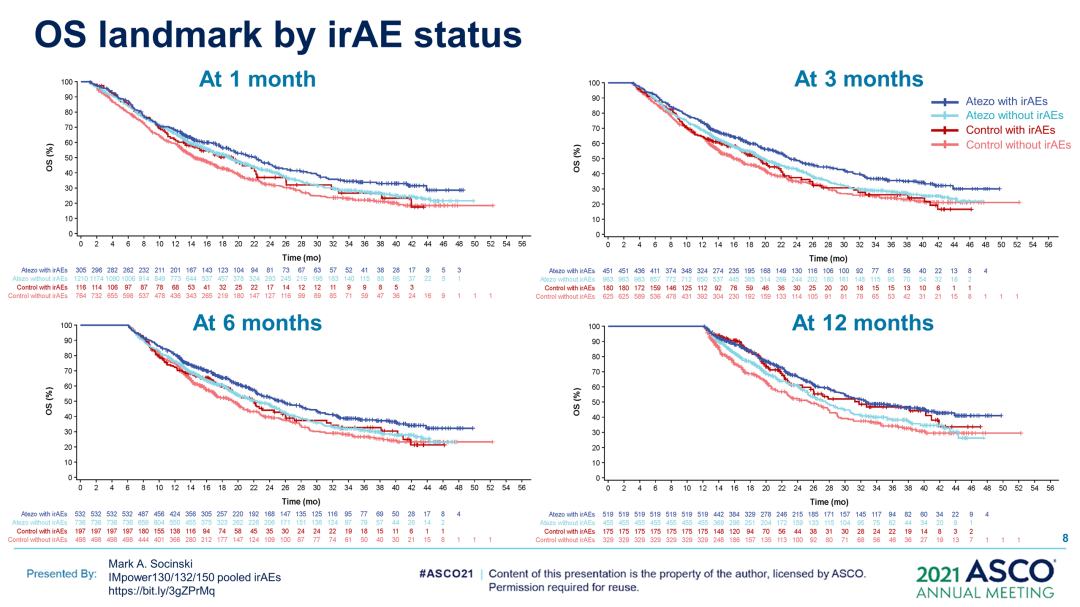

根据时间依赖性Cox模型,阿替利珠单抗组出现与未出现irAE的患者之间的OS HR(95%CI)为0.69(0.60,0.78),对照组为0.82(0.68,0.99);排除皮疹(被认为是特异性最低的irAE)后,OS、HR(95%CI)分别为0.75(0.65,0.87)和0.90(0.71,1.12)。



研究结论:在这项探索性汇总分析中,根据时间依赖性Cox模型和界标分析,在含阿替利珠单抗治疗组和对照组中,发生irAE的患者的OS长于未发生irAE的患者;排除皮疹后,阿替利珠单抗治疗组仍然存在这一趋势。界标分析表明,阿替利珠单抗组中发生1/2级irAE的患者的OS最长,发生≥3级irAE的患者的OS最短,这可能是由于治疗中断/停药所致。(2021ASCO,9002)
晚期二线治疗
POPLAR & OAK:一举拿下适应症
2期POPLAR研究[10]共入组了287名经过铂类化疗后进展的晚期NSCLC患者,随机接受阿替利珠单抗或多西他赛治疗,首要终点是意向治疗(Intention-to-treat ,ITT)人群和PD-L1阳性人群的总生存(Overall Survival. OS)。ITT人群中,两组的中位OS 12.6月 vs 9.7月(HR= 0.73,P=0.04),无进展生存(Progression-Free Survival,PFS)和客观反应率(ObjectiveResponse Rate,ORR)则无显著差异。
57名阿替利珠单抗治疗后RECIST进展后继续阿替利珠单抗治疗的患者仍有获益,进展后OS 11.1个月,而接受其他治疗是8.3个月(n=30)。研究中3-4级不良事件(AE)发生率 40% vs 53%,3-4级治疗相关不良事件(TRAE)发生率 11% vs 39%。

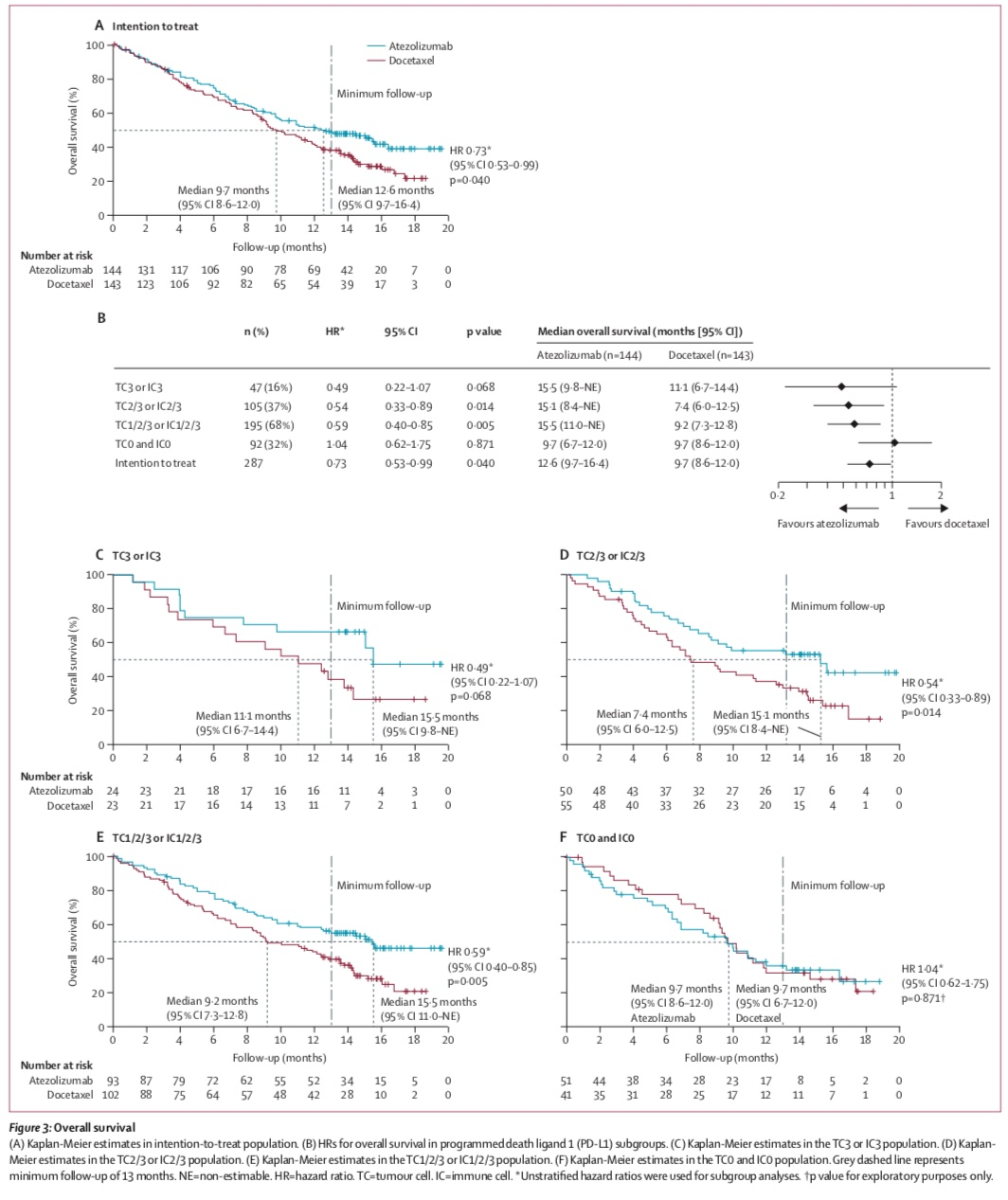

POPLAR是第一个将PD-L1检查点抑制剂应用与经治NSCLC患者的临床研究。与多西紫杉醇相比,Atezolizumab显著增加了此类患者的生存期,而且这一提高与肿瘤组织中PD-L1的表达有关,表明PD-L1高表达患者从Atezolizumab中获益更多。在安全性评价中,Atezolizumab显示出比较好的耐受性,与化疗药物相比安全性也更好。
3期OAK研究[11]的1225名患者接受二线阿替利珠单抗或多西他赛治疗,共首要终点是ITT人群的OS和PD-L1阳性人群的OS。ITT人群中,中位OS分别是13.8个月 vs 9.6个月(HR 0.73,P=0.0003)。PFS和ORR类似。PD-L1阳性人群中,中位OS分别是15.7个月 vs 10.3个月(HR 0.74,P=0.0102)。3-4级AE 发生率37% vs 54%,免疫相关不良反应(irAE)包括肺炎(1%,3级<1%),肝炎(<1%)和结肠炎(<1%)。
行标志物分析,OAK研究的获益和PD-L1表达(肿瘤细胞/肿瘤浸润免疫细胞[TC/IC])具有相关性,最大获益在PD-L1最高表达人群(TC3/IC3),中位OS 20.5个月 vs 8.9个月;但是TC0/IC0的患者,阿替利珠单抗依旧优于多西他赛,中位OS 12.6个月 vs 8.9个月。
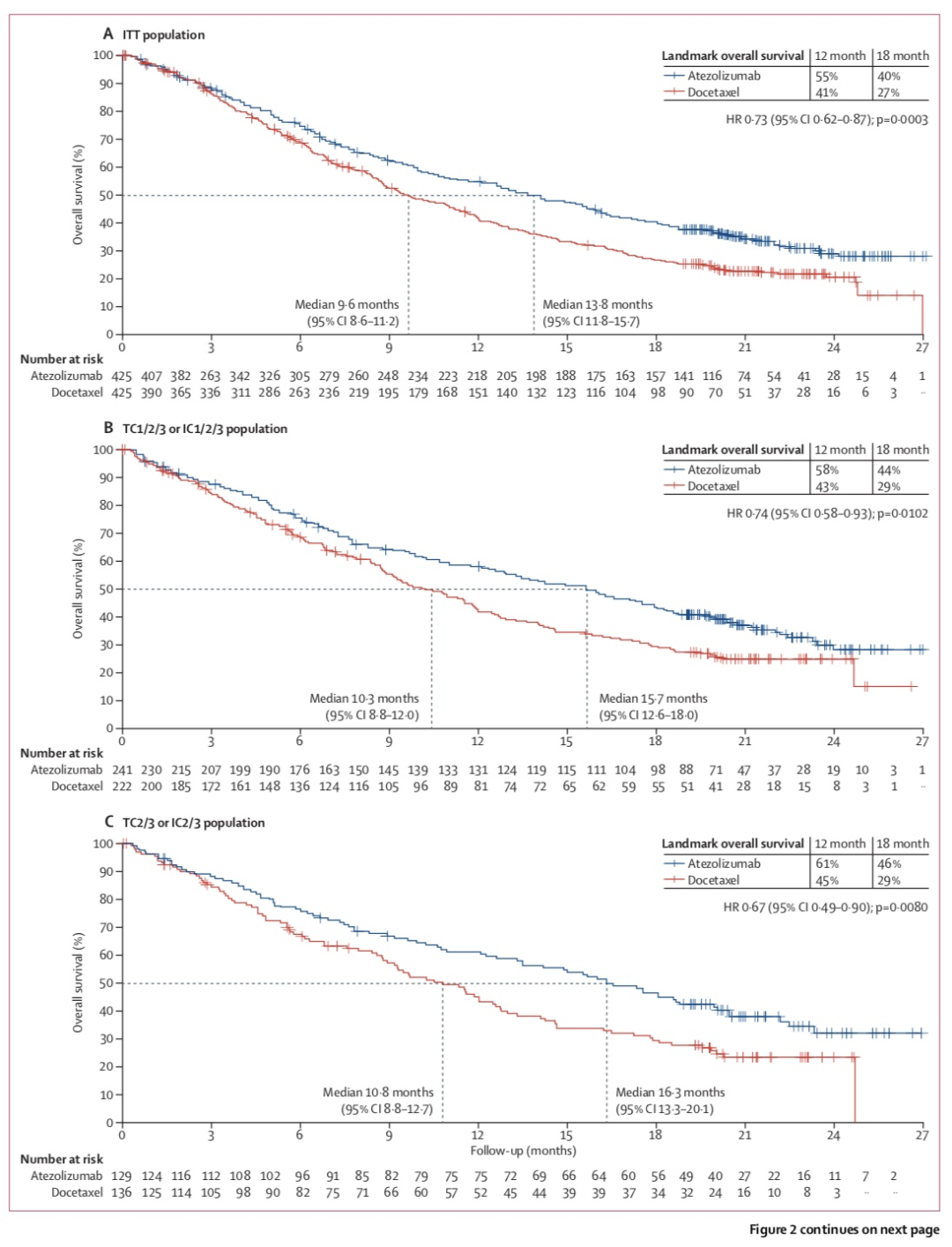
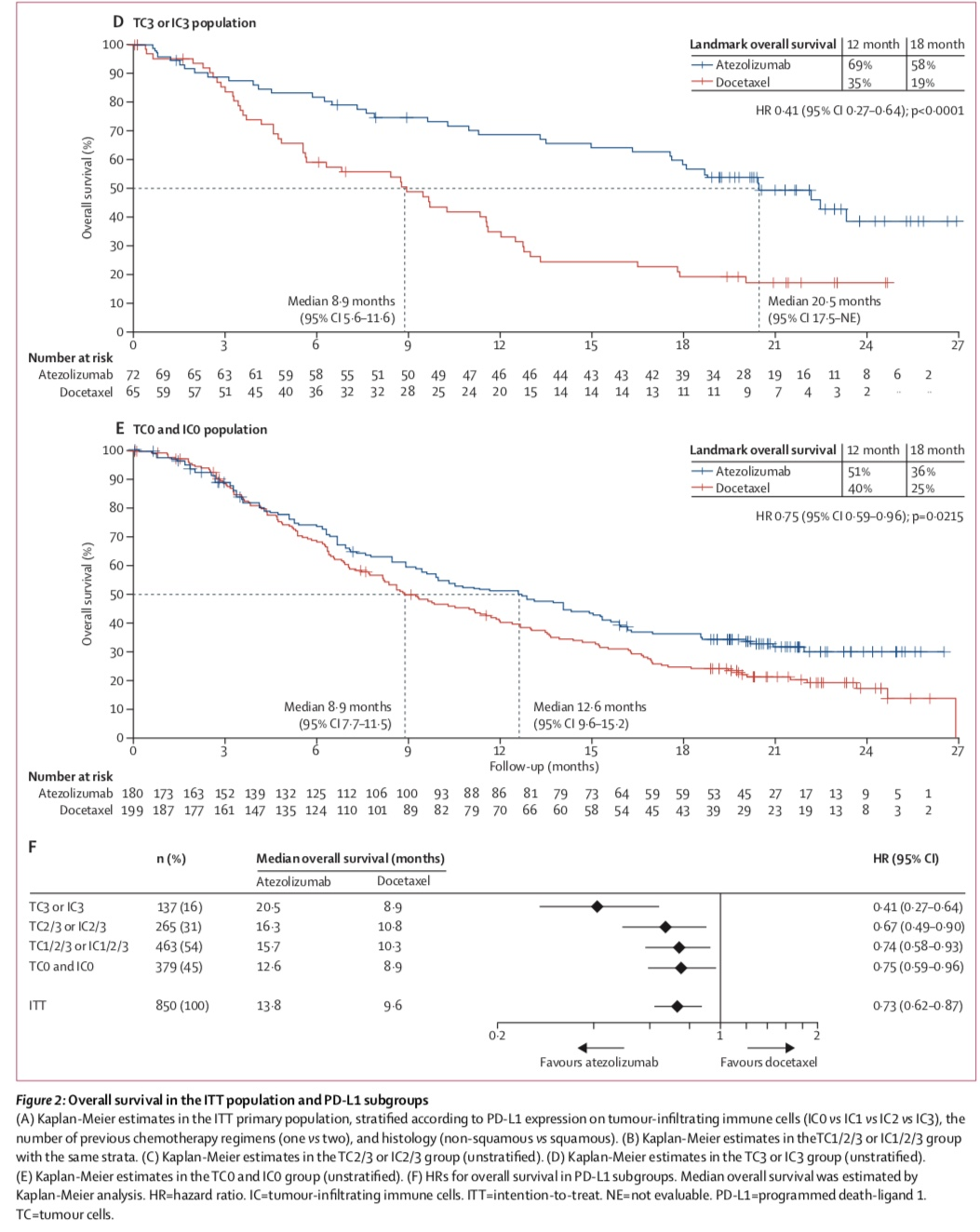


进一步分析不同组织学类型(鳞癌 vs 非鳞癌)、基线脑转移状态、吸烟史、EGFR突变状态患者的疗效,除EGFR突变亚组(HR=1.24 [95% CI 0.71–2.18]),其余各亚型患者更倾向于从Atezolizumab的治疗中获益。
2016年5月18日,基于POPLAR和OAK研究,阿替利珠单抗获得FDA批准,用于铂类化疗进展后的NSCLC。之后,中国药监局(NMPA)也批准了阿替利珠单抗的这一适应证。
2020年ESMO会议公布的数据显示,POPLAR和OAK研究的最短随访时间分别为53和45个月,POPLAR研究4年的生存率:阿替利珠单抗组为14.8%,多西他赛组为8.1%。
OAK研究4年的生存率:阿替利珠单抗组为15.5%,多西他赛组为8.7%。在各组织学类型和PD-L1表达亚组中均观察到阿替利珠单抗所带来的长期OS获益。
小细胞肺癌
IFCT-1603:二线治疗败北
IFCT-1603 研究[12]是一项评估一线EP方案治疗进展后阿替利珠单抗(1200 mg, 每3周一次)与化疗(拓扑替康或原治疗方案)相比疗效及安全性的2期临床试验。73名患者2:1随机接受阿替利珠单抗或常规化疗,首要终点为6周ORR。
结果显示,阿替利珠单抗组和化疗组6周ORR分别为2.3%、10%,PFS分别为4.3、1.4个月(HR=2.26,95% CI: 1.3–3.93, P=0.004),但两组的OS无差异(9.5 vs. 8.7 个月; HR=0.84, 95% CI: 0.45–1.58, P=0.6)。
IMpower133:改写ES-SCLC一线治疗历史
IMpower133研究[13]为一个全球性Ⅰ/Ⅲ期双盲、随机、安慰剂对照试验,将403例初治的广泛期SCLC患者随机等比分组,分别给予Atezolizumab+EP方案4个周期诱导化疗,序贯Atezolizumab维持治疗(201例)或EP方案+安慰剂治疗(202例),序贯安慰剂维持治疗并且随访,直至疾病进展或出现不可耐受不良反应或不再临床获益。该研究的主要终点为OS以及研究者评估的PFS。
结果显示,中位随访13.9个月,Atezolizumab显著延长OS(中位OS,12.3个月 vs. 10.3个月,HR=0.70,95%CI0.54~0.91,P=0.007),两组中位PFS分别为5.2个月和4.3个月(HR=0.77,95%CI 0.62~0.96,P=0.02)。此外,Atezolizumab联合用药的安全性与已报道的单药的安全性一致,无新的发现。
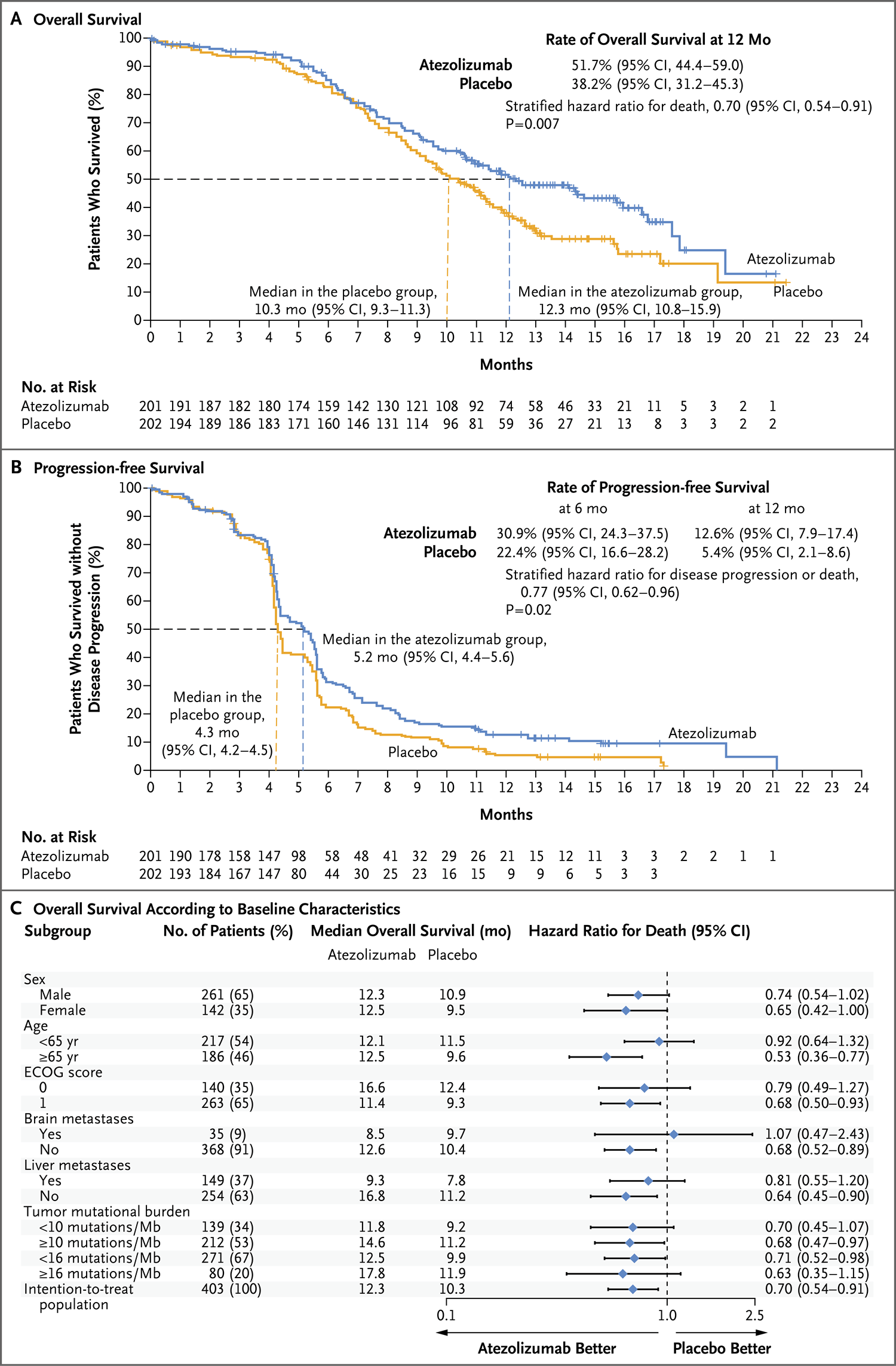

IMpower133终结了ES-SCLC 30年来治疗无进展的困境,可以称之为ES-SCLC治疗史上的里程碑。
尼+阿替利珠单抗对比多西他赛治疗经ICI和含铂化疗进展患者的疗效和安全性。
ASTRUM-005研究
ASTRUM-005研究为一项在既往未接受过治疗的ES-SCLC患者中开展的比较斯鲁利单抗联合化疗(卡铂-依托泊苷)及安慰剂联合化疗(卡铂-依托泊苷)的有效性和安全性的随机、双盲、国际多中心、III期临床研究。纳入的患者按照2:1的比例随机分为两组,分别接受静脉输注斯鲁利单抗或安慰剂联合化疗,每三周一次,直至疾病进展、死亡、毒性不耐受、受试者撤回知情同意,或出现方案规定的其他情况(以先发生者为准)。研究的主要终点为总生存期(OS)。

研究结果:截至2021年10月22日,本研究共入组585名合格的患者(斯鲁利单抗组,n=389;安慰剂组,n=196),中位随访时间为12.3个月。斯鲁利单抗组和安慰剂组的中位OS分别为15.4个月(95% CI 13.3-NE)和10.9个月(95% CI 10.0-14.3),风险比(HR)为0.63(95% CI 0.49-0.82;p<0.001)。两组的24个月总生存率分别为43.1%和7.9%。斯鲁利单抗组及安慰剂组经独立影像评估委员会(IRRC)依据RECIST v1.1评估的中位PFS分别为5.7和4.3个月(HR 0.48,95% CI 0.38-0.59)。IRRC依据RECIST v1.1评估的ORR(80.2% vs. 70.4%)及DOR(中位DOR,5.6 vs. 3.2个月)也能观察到疗效的提升。
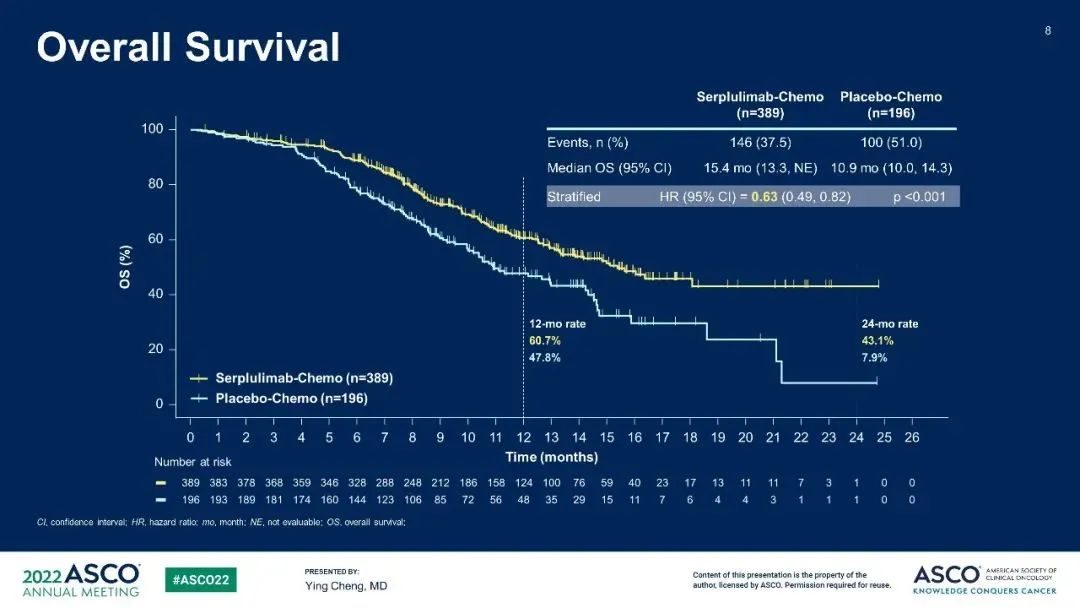


两个试验组分别有129(33.2%)及54(27.6%)名患者发生三级及以上与斯鲁利单抗或安慰剂相关的治疗相关不良事件(TRAEs)。斯鲁利单抗组的免疫相关不良事件(irAEs)发生率较安慰剂组高,且与已获批的PD-1/PD-L1单抗相似。
小结:试验结果表明,斯鲁利单抗联合卡铂-依托泊苷能明显改善一线ES-SCLC患者的OS,且其安全性与之前的研究结果一致。斯鲁利单抗有望成为全球首个一线治疗ES-SCLC的抗PD-1单抗产品,为此类患者提供一种新的治疗选择。
参考文献
[1]Wakelee H etal.Phase II Trial of Atezolizumab for Patients with PD-L1-Selected AdvancedNSCLC(BIRCH): Updated Efficacy and Exploratory Biomarker Results: Topic:MedicalOncology. J Thorac Oncol. 2016; 11:S251–S2.
[2]Spigel DR etal.Clinical activity and safety from a phase II study (FIR) of MPDL3280A(anti-PDL1) in PD-L1-selected patients with non-small cell lung cancer (NSCLC).J Clin Oncol. 2015; 33(suppl) abst 8028.
[3] Herbst RS, etal.Atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC.N Engl J Med. 2020.
[4] West H etal.Atezolizumab in combination with carboplatin plus nab-paclitaxelchemotherapy compared with chemotherapy alone as first-line treatment formetastaticnon-squamous non-small-cell lung cancer (IMpower130): amulticentre,randomised, open-label, phase 3 trial. Lancet Oncol. 2019Jul;20(7):924-937.
[5] IMpower132:PFS and Safety Results with 1L Atezolizumab+Carboplatin/Cisplatin+Pemetrexed inStageIV Non-Squamous NSCLC. WCLC 2018
[6] JotteR et al.Atezolizumab in Combination With Carboplatin and Nab-Paclitaxel inAdvancedSquamous NSCLC (IMpower131): Results From a Randomized Phase III Trial. J Thorac Oncol. 2020, 15(8): 1351-1360
[7]Socinski MA,Jotte RM, Cappuzzo F, et al. Atezolizumab for First-Line Treatment ofMetastatic Nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24):2288-2301.
[8]Reck M etal.Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lungcancer(IMpower150): key subgroup analyses of patients with EGFR mutations orbaseline liver metastases in a randomised, open-label phase 3 trial. Lancet Respir Med.2019 May;7(5):387-401.
[9]Socinski MA,MokTSK,Nishio M,et al.IMpower150 final analysis:Efficacy of atezolizumab(atezo)+bevacizumab(bev) and chemotherapy in first-line(1L) metastatic nonsquamous(nsq)non-small cell lung cancer(NSCLC) across key subgroups[EB/OL].2020 AACR,abstract CT216.
[10]Fehrenbacheret al.Atezolizumab versus docetaxel for patients with previously treatednon-small-cell lung cancer (POPLAR): a multicentre, open-label, phase2randomised controlled trial. Lancet. 2016; 387:1837-46.
[11]Rittmeyer A etal.Atezolizumab versus docetaxel in patients with previouslytreatednon-small-cell lung cancer (OAK): a phase 3, open-label, multicentrerandomised controlled trial. Lancet. 2017; 389:255–65.
[12] Pujol JL etal. A Randomized Non-Comparative Phase II Study of Anti-Programmed CellDeath-Ligand1 Atezolizumab or Chemotherapy as Second-Line Therapy in PatientsWith Small Cell Lung Cancer: Results From the IFCT-1603 Trial. J Thorac Oncol.2019May;14(5):903-913.
[13] HornL et al.First-Line Atezolizumab plus Chemotherapy in Extensive-StageSmall-Cell LungCancer. N Engl J Med. 2018 Dec 6;379(23):2220-2229.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







