JEM:增强神经发生挽救阿尔茨海默病
2022-11-04 brainnew神内神外 brainnew神内神外
阿尔茨海默病(AD)患者和家族性阿尔茨海默症(FAD)小鼠模型海马神经发生受损。然而,新生神经元是否在记忆障碍中起着因果关系的作用尚不清楚。
导读:
阿尔茨海默病(AD)患者和家族性阿尔茨海默症(FAD)小鼠模型海马神经发生受损。然而,新生神经元是否在记忆障碍中起着因果关系的作用尚不清楚。近期,Orly Lazarov团队在《JOURNAL OF EXPERIMENTAL MEDICINE》杂志上发表“ Augmenting neurogenesis rescues memory impairments in Alzheimer’s disease by restoring the memory-storing neurons”的研究论文。作者研究发现在海马依赖性记忆任务后,未成熟神经个体被积极地招募到engram中。然而,这种招募在FAD小鼠中严重不足。招募的未成熟神经元表现出受损的脊突密度和改变的转录谱。FAD小鼠神经发生的定向增强恢复了engram中新神经元的数量、树突棘密度以及未成熟和成熟神经元的转录特征,最终导致记忆的恢复。而AD中神经发生增强后未成熟神经元的化学遗传失活,逆转了小鼠的表现,并降低了记忆。而与AD连锁的App、ApoE和Adam10是engram中最高的差异表达基因,表明神经发生缺陷导致AD患者的记忆障碍。
 FAD小鼠DG中更多的新神经元导致海马依赖性记忆任务的表现更好
FAD小鼠DG中更多的新神经元导致海马依赖性记忆任务的表现更好
为了研究增强成年海马神经发生是否能挽救FAD的学习和记忆缺陷,作者设计了一种具有可诱导神经发生的FAD小鼠模型。将5xFAD小鼠和野生型小鼠与NestinCreERT2;B a xfl/fl小鼠杂交(图1A)。雌性NestinCreERT2; Baxfl/fl(NB)或NestinCreERT2; Baxfl/fl; 5xFAD(NBF)小鼠在1月龄时用他莫昔芬(T-NB或T-NBF)或玉米油处理(分别为C-NB或C-NBF;图1 B)。定量聚合酶链式反应证实重组诱导的bax基因缺失75%(图S1 A)。为了支持先前的报告,Bax基因的缺失增强了神经前体细胞(NPC)的存活,并导致神经发生的增加。重组后增殖性神经母细胞的数量有增加的趋势,但没有明显增加(图S1 B),可能是因为Bax的缺失提高了这些细胞的存活率,而不是它们的增殖速度,因此主要表现为未成熟神经元和新生神经元的数量增加。值得注意的是,与C-NB小鼠相比,C-NBF小鼠中增殖的神经母细胞数量显著减少,支持AD患者神经发生减少的观点(图S1 B)。与年龄和性别匹配的C-NB小鼠相比,T-NB的未成熟神经元(双皮质素[DCX]+;图1 C)数量明显更高,新神经元的存活率更高(BrdU+NeuN+;图1 D),以及有更多的未成熟神经元(DCX+NeuN+;图1,E和F)。与C-NB相比,C-NBF的未成熟神经元明显减少,新神经元的存活率和数量减少(图1,C-F),验证了这一模型再现了5xFAD中海马神经发生的损伤。重要的是,与C-NBF相比,T-NBF小鼠有明显更多的未成熟和新的神经元(图1,C-F)。为了研究增加的神经发生是否能挽救FAD小鼠的记忆障碍,以及未成熟神经元是否积极参与疾病中的记忆畸形,四组小鼠接受了一种新的对象定位(NOL)测试。C-NB和T-NB表现相似,60%的时间用于探索新位置的物体(图1,G和H)。同样,他们的辨别指数相似(图1 I)。这可能暗示了上限效应,或者行为范式在检测记忆性能的离散改善方面具有有限的敏感性。值得注意的是,C-NBF小鼠未通过测试,优选探索旧位置,表现为阴性鉴别指数(图1,H和I)。重要的是,T-NBF小鼠表现出显著改善的性能,增加了对新位置的偏好,并具有与NB小鼠相似的更大的辨别指数(图1,H和I)。为了进一步表征增强的神经发生对AD记忆的影响,另一组C-NB、T-NB,C-NBF和T-NBF小鼠接受不同的行为测试,使用海马依赖性CFC测试检查联想记忆(图1 J)。与它们在NOL试验中的表现相当,C-NB和T-NB小鼠能够将环境与休克相似地很好地关联,在试验日平均冻结40%(图1K)。C-NBF小鼠在该试验中表现不佳,在试验日平均冷冻20%(图1K)。重要的是,T-NBF小鼠在平均冷冻30%的情况下,与休克相关的上下文显著更好(图1K)。为了进一步证实上述发现,我们通过对小鼠进行明暗测试来表征其焦虑水平。四组小鼠表现出相当程度的焦虑(图S1 C)。综上所述,这些结果强烈表明,FAD小鼠海马神经发生的增强显著改善了空间识别和背景记忆。
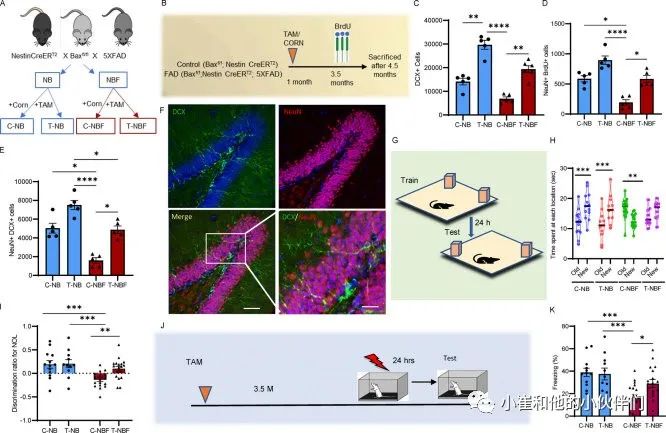
图1 FAD 小鼠神经发生增强后海马依赖性记忆的拯救
新生神经元在FAD的记忆获取中起作用
为了探讨未成熟神经元是否通过参与记忆形成来拯救FAD中的记忆,作者试图跟踪记忆获取后激活的神经元。为此,作者使用了一种基于Tet-off的病毒engram标记试剂盒,该试剂盒由AAV9-cFos-tTA和AAV9-TRE-ChR2-eYFP的混合物组成。在将混合物立体定向注射到DG之前1周,小鼠开始接受强力霉素饮食,并在给予足部电击前18小时取出,以允许在记忆采集期间激活的神经元中表达增强的黄色荧光蛋白(eYFP)(图2,A和B)。与抗c-fos抗体的联合免疫染色验证了eYFP+神经元表达c-fos,表明这些神经元在记忆获得过程中被招募到神经元集合中,并在记忆恢复过程中被重新激活(图2,B和D)。先前的一项研究报告称,某些AAV血清型在注射后18小时内诱导BrdU标记细胞大量死亡,并且没有证据表明在注射后3个月内成年神经发生恢复。为了检查病毒engram标记试剂盒是否影响当前研究中的神经发生程度,作者比较了预先注射了病毒载体的小鼠(图1 D)和没有注射的小鼠(图S1 D)中存活的未成熟神经元(NeuN+BrdU+)的数量,观察到两组小鼠的数量相当。为了进一步验证作者的标记方法的特异性,对饲养在笼中的小鼠的EYFP+、Eg r-1+、e Y F P+Egr-1+、DCX+EYFP+Egr-1+、DCX+EYFP+Egr-1+细胞数进行了检测。与接受CFC的小鼠相比,作者观察到这些小鼠的DG中激活的细胞数量明显较少,这表明观察到的这些细胞被招募到记忆回路中是对CFC高度特异的。为了研究新的神经元是否参与记忆获取,以及FAD小鼠的神经发生增加是否导致新的神经元更多地被招募到记忆回路中,作者首先量化了四组小鼠大脑中eYFP+细胞的总数。与行为一致,作者观察到在C-NB和T-NB中有相似数量的细胞被招募到印迹中。因此,进一步的量化集中在行为受损的FAD小鼠的engram及其神经发生增强(T-NBF)后的状态。在C-NB、C-NBF和T-NBF小鼠中,CFCs训练后被招募到engram细胞总数(即EYFP+细胞)相似(图2 C)。为了检测EYFP+神经元的总数,作者用抗NeuN抗体对脑切片进行了共染色。观察到NeuN+eYFP+的数量与所有组的eYFP+细胞总数相似,这表明在DG获得记忆后招募的细胞是神经元。实验组间NeuN+EYFP+细胞总数相似(图2 E)。有趣的是,两组之间在新神经元的数量上观察到了显著的差异。与C-NB组小鼠相比,C-NBF组小鼠(Neun+DCX+EYFP+)中新生的神经元的数量显著减少(图2,F,I)。并且T-NBF小鼠激活的新神经元Neun+DCX+EYFP+的数量显著增加(图2F)。在分析不同组中被招募到记忆回路中的新神经元(Neun+BrdU+EYFP+)的存活率时,也观察到了类似的结果(图2G)。并且与C-NBF组和T-NBF组相比,C-NBF组激活的新神经元占激活神经元总数的百分比显著降低(%(Neun+DCX+EYFP+)/总EYFP+细胞;图2 H)。总之,这些结果表明,在C-NBF小鼠的记忆获取过程中,较少的未成熟神经元被招募到engram中,而增强神经发生导致招募更多的未成熟神经元,与C-NB小鼠中的数量相当。此外,这些结果表明,招募到engram的未成熟神经元数量减少与C-NBF的行为受损相关,而在T-NBF小鼠中,未成熟神经元的数量增加与完整的行为表现相关。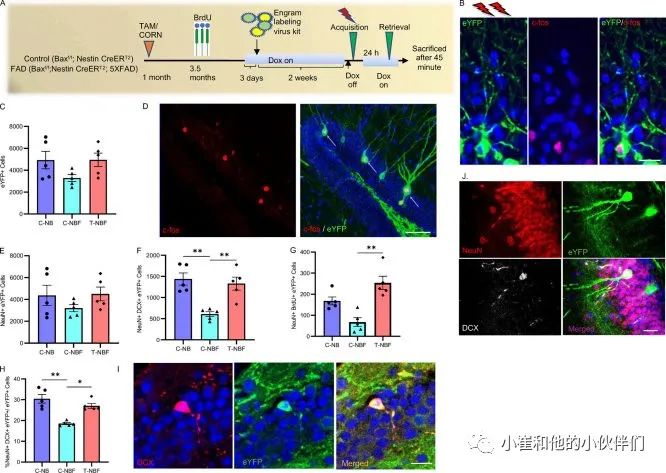
图2 增强神经发生挽救未成熟神经元重新进入记忆回路
在FAD小鼠中,获得记忆时被招募的神经元在检索时被重新激活的较少
为了进一步阐明新的神经元在记忆印迹中的作用,作者继续探索,在情境记忆获得过程中被招募的未成熟的神经元是否在重新检索该记忆时被重新激活。为了确定这一点,作者检测了Egr-1(Zif268)的水平,这是一种以前被认为是记忆恢复的即时早期基因。这一分析表明,测试诱导激活后表达即刻早期基因Egr-1的细胞总数(Egr-1+细胞)在三组中相似,这表明在记忆恢复过程中招募的神经元总数不会因FAD基因或海马神经发生的水平而改变(图3 A)。值得注意的是,与C-NB小鼠相比,C-NBF小鼠的DCX+Egr-1+细胞数量显著减少(图3 B)。在T-NBF小鼠中,随着神经发生的增加,这个数字显著增加,这表明增加的神经发生导致在记忆提取过程中招募更多的未成熟神经元(图3 B)。与C-NBF小鼠相比,在记忆获得和提取过程中招募的EYFP+Egr-1+细胞总数在C-NBF小鼠中有所降低,在T-NBF小鼠中增加(图3,C和H)。在记忆和提取过程中招募的未成熟神经元的数量(DCX+EYFP+Egr-1+)显示,与C-NB相比,C-NBF的数量减少,但没有统计学意义,而T-NBF组显著增加(图3,D和I)。三组之间在记忆检索期间招募的未成熟神经元(DCX+eYFP+Egr-1+)的数量变化与他们在获取过程中的招募直接相关。显然,在检索过程中被激活但在获取过程中不被激活的未成熟神经元的数量(DCX+EYFP−Egr-1+)没有显示出治疗或基因型的影响(图3 E)。这一结果表明,增强神经发生特别是增加了参与记忆获得的新神经元的数量。值得注意的是,在获取过程中招募的成熟神经元的数量和在提取过程中重新激活的数量在三个试验组之间是相似的(图3 F)。对每个实验组中参与神经元组合的未成熟和成熟神经元比例的检查显示,与C-NBF相比,C-NBF的记忆回路中未成熟神经元的数量减少,只有11%的新神经元在C-NBF的DG中,而C-NB中为20%。随着神经发生的增强,这一比例在T-NBF中增加到35%(图3 G)。综上所述,该研究表明在FAD小鼠中,为形成记忆而被招募到神经元集合中的未成熟神经元的数量受到影响。因此,FAD小鼠被招募到engram中的神经元总数减少,导致记忆力减退。神经发生的增强导致参与记忆形成的新神经元数量增加,从而使记忆得到了恢复。

图3 在增强神经发生后,FAD小鼠在情景记忆检索中重新激活的未成熟神经元的数量增加
神经发生增强后FAD小鼠未成熟神经元参与engram的突触棘密度增强
突触病理是阿尔茨海默病最早的损害之一,与记忆障碍有关。为了阐明在T-NBF小鼠的神经发生增强后,新神经元在engram中的增强招募是否与记忆恢复有关,作者观察了这些细胞的脊椎密度是否发生了变化。为了回答这个问题,作者量化了C-NB、C-NBF和T-NBF小鼠DG中DCX+EYFP+Egr-1+细胞中树突棘的密度。与树突棘在记忆形成中起重要作用的观点一致,树突棘在阿尔茨海默病中受损,作者观察到,与C-NB相比,C-NBF内新生的神经元突触密度较低(图4,A和B)。并且T-NBF内engram新神经元的突触密度已恢复(图4,A和B)。为了深入了解在engram的树突中观察到的棘突的类型,作者量化了蘑菇样棘突的数量和细棘突的密度。作者观察到与C-NB相比,C-NBF小鼠的树突中蘑菇样棘突的数量减少,而T-NBF小鼠的蘑菇样棘突数量恢复(图4 C)。在细棘突中也观察到了类似的趋势;然而,C-NBF和T-NBF之间的差异没有统计学意义(图4 D)。对棘突密度与细胞体距离的量化显示,C-NBF和T-NBF的密度相当,而C-NBF的棘突密度一直很低,显著低于C-NBF(图4,E-G)。有趣的是,作者观察到神经发生的增强挽救了engram中三级树突的数量(EYFP+Egr-1+细胞;图A-C)。总之,这些结果支持新生神经元在T-NBF小鼠记忆恢复中的作用。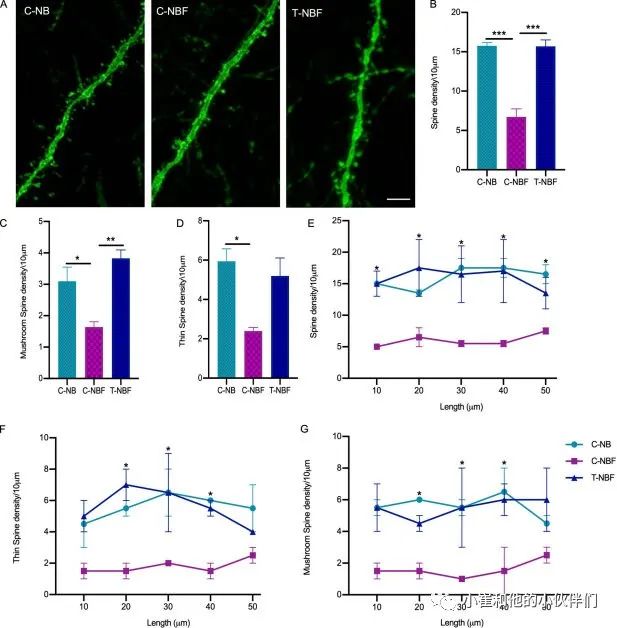
图4 神经再生增强后FAD小鼠突触密度的恢复
神经发生的增强恢复了 FAD 中参与engram的成熟颗粒神经元的突触棘密度
鉴于增强的神经发生对参与engram的未成熟神经元的棘突密度的影响,作者想知道这一过程是否影响在engram中起作用的DG中成熟颗粒神经元的棘突密度。为了检验这一点,作者量化了C-NB、C-NBF和T-NBF小鼠大脑切片中颗粒细胞层中Neun+EYFP+Egr-1+的树突棘的密度和形态(图5 A)。棘突密度的定量显示,C-NBF组DG中Neun+EYFP+Egr-1+神经元的棘突密度比C-NB鼠低(图5 B)。观察到T-NBF小鼠DG中Neun+EYFP+Egr-1+神经元的脊椎密度与C-NB小鼠相当(图5 B)。这一结果表明,增强神经发生可以非自主地恢复DG内成熟神经元的突触可塑性。为了检验特定形式的树状棘突是否在engram中被调节,作者量化了蘑菇样棘突、粗棘突和细棘突的密度。数据显示,在C-NBF小鼠中,Neun+EYFP+Egr-1+神经元的蘑菇棘密度明显不足(图5 C)。T-NBF小鼠的蘑菇棘突密度恢复(图5C)。粗棘突和细棘突的密度显示出类似的趋势,尽管在统计学上没有显著意义(图5,D和E),与C-NBF和T-NBF相比,检查与细胞体距离的函数的棘突密度发现,C-NBF组小鼠神经元的总脊椎密度一致受损,与C-NB和T-NBF组相比,与距离细胞体的距离无关(图5 F)。与C-NB和T-NBF相比,C-NBF中蘑菇棘突密度的缺陷在距离细胞体>10μm处更为明显(图5 G)。对三组小鼠颗粒神经元中棘突类型比率的检测表明,C-NB和T-NBF小鼠颗粒神经元中的大部分棘突是蘑菇状的(∼40%),而C-NBF组的大部分是细棘突(图5 H)。接下来,作者比较了T-NBF中神经再生增强后未成熟神经元和成熟神经元的棘突密度的变化。数据显示,尽管与C-NBF相比,T-NBF小鼠未成熟和成熟神经元的棘突密度都有所增加,但未成熟神经元的整体棘突密度高于成熟神经元(图5 I)。虽然与C-NBF相比,T-NBF中成熟和未成熟神经元中的所有三种棘突类型都增加了(图5,J-L),但与C-NBF相比,T-NBF小鼠中未成熟神经元中短棘突的密度显著增加,但成熟神经元中的短棘突密度并未增加(图5 L)。综上所述,这些结果表明,增强FAD中的神经发生可以恢复DG中成熟颗粒神经元的棘突密度缺陷。
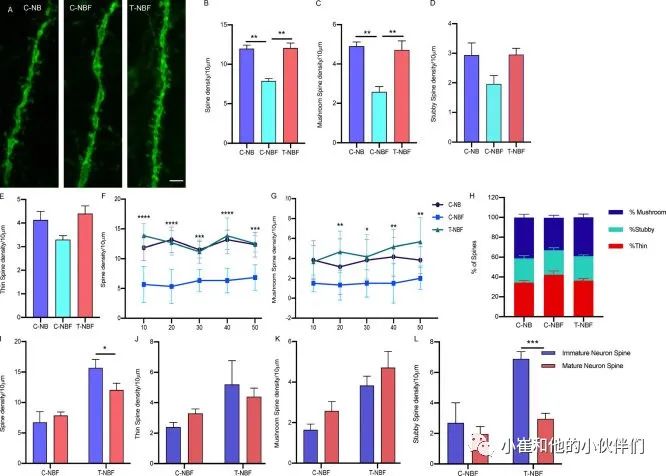
图5 神经发生的增强调节参与DG中engram的成熟颗粒神经元的突触可塑性
未成熟的神经元是形成正常记忆所必需的
为了解决这个问题,T-NBF小鼠被注射了逆转录病毒载体,表达由设计药物(DREADD)RV-hM4Di-EGFP独占激活的GI设计者受体,以在CFC之前4周特异性灭活新成熟的神经元(图6 A)。为验证RV-hM4Di-EGFP对感染细胞的灭活作用,用氯氮平N-氧化物(CNO)对注射RV-hM4Di-EGFP的小鼠进行处理,并检测其脑组织中EGFP和内源性c-fos的表达。作者观察到EGFP和内源性c-fos的表达没有重叠,证实RV-hM4Di-EGFP可以灭活感染的细胞(图6,B-E)。为了进一步验证DREADD在几种小鼠中的特异性,作者在未注射Gi恐惧受体的小鼠中检测了促动器治疗的假定副作用。作者观察到它们的冻结水平(图S3、D和E)或促动器或注射部位的影响(图S3、F-I)没有变化。接下来作者研究了灭活未成熟神经元对T-NBF小鼠CFC中记忆形成的影响。为此,T-NBF小鼠在CFC4wk前4周立体定向注射RV-hM4Di-EGFP或对照病毒(RV-EGFP)。在行为测试前5天,用促动器或水处理小鼠(图6 A)。用促动器治疗RV-hM4Di-EGFP注射的T-NBF小鼠显著降低了这些小鼠的记忆 (图6 F)。并且,在RV-hM4Di-EGFP注射的野生型小鼠、C-NB或T-NB小鼠的CFC过程中抑制新神经元的活动不会影响小鼠的表现(图6,G-I)。野生型和C-NB小鼠的结果支持了之前在胸苷激酶表达的小鼠中的观察结果,即新神经元的缺失不会影响CFCs的表现。在T-NB小鼠中缺乏效应与C-NB和T-NB小鼠在CFC任务中表现出相似的表现相一致,并表明T-NB小鼠中额外的未成熟神经元对功能性CFC engram不是必不可少的,这支持了作者关于这些小鼠存在天花板效应的假设。这些结果表明,T-NBF小鼠的正常记忆形成需要更多的未成熟神经元,而它们在C-NBF中的缺乏是记忆损伤的基础。在T-NBF小鼠中,增加它们的数量可以挽救记忆,反过来,它们的失活扰乱了engram和记忆的形成。总而言之,增加FAD小鼠的神经发生增加了新神经元的可用性,将其整合到情景engram细胞中,导致正确的engram形成和在记忆任务中的完整表现。此外,未成熟的神经元在记忆检索过程中被有利地重新激活,是拯救FAD中engram的必要条件。值得注意的是,作者表明除了未成熟的神经元外,增强神经发生会影响参与记忆engram的成熟颗粒神经元的突触可塑性。

图6 FAD 中 CFC 记忆的形成需要新的神经元参与
增强FAD的神经发生导致了类似于野生型的engram转录特征
到目前为止的结果表明,神经发生的增强调节了FAD(T-NBF)小鼠的海马功能。因此,作者试图研究与野生型小鼠相比,FAD中engram的信号通路,以及它们在神经发生增强后的改变。此外,作者还研究了神经发生的增强是否会影响DG中颗粒细胞的概况。因此,作者研究了在C-NB、C-NBF和T-NBF小鼠的DG中招募到的未成熟和成熟神经元的转录特征。为此,C-NB、C-NBF和T-NBF小鼠被注射了engram混合物,被置于多西环素饮食中,并接受CFC,如前所述。在CFC的测试阶段45分钟后,杀鼠取脑,脑组织冷冻。通过空间转录组学对冠状切片进行分析(图7 A)。使用原位测序法对159个感兴趣的基因同时进行了单细胞分辨率的测序(图7,A-E)。为了将读数分配给单个细胞,使用定制的MatLab脚本(图7,F-L)对DAPI细胞核染色的大脑切片的图像进行细胞分割。对细胞数量的量化表明,三组脑切片中的平均总细胞计数是相似的。而DG中的细胞总数显示C-NB组为6460±235个细胞±SE,C-NBF组为4619±325个,T-NBF组为6450±313个。这可能表明,DG中的细胞数量取决于这些小鼠的神经再生水平。为了确定DG中的engram,作者检测了DG中统一追踪的区域中EYFP的表达,该区域包括DG的门部、颗粒下和颗粒层。如果单元格包含至少一个EYFP读取,则将其定义为EYFP+。Fisher‘s Exact检验(FET)用于比较每种细胞类型的成对分组中表达每种基因的细胞的比例。图7 M显示了三个实验组的DG中表达模式的t分布的随机邻居嵌入(t-SNE)图。
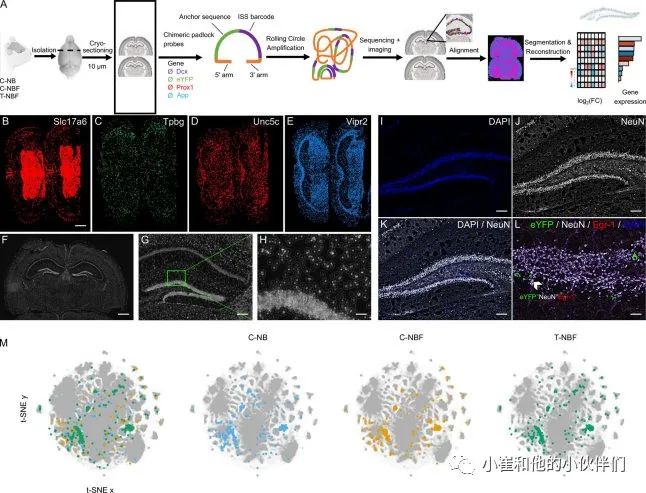
图7 未成熟和成熟engram的原位测序
为了深入了解engram神经元的分子图谱,作者将EYFP+神经元的图谱与C-NB组中的EYFP−神经元的图谱进行了比较。与EYFP−相比,在EYFP+神经元中,一系列对神经元功能至关重要的基因,如SYN1、NDNF、NCAM1、NPY2R、SLC6A5、OPRK1、MAPK3和Gabra1表达上调(图8 A)。有趣的是,几个与AD相关的基因,如App,ADAM10和PSEN1等也受到了调控(图8 A)。一些基因如App、Fos、Npas4、Npy2r、Oprk1、Sst、Gul、Syn1、Slc17a8、ApoE。Mapk3, Adam10, Pvalb, and Gad2, 在C-NB小鼠的eYFP+成熟神经元中比eYFP-成熟神经元上调(图8 B)。在eYFP+的新神经元中,与eYFP-的新神经元相比,Neurod6、Src6a1、Src6a5、Src17a8、Ncam1和Grin2b等基因被上调(图8 C)。有趣的是,C-NBF小鼠eYFP+神经元的转录谱与C-NB的相反(图8 A)。在大多数情况下,在C-NBF的engram中,那些在C-NB印迹中大幅上调的基因的表达没有大的变化,而另外一组在C-NB中没有大幅调控的基因,如Fev、Wfs1、Map2、Vipr2、Ptprc、Arc、Egr-1,在C-NBF印迹中被上调(图8 A)。值得注意的是,T-NBF中engram的分布情况部分反映了C-NB的情况(图8 A)。对不同组别中成熟和新的神经元概况的检查显示了类似的趋势(图8,B、C)。与C-NBF中的eYFP-成熟神经元相比,eYFP+成熟神经元的特征在很大程度上与C-NB小鼠的特征相反;T-NBF组的表达情况与其他各组部分相似(图8 B)。与eYFP+成熟神经元的表达情况相似,C-NBF中eYFP+新神经元的表达情况与C-NB中相反(图8 C)。有趣的是,T-NBF中eYFP+新神经元的基因表达与C-NB组中这些细胞的情况相似(图8,C和D)。调节神经元功能的基因,如Ncam1,在C-NB和T-NBF小鼠的(eYFP+/eYFP-)新神经元中的P值最低(图8 E)。综上所述,与其他同伴相比,被招募到engram神经元具有独特的基因表达谱。在FAD小鼠中,这一特征差异很大,并且在神经发生增强后部分恢复。神经发生增强后,在新神经元和总神经元中engram神经元图谱的恢复尤为明显。
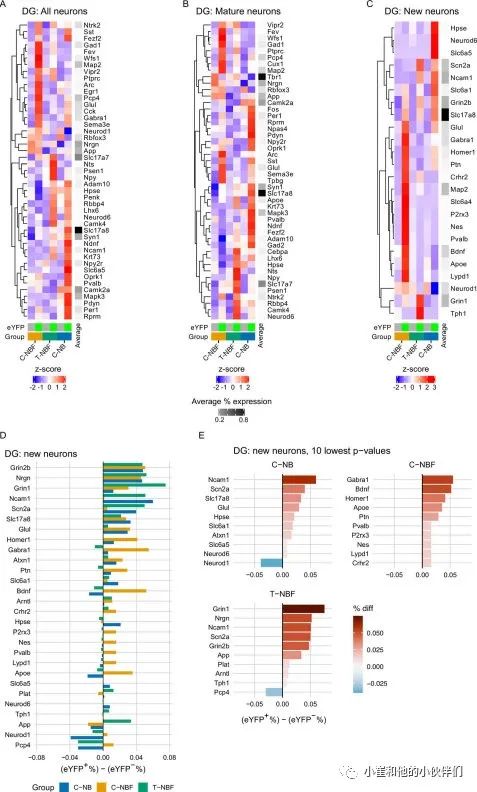
图8 FAD 中改变的记忆engram图谱在神经发生增强后得以恢复
与AD相关的信号调节engram
接下来,作者比较了三个实验组之间的engram图谱,而不考虑DG中未被招募到engram图谱中的其余神经元的图谱。对DG和门内EYFP+神经元分布的研究表明,与C-NB和T-NBF相比,C-NBF内EYFP+神经元的分布减少(图9,A-C)。C-NB中EYFP+神经元与C-NBF相比的差异基因表达(图9,D和G)表明,相对于C-NBF,Mapk3和ADAM10是C-NB中上调最多的基因;相对于C-NBF,C-NB下调幅度最大的是Wfs1和Nefh(图9,D和G)。与C-NBF相比,Camk2a、App、GLUL、Wfs1、Arc和Lmo1在T-NBF中下调最多(图9,E和H)。相对于C-NB,T-NBF上调最多的是Grin1和Syt6,而Camk2a、Mapk3、Rprm、PER1和Pvalb下调最多(图9,F和I)。总DG中的分数表达显示了实验组的随机顺序(图9J和图5C)。并且EYFP+细胞的部分表达显示T-NBF组和C-NB组之间的表达模式接近,而C-NBF组显示出不同的表达模式(图9K和图5C)。所有159个基因都列在图9的L-N中,并分别按C-NB/C-NBF(图9 L)、T-NBF/C-NBF(图9M)和T-NBF/C-NB(图9 N)比较的log2FC进行排序。接下来,作者试图研究神经发生的增强是否影响了DG中兴奋性神经元与抑制性神经元的比率。为此,作者量化了成熟和未成熟神经元的数量,这些神经元表达已知的调节抑制或兴奋活动的基因。作者观察到三个实验组的抑制性和兴奋性的比率是相似的。接下来,作者研究了未成熟神经元和成熟神经元在这些亚群中的分布,以及这些神经元是否在engram(EYFP+)中发挥了作用。数据显示,增强神经发生对兴奋性未成熟和成熟神经元的作用最大。此外,与C-NBF相比,T-BN和C-BN中抑制性eYFP-成熟神经元的数量较高。然而所有被定义为抑制性的神经元都至少表达了一个兴奋性的指标。因此,进一步的实验将需要验证这些神经元的功能。

图9 FAD 和神经发生增强后engram转录谱
为了深入了解新生神经元与成熟神经元在engram图谱中的分布,作者首先基于它们的空间转录检查了它们的分布,并观察到与C-NB和T-NBF组相比,C-NBF组未成熟神经元和成熟神经元的分布都减少了(图10,A-C)。接下来,作者检查了每种EYFP+神经元类型中表达最低P<0.05基因的细胞的平均数量(图10,D-L)。在具有P<0.05的基因中,在EYFP+神经元和EYFP+成熟神经元的C-Nb/CNBF比较中,ADAM10、Mapk3、Gad1、2和n d Slc17a8的调控作用最强(图10,D和E)。在EYFP+的未成熟神经元中,APOE、BDNF、Camk2a、Nefh和n d NeuroD1的表达最强(图10)。有趣的是,在T-NBF/C-NBF条件下,在EYFP+总神经元和成熟神经元中,ADAM10和App、Camk2a、GLUL、a d Lmo1的表达最强(图10,G和H),而在新神经元中,APOE、BDNF、Gabra1、Hmer 1和 MAPT的表达最强(图10 I)。在T-NBF/C-NB条件下,Camk2a和Mapk3在成熟和未成熟神经元中调节最多(图10,J-L)。比较C-NB/C-NBF和T-NBF/C-NBF engram中差异表达基因的方向性显示出相似的方向性(图10,M-O)。重要的是,在C-NB/C-NBF和T-NBF/C-NBF比较中P值最低的20个基因中,在C-NB/C-NBF和T-NBF/C-NB比较中,eYFP+神经元、eYFP+成熟神经元和eYFP+新生神经元有一个统计学上的显著比例,具有相同的折叠变化方向,而不是仅仅由于随机机会而预期(图10 P)。这些结果表明,与野生型(C-NB)相比,增强神经发生促进了类似的基因。

图10 增强神经发生后 FAD DG 中新的和成熟的engram转录谱的改变
小 结
这项研究提供了几个新的观察结果。首先是直接证据表明,DG中的未成熟神经元在野生型和FAD小鼠的海马区依赖engram中发挥了作用。其次,海马神经发生的障碍导致FAD的engram形成缺陷,并导致记忆障碍。第三,越来越多的神经发生通过恢复记忆engram来挽救记忆。第四,在FAD中,未成熟神经元是形成正常记忆所必需的。第五,增强神经发生挽救了FAD小鼠DG中未成熟和成熟的engram的棘突密度缺陷。第六,增强神经发生可以调节DG中未成熟和成熟的engram的特征,使其与野生型小鼠的engram的转录特征相似。第七,AD相关信号,特别是App、APOE和ADAM10,在engram中发挥作用,并在神经发生增强和记忆恢复后受到调节。最重要的是,此结果表明,神经发生的增强可以调节FAD中DG中engram的转录谱,使其与野生型小鼠DG中的一个engram相似。这表明,增强神经发生可通过影响DG中印迹的分子谱来挽救FAD中的记忆缺陷。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言