【综述】| 共培养策略在类器官研究中的应用进展
2023-09-11 中国癌症杂志 中国癌症杂志 发表于上海
本文阐述共培养策略在类器官生成中的作用,并重点介绍不同细胞成分及微生物组与类器官共培养的应用,以期为构建开发具有更高体内模拟程度的类器官提供参考和帮助。
[摘要] 类器官作为一种良好的体外研究模型,在生物医学领域中的应用越来越广泛。通过采用各种组织培养技术开发自组装的3D结构,类器官可重现器官固有结构中细胞的高度复杂性,因此被广泛用于研究调节机体发育和疾病的机制、高通量药物筛选及个性化治疗等。为更好地重现微环境内细胞间的相互作用,共培养策略已经扩展到更多的细胞类型,共培养策略的迅速发展使类器官技术的应用前景更加广阔,并为治疗人类疾病和再生医学开辟了新的道路。本文阐述共培养策略在类器官生成中的作用,并重点介绍不同细胞成分及微生物组与类器官共培养的应用,以期为构建开发具有更高体内模拟程度的类器官提供参考和帮助。
[关键词] 共培养;类器官;疾病建模;细胞间相互作用;微环境
[Abstract] As a good in vitro research model, organoids are more and more widely used in the biomedical field. By developing self-assembled 3D structures using various tissue culture techniques, organoids can rebuild the high complexity of cells in the inherent structure of the organ, and are therefore unanimously used to study mechanisms regulating body development and disease, high-throughput drug screening, and personalized treatment and so on. To better recapitulate cell-to-cell interactions within the microenvironment, co-culture strategies have been extended to more cell types, and their rapid development offers broader prospects for organoids and paves the way for the treatment of human diseases and regenerative medicine. This review discussed the role of co-culture strategies in organoid generation, and focused on the application of various cellular components and microorganisms in organoid construction, thereby providing reference and help for scholars to construct and develop organoids with a higher degree of in vivo simulation.
[Key words] Co-culture; Organoid; Disease modeling; Cell-to-cell interactions; Microenvironment
类器官是由成体组织或多功能干细胞[包括组织常驻成体干细胞(adult stem cell,ASC)、胚胎干细胞(embryonic stem cell,ESC)或诱导多能干细胞(induced pluripotent stem cell,iPSC)][1]通过体外自组织方式形成的3D培养物,与相应的器官拥有类似的空间组织结构并能够重现相应器官的部分功能,可较好地概括来源组织的特征和细胞异质性[2]。因其更具有仿生性的特点,被广泛用于研究调节机体发育和疾病的机制、高通量药物筛选及个性化治疗[3]等方面。
人体器官均是各种细胞类型的集合体,不同细胞与周围微环境之间存在多向相互作用,参与组织形成、维持稳态和功能稳定[4]。类器官模型的开发是为了克服体内研究的限制,但微环境中相关细胞成分的缺乏使其不能完全重现各种器官的整体结构和功能。鉴于重建微环境对于研究正常组织功能和疾病进展的重要性,建立生理相关模型时迫切需要一种合适的共培养体系[5]。研究者利用共培养策略优化类器官共培养条件,包括添加各种细胞类型和细胞外基质(extracellular matrix,ECM),提供适当的生态位,增强类器官凝聚,并改善类器官的血管化和成熟(图1)。目前,体外类器官培养体系中的细胞类型相对缺乏,特别是免疫细胞,同时还缺乏一些重要的生理过程,包括血管化和神经支配,但细胞微阵列、蛋白质微图案化、微流体、器官芯片、生物材料支架和生物打印等多种工程工具的开发[6]可更精确地控制细胞微环境,极大地促进类器官模型的应用。
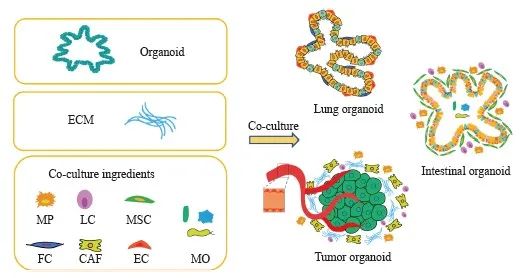
图1 类器官多细胞共培养示意图
Fig. 1 Schematic diagram of organoid multi-cell co-culture
MP: Macrophages; LC: Lymphocytes; MSC: Mesenchymal cell; FC: Fibroblasts; CAF: Cancer-associated fibroblast; EC: Endothelial cells; MO: microorganism
1 免疫细胞与类器官共培养的应用
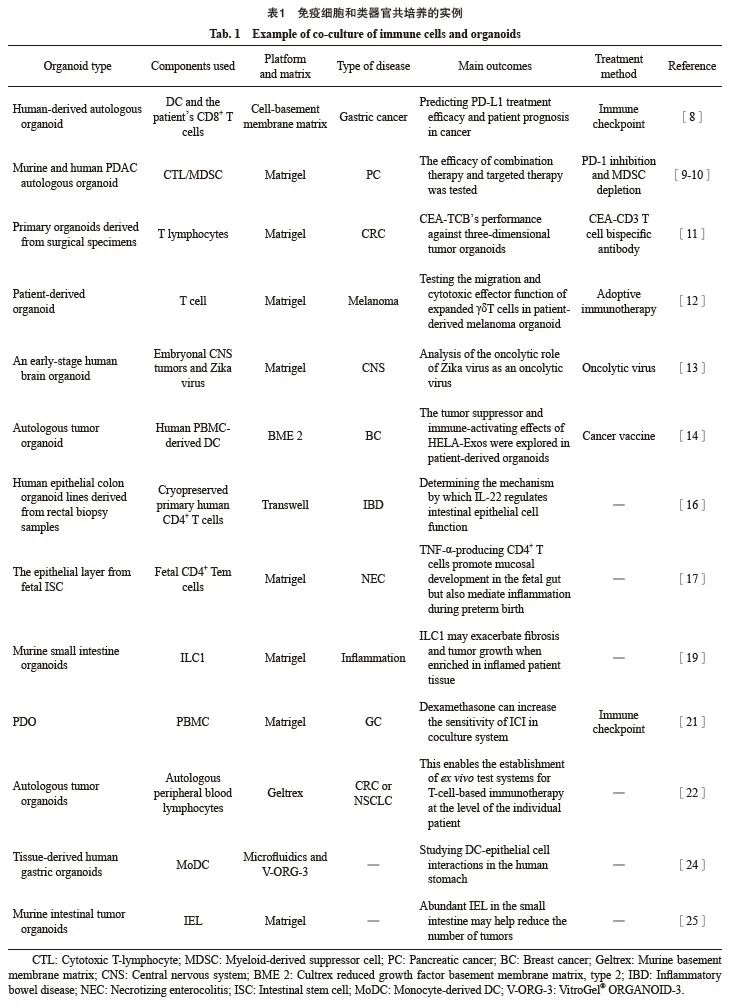
微环境中包含巨噬细胞、中性粒细胞、自然杀伤细胞和树突状细胞(dendritic cell,DC)等固有免疫细胞,以及适应性免疫细胞、T淋巴细胞和B淋巴细胞。将类器官与免疫细胞共培养可以重建体内微环境,此种共培养系统的应用目前十分广泛,详见表1。
1.1 评价癌症免疫治疗效果
各种免疫治疗手段有望从根本上改变癌症患者的治疗方式。抗程序性死亡[蛋白]-1 (programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)是阻断T细胞抑制性检查点受体中最有效的免疫疗法,然而其在大多数癌症类型中的应答率也仅为15%~25%[7]。因此,建立可靠的体外模型来检测疗效及优化治疗方法十分必要。Chakrabarti等[8]使用人源性自体胃癌类器官与患者的免疫细胞共培养作为临床前研究模型,预测PD-L1靶向治疗的有效性,以期达到提高疗效的目的。此外,类器官与免疫细胞共培养也可检测免疫检查点抑制剂(immune checkpoint inhibitor,ICI)与其他疗法联合的效果,有研究[9-10]通过小鼠及人胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)自体类器官与免疫细胞共培养,发现利用卡博替尼去除多形核髓源抑制性细胞可优化抗PD-1/PD-L1的疗效。
除ICI治疗外,类器官也广泛应用于检测其他免疫治疗的效果,包括靶向抗体、过继细胞疗法、溶瘤病毒和癌症疫苗等。Teijeira等[11]将来自结直肠癌(colorectal cancer,CRC)手术标本的表达不同水平癌胚抗原(carcinoembryonic antigen,CEA)的原发类器官与T淋巴细胞共培养,发现CEA-CD3 T细胞双特异性抗体赛必妥单抗不会介导低于某个CEA表达阈值的人类预活化T细胞的杀伤。Ou等[12]利用患者来源的黑色素瘤类器官与扩增的γδT细胞共培养,测试扩增的γδT细胞迁移和细胞毒性效应功能,以期增强过继免疫治疗的效果。Ferreira等[13]设计了一种早期人脑类器官与胚胎性中枢神经系统肿瘤共培养的体外模型,以分析寨卡病毒作为溶瘤病毒的溶瘤作用,细胞因子和趋化因子的基因表达,证明治疗后免疫细胞募集和肿瘤炎症增强。Huang等[14]在乳腺癌患者外周血单核细胞(peripheral blood mononuclear cell,PBMC)-自体肿瘤类器官共培养系统中评估原位DC疫苗(HELA-Exos)的靶向、杀伤和免疫激活效应,发现HELA-Exos通过促进原位癌细胞激活的1型常规DC的活化,改善肿瘤反应性CD8+ T淋巴细胞反应。
1.2 研究炎症机制
类器官模型可以与常驻或循环免疫细胞共培养,以阐明其在炎症发生、发展中的作用。有研究[15]报道,在3D培养系统中利用器官型气液界面培养方法,将免疫细胞群与食管上皮细胞共培养来建立食管炎模型,在氧化应激条件下诱导反应性增殖反应并增强DNA损伤。
炎症性肠病起始和持续存在的关键因素是上皮屏障的完整性。Patnaude等[16]利用类器官与免疫细胞的共培养,探索白细胞介素-22 (interleukin-22,IL-22)调节肠上皮细胞功能的机制,证实IL-22炎症环境可促进上皮再生、先天防御和膜黏液产生。此外,有研究[17]构建了肠干细胞衍生的类器官和胎儿CD4+效应记忆性T细胞共培养系统,发现产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的CD4+ T细胞群体能促进胎儿肠道的黏膜发育,但也会在早产时介导炎症发生。
炎症是癌症发生、发展的主要驱动因素[18]。为利用类器官共培养探讨炎症相关的癌症发生机制,Jowett等[19]开发了与1型先天淋巴细胞(innate lymphoid cells 1,ILC1)共培养的肠道类器官,发现在该类器官中小鼠及人ILC1分泌转化生长因子β1会驱动CD44v6+上皮隐窝的扩张,提示当其在发炎的患者组织中富集时可能会加剧纤维化和肿瘤生长。
1.3 药物筛选及个性化治疗
与传统模型相比,类器官在筛选针对癌症的临床前免疫治疗药物方面显示出巨大潜力[20]。Xiang等[21]对多种免疫相关分子和潜在的靶向治疗进行了跨数据库分析,确定了25种可能在调节肿瘤免疫逃逸中发挥关键作用的潜在化合物,并利用患者来源的类器官(patient-derived organoids,PDO)与PBMC共培养系统,发现地塞米松通过同时降低PD-L1和吲哚胺2,3-双加氧酶1这两个免疫检查点的活性来抑制T细胞衰竭,表明地塞米松是增加ICI敏感性的潜在方案。
类器官能够复制免疫过程并重现亲代肿瘤的关键特征,有助于确定免疫机制,允许为患者个体化定制最合适的药物并预测对候选治疗药物的临床反应。Cattaneo等[22]建立肿瘤类器官和自体外周血淋巴细胞共培养系统来研究肿瘤反应性T细胞的产生和功能评估,该共培养系统中的肿瘤反应性T细胞首先在[γ干扰素(interferon-γ,IFN-γ)刺激的]自体肿瘤细胞存在下扩增。这一策略可从33%~50%的非小细胞肺癌(non-small cell lung cancer,NSCLC)和微卫星不稳定CRC患者样本中获得肿瘤反应性CD8+ T细胞群,从而在个体患者的水平上建立基于T细胞的免疫治疗的体外测试系统。此外,建立类器官生物库有利于药物开发和患者个性化精准治疗。
1.4 研究上皮-免疫细胞相互作用
免疫化合物可以影响上皮细胞分化,上皮细胞会影响免疫细胞的表型。类器官与免疫细胞的共培养系统有助于研究上皮细胞与免疫细胞的相互作用。无论是来源于iPSC还是ASC的上皮类器官培养均可为多种应用的免疫学研究提供一个有希望的平台[23]。
近年来,已建立了许多研究上皮细胞及其与免疫系统相互作用的模型系统。Cherne等[24]利用基于多糖的合成水凝胶VitroGel®ORGANOID-3优化肠道类器官流动芯片的微流体装置,将免疫细胞成功整合到胃类器官组织芯片中,扩展其生理相关性和适用性。该共培养模型可以探索人胃中DC与上皮细胞的相互作用,拓宽对单核吞噬细胞的免疫监测及其在胃部疾病中作用的研究。Morikawa等[25]将野生型上皮内淋巴细胞(intraepithelial lymphocyte,IEL)扩增并与多发性肠道肿瘤小鼠的肠道肿瘤类器官共培养,利用活体成像系统可视化了肠道肿瘤微环境(tumor microenvironment,TME)中IEL的动态变化,IEL与上皮细胞之间的相互作用,以及细胞间接触在肠道抗肿瘤免疫中的作用,证明增加结肠中IEL的数量或加强IEL与上皮细胞之间的细胞间接触的策略可能对预防高癌症风险患者的肠道肿瘤有效。
2 成纤维细胞与类器官共培养的应用
成纤维细胞是异质细胞,包含功能不同的群体,其表型根据其起源组织和诱发疾病的类型而有所不同[26]。在正常组织中,成纤维细胞在损伤过程中被激活,产生用于组织重建的各种成分,而肿瘤细胞可通过信号转导影响正常成纤维细胞的功能,导致癌症相关成纤维细胞(cancer-associated fibroblast,CAF)的形成[27]。目前,类器官与成纤维细胞共培养系统也得到了广泛应用,详见表2。
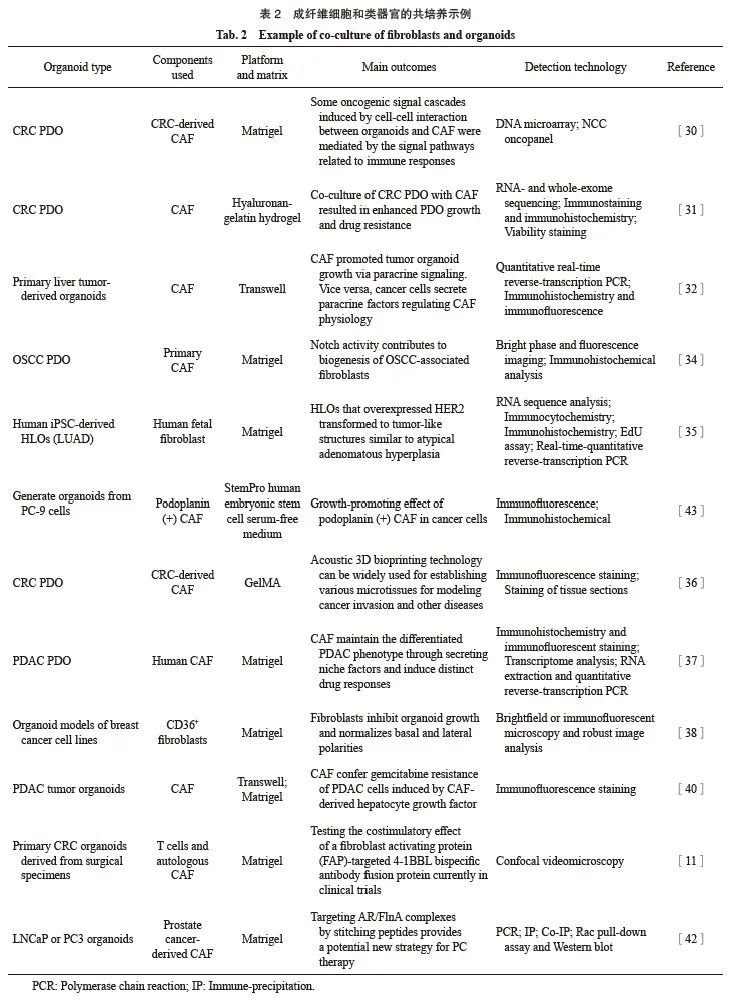
2.1 探索肿瘤-CAF串扰机制
在TME中,CAF和癌细胞通过ECM和可溶性因子以双向串扰的方式相互通信。CAF分泌大量的交联酶以上调基质硬度,从而增强肿瘤细胞和基质细胞中基于整联蛋白的机械传递[28]。癌细胞中的整联蛋白对CAF影响的ECM变化作出反应,将ECM的信号转导到细胞中,从而影响肿瘤细胞增殖、迁移和存活[29]。
类器官与癌症相关基质细胞共培养为研究TME中的细胞串扰提供有利平台,如添加CAF的CRC PDO能够改善CAF串扰相关通路的重现性。Naruse等[30]从CRC外科标本中建立了类器官和CAF共培养系统,评估共培养后基因表达谱改变和肿瘤组织中肿瘤细胞和CAF之间的相互作用,同时发现CAF可以诱导CRC类器官中的沉默基因表达。Luo等[31]开发了一种透明质酸-明胶水凝胶共培养策略,以维持CRC PDO和CAF的生存能力且该模型重现了CAF介导的CRC与基质间的串扰。Liu等[32]在体外建立小鼠和人原发性肝癌来源的类器官与CAF的3D共培养模型,发现CAF通过旁分泌信号促进肿瘤类器官的生长,同时癌细胞分泌调节CAF生理的旁分泌因子。
在实体肿瘤中,物理接触诱导的信号被认为是至关重要的细胞串扰[33]。然而,直到最近才发现成纤维细胞激活的特定接触依赖机制,如Notch活性,基于成纤维细胞附着的类器官模型,证实Notch活性有助于口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)相关成纤维细胞的生物发生[34]。更重要的是,使用Notch抑制剂处理会降低OSCC类器官中的CAF/癌旁成纤维细胞的形态激活。
2.2 研究肿瘤的发生、发展及抑制
CAF主要通过分泌促血管生成和肌成纤维细胞信号,促进免疫抑制、炎症和富氧微环境,从而推动肿瘤发生。因此,类器官与成纤维细胞共培养可以重现肿瘤的发展过程,有助于开发肿瘤的治疗新策略。Miura等[35]在使用CRISPR/Cas9基因组编辑技术处理人iPSC后,将其与人胎儿成纤维细胞共培养,形成人肺类器官,其可作为模型来重现肺腺癌的早期肿瘤发生,并将为肿瘤发生的分子基础提供新见解。
CAF通过重塑ECM和释放大量ECM蛋白和可溶性因子参与癌症的发展和转移。Chen等[36]使用声学生物打印技术将来自同一患者的肿瘤类器官和CRC患者的CAF共培养,可观察到癌细胞从肿瘤类器官到3D CAF微组织的迁移和侵袭。Shinkawa等[37]建立了一个PDAC类器官与CAF的共培养模型,发现CAF通过分泌生态位因子维持分化的PDAC表型,并诱导不同的药物反应,这可能推动基于亚型的治疗新方法的发展。
CAF即可发挥肿瘤支持作用,也可发挥肿瘤抑制作用。CAF可以募集调节性T细胞进入肿瘤,Cheng等[38]首次证实,将CD36+成纤维细胞与MDA-MB-231或MCF7乳腺癌细胞系的类器官共培养,CD36的过表达可以抑制乳腺癌细胞系的集落生长。
2.3 研究药物的耐药机制
CAF通过分泌一些功能因子从而诱导肿瘤的化疗耐药,如生长因子、细胞因子、趋化因子和microRNA等[39]。在CAF存在的情况下,小鼠和人肝肿瘤类器官对临床使用的抗癌药物产生耐药性。为确认这些效应是否与旁分泌信号有关, Liu等[32]将小鼠和人的类器官暴露于CAF条件培养基中,并用索拉非尼、雷戈拉非尼或5-氟尿嘧啶处理,发现存在CAF条件培养基的类器官对治疗更具有抵抗力。Feldmann等[40]通过肿瘤类器官和CAF共培养,发现CAF塑造了上皮-间充质表型,PDAC细胞对吉西他滨的耐药性是由CAF衍生的肝细胞生长因子诱导的。
2.4 寻找CAF相关靶点
近年来,CAF已成为多种癌症模型中极具潜力的诊断和治疗靶点。与肿瘤细胞相比,CAF基因更稳定,获得治疗耐药性的可能性更小。有研究[27,41]报道,CAF靶向治疗剂可以通过靶向CAF衍生因子发挥作用,或通过转化生长因子-β (transforming growth factor-β,TGF-β)阻断逆转其活化表型,或直接靶向CAF亚群,如成纤维细胞活化蛋白(fibroblast activation protein,FAP)。
Teijeira等[11]通过肿瘤类器官、T细胞与自体CAF共培养,测试临床试验中FAP靶向的4-1BBL双特异性抗体融合蛋白的共刺激效应。前列腺CAF表达一种转录不全的雄激素受体(androgen receptor,AR),在LNCaP或PC3类器官和来自前列腺癌(prostate cancer,PC)患者的CAF共培养中,AR衍生的缝合肽破坏AR/细丝蛋白A(filamin A,FlnA)复合物组装,消除CAF的雄激素依赖性迁移和侵袭性。通过缝合肽靶向AR/FlnA复合物为PC治疗提供了一种潜在的新策略[42]。
3 其他细胞组分与类器官共培养的应用
3.1 类器官与间充质细胞(mesenchymal cell,MSC)共培养
MSC一般是指具有自我更新和多向分化能力的间充质干细胞。在上皮类器官中加入MSC共培养,可研究其在类器官形成和组织再生中的相互作用。Jorgensen等[44]利用小鼠唾液腺导管上皮细胞和原代E16唾液MSC共培养,在预制藻酸盐水凝胶微管的生物相容性平台上检测来自上皮-间充质相互作用的自组织。Yang等[45]将小鼠或患者衍生的类器官与iPSC-MSC共培养,发现iPSC-MSC以蛋白激酶B(protein kinase B,AKT)依赖性方式通过TNF-α刺激基因6促进上皮细胞增殖来加速结肠炎模型中的黏膜愈合。Moussa等[46]通过Ki-67免疫染色研究MSC共培养对自组织类器官中结肠上皮细胞增殖的影响,发现骨形态发生蛋白拮抗剂Grem-1、Twsg-1参与MSC诱导类器官形成的过程。Cordero-Espinoza等[47]利用基于微流体的类器官共培养,重现门静脉导管MSC的结构,证明小鼠门静脉周围MSC亚群以细胞接触依赖的方式对上皮细胞增殖具有双重控制作用。
类器官可以通过共培养技术来研究体内上皮-间充质转化(epithelial-mesenchymal transition,EMT)。Tanaka等[48]使用胰腺癌细胞系S2-013细胞、人EC和人MSC共培养产生人胰腺癌类器官,建立皮下移植人胰腺癌类器官的小鼠模型,通过H-E染色观察到EMT。
3.2 类器官与内皮细胞(endothelial cell,EC)共培养
类器官与EC共培养有助于类器官的血管化,可复制实体器官近乎自然的功能,并为基础研究和生物医学研究创造高度相似的内部环境。有研究[49]发现,当转录因子Ets变体2(Ets variant 2,Etv2)原型胎儿衍生的人脐静脉EC与CRC类器官组织共培养时,血管密度和血管间距的均匀性增加,验证Etv2上调具有形成稳定血管床的作用。Palikuqi等[50]发现EC“重置”为适应性强的血管生成细胞后,直接与3D共培养类器官内的细胞相互作用,从而可以破译器官型EC与实质细胞之间的串扰和确定EC异质性的决定因素。
血管化的脑类器官为建立神经血管疾病模型提供了一个高效平台。为实现类器官血管化的时间同步和空间定向,Salmon等[51]采用定制的3D打印微流控芯片,将人多能干细胞(human pluripotent stem cells,hPSC)来源的周细胞和EC萌发并自组装成有组织的血管网络,其在芯片上与脑类器官发生物理作用,形成完整的神经血管类器官。另外Ahn等[52]将从血管类器官中分离的细胞与脑类器官共培养,发现血管细胞穿透脑类器官形成神经特异性血管网络,说明其组织特异性和适应性良好。
4 微生物与类器官共培养的应用
4.1 研究宿主-微生物的相互作用
类器官与细菌共培养为研究复杂的宿主-细菌相互作用提供了有效方法。Pradhan等[53]向人肠道类器官组织中微量注射Nissle以评估其安全性,发现其可能是通过激活人体防御来避免致病性大肠杆菌的侵害。有研究[55]通过向类器官腔内注射细菌研究宿主微生物动力学,发现原发性硬化性胆管炎衍生的肺炎克雷伯菌的上皮损伤作用与细菌移位和对辅助性T细胞17介导的肝胆损伤的易感性有关。
除细菌之外,类器官与病毒共培养疾病模型也得到广泛应用。Natarajan等[56]利用微流控芯片开发了CD8+ T细胞和ASC衍生的肝类器官系统,证明共培养系统可应用于检测对丙型肝炎病毒的适应性免疫反应。另有研究[57-58]发现,严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome corona virus 2,SARS-CoV-2)感染的hPSC衍生的肺类器官和结肠类器官可作为疾病模型来研究病毒的感染途径和感染细胞的免疫反应,有望为药物筛选和识别候选新型冠状病毒肺炎疗法提供新的思路。通过气液界面培养技术,iPSC衍生的人肺上皮类器官可模拟SARS-CoV-2对肺泡上皮的初始顶端感染[59]。
4.2 研究驱动肿瘤进展的因素及机制
类器官与细菌等微生物共培养可用于研究驱动肿瘤进展的因素及机制,如幽门螺杆菌与胃癌[60],以及大肠杆菌与结肠癌[54]。Holokai等[61]开发了一种被幽门螺杆菌感染并经PD-L1抑制剂治疗的患者源性类器官和自体免疫细胞共培养系统,研究PD-L1对细菌感染的保护机制,证实表达PD-L1的细胞感染幽门螺杆菌后可能会受到免疫反应的保护,从而导致癌前病变发展为胃癌。此外,有研究者利用鼠胃中分离出来的胃类器官与细菌共培养,发现氧化DNA损伤的累积与慢性炎症的组合效应可能在幽门螺杆菌相关胃癌的发生、发展中发挥关键作用[62]。
5 讨论和展望
共培养策略的应用使3D类器官模型更加接近于体内真实状态,但对于任何模型来说,其组成和功能均无法达到真正的体内水平,内在缺陷不可避免。类器官模型在许多方面仍然是亟待优化、完善的,体内微环境中多种细胞成分的缺乏是当前类器官模型的重要问题[63],因为类器官的共培养条件通常是每种细胞类型最佳条件的折衷。每种细胞类型有特定培养基成分的需求,细胞产生的旁分泌因子的扩散和共培养细胞的增殖率也会受培养基成分的影响,因此为类器官的成熟和血管化选择合适的培养基极具挑战性。另一个实际限制是在大多数类器官模型中必须使用matrigel或其他动物衍生基质,以使细胞聚集成3D结构[2],但这些基质的组成尚不明确,去除类似材料的应用对于后续研究至关重要。未来研究的重点将是进一步优化共培养条件,同时关注培养基成分和使用的ECM类型等影响因素[23]。随着脱细胞技术、微流控装置、器官芯片、实时成像技术及3D打印技术的发展,类器官与共培养策略相结合将进一步加深研究者对机体发育、分子生物学和疾病发生、发展过程的理解,为生物医学领域的基础与临床研究提供更强大的生物模型平台。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] PRIOR N, INACIO P, HUCH M. Liver organoids: from basic research to therapeutic applications[J]. Gut, 2019, 68(12): 2228-2237.
[2] LAU H C H, KRANENBURG O, XIAO H P, et al. Organoid models of gastrointestinal cancers in basic and translational research[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(4): 203-222.
[3] Models for immuno-oncology research[J]. Cancer Cell, 2020, 38(2): 145-147.
[4] SMOLAR J, HORST M, SALEMI S, et al. Predifferentiated smooth muscle-like adipose-derived stem cells for bladder engineering[J]. Tissue Eng Part A, 2020, 26(17/18): 979-992.
[5] YUKI K, CHENG N, NAKANO M, et al. Organoid models of tumor immunology[J]. Trends Immunol, 2020, 41(8): 652-664.
[6] HOFER M, LUTOLF M P. Engineering organoids[J]. Nat Rev Mater, 2021, 6(5): 402-420.
[7] SAHIN U. Studying tumor-reactive T cells: a personalized organoid model[J]. Cell Stem Cell, 2018, 23(3): 318-319.
[8] CHAKRABARTI J, KOH V, SO J, et al. A preclinical humanderived autologous gastric cancer organoid/immune cell coculture model to predict the efficacy of targeted therapies[J]. J Vis Exp, 2021, (173).
[9] HOLOKAI L, CHAKRABARTI J, LUNDY J, et al. Murine- and human-derived autologous organoid/immune cell co-cultures as pre-clinical models of pancreatic ductal adenocarcinoma[J]. Cancers, 2020, 12(12): 3816.
[10] CHAKRABARTI J, HOLOKAI L, SYU L, et al. Hedgehog signaling induces PD-L1 expression and tumor cell proliferation in gastric cancer[J]. Oncotarget, 2018, 9(100): 37439-37457.
[11] TEIJEIRA A, MIGUELIZ I, GARASA S, et al. Threedimensional colon cancer organoids model the response to CEA-CD3 T-cell engagers[J]. Theranostics, 2022, 12(3): 1373-1387.
[12] OU L L, WANG H S, LIU Q, et al. Dichotomous and stable gamma delta T-cell number and function in healthy individuals[J]. J Immunother Cancer, 2021, 9(5): e002274.
[13] FERREIRA R O, GRANHA I, FERREIRA R S, et al. Effect of serial systemic and intratumoral injections of oncolytic ZIKV BR in mice bearing embryonal CNS tumors[J]. Viruses, 2021, 13(10): 2103.
[14] HUANG L X, RONG Y, TANG X, et al. Engineered exosomes as an in situ DC-primed vaccine to boost antitumor immunity in breast cancer[J]. Mol Cancer, 2022, 21(1): 45.
[15] WHELAN K A, MUIR A B, NAKAGAWA H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine[J]. Cell Mol Gastroenterol Hepatol, 2018, 5(4): 461-478.
[16] PATNAUDE L, MAYO M, MARIO R, et al. Mechanisms and regulation of IL-22-mediated intestinal epithelial homeostasis and repair[J]. Life Sci, 2021, 271: 119195.
[17] SCHREURS R R C E, BAUMDICK M E, SAGEBIEL A F, et al. Human fetal TNF-α-cytokine-producing CD4+ effector memory T cells promote intestinal development and mediate inflammation early in life[J]. Immunity, 2019, 50(2): 462-476.e8.
[18] GRETEN F R, GRIVENNIKOV S I. Inflammation and cancer: triggers, mechanisms, and consequences[J]. Immunity, 2019, 51(1): 27-41.
[19] JOWETT G M, NORMAN M D A, YU T T L, et al. ILC1 drive intestinal epithelial and matrix remodelling[J]. Nat Mater, 2021, 20(2): 250-259.
[20] YE W R, LUO C, LI C L, et al. Organoids to study immune functions, immunological diseases and immunotherapy[J]. Cancer Lett, 2020, 477: 31-40.
[21] XIANG Z, ZHOU Z J, SONG S Z, et al. Dexamethasone suppresses immune evasion by inducing GR/STAT3 mediated downregulation of PD-L1 and IDO1 pathways[J]. Oncogene, 2021, 40(31): 5002-5012.
[22] CATTANEO C M, DIJKSTRA K K, FANCHI L F, et al. Tumor organoid-T-cell coculture systems[J]. Nat Protoc, 2020, 15(1): 15-39.
[23] BAR-EPHRAIM Y E, KRETZSCHMAR K, CLEVERS H. Organoids in immunological research[J]. Nat Rev Immunol, 2020, 20(5): 279-293.
[24] CHERNE M D, SIDAR B, SEBRELL T A, et al. A synthetic hydrogel, VitroGel® ORGANOID-3, improves immune cellepithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells[J]. Front Pharmacol, 2021, 12: 707891.
[25] M O R I K A W A R , N E M O T O Y , Y O N E M O T O Y , e t a l . Intraepithelial lymphocytes suppress intestinal tumor growth by cell-to-cell contact via CD103/E-cadherin signal[J]. Cell Mol Gastroenterol Hepatol, 2021, 11(5): 1483-1503.
[26] DAVIDSON S, COLES M, THOMAS T, et al. Fibroblasts as immune regulators in infection, inflammation and cancer[J]. Nat Rev Immunol, 2021, 21(11): 704-717.
[27] SAHAI E, ASTSATUROV I, CUKIERMAN E, et al. A framework for advancing our understanding of cancerassociated fibroblasts[J]. Nat Rev Cancer, 2020, 20(3): 174-186.
[28] SAINI H, NIKKHAH M. Fabrication method of a high-density co-culture tumor-stroma platform to study cancer progression[J]. Methods Mol Biol, 2021, 2258: 241-255.
[29] JANG I, BENINGO K A. Integrins, CAFs and mechanical forces in the progression of cancer[J]. Cancers, 2019, 11(5): 721.
[30] NARUSE M, OCHIAI M, SEKINE S, et al. Re-expression of REG family and DUOXs genes in CRC organoids by coculturing with CAFs[J]. Sci Rep, 2021, 11(1): 2077.
[31] LUO X B, FONG E L S, ZHU C J, et al. Hydrogel-based colorectal cancer organoid co-culture models[J]. Acta Biomater, 2021, 132: 461-472.
[32] LIU J Y, LI P F, WANG L, et al. Cancer-associated fibroblasts provide a stromal niche for liver cancer organoids that confers trophic effects and therapy resistance[J]. Cell Mol Gastroenterol Hepatol, 2021, 11(2): 407-431.
[33] DAWSON J C, SERRELS A, STUPACK D G, et al. Targeting FAK in anticancer combination therapies[J]. Nat Rev Cancer, 2021, 21(5): 313-324.
[34] CHEN X, LI R, ZHAO H, et al. Phenotype transition of fibroblasts incorporated into patient-derived oral carcinoma organoids[J]. Oral Dis, 2021: 2021Nov5.
[35] MIURA A, YAMADA D, NAKAMURA M, et al. Oncogenic potential of human pluripotent stem cell-derived lung organoids with HER2 overexpression[J]. Int J Cancer, 2021, 149(8): 1593-1604.
[36] CHEN H, DU L, LI J, et al. Modeling cancer metastasis using acoustically bio-printed patient-derived 3D tumor microtissues[J]. J Mater Chem B, 2022, 10(11): 1843-1852.
[37] SHINKAWA T, OHUCHIDA K, MOCHIDA Y, et al. Subtypes in pancreatic ductal adenocarcinoma based on niche factor dependency show distinct drug treatment responses[J]. J Exp Clin Cancer Res, 2022, 41(1): 89.
[38] CHENG Q S, JABBARI K, WINKELMAIER G, et al. Overexpression of CD36 in mammary fibroblasts suppresses colony growth in breast cancer cell lines[J]. Biochem Biophys Res Commun, 2020, 526(1): 41-47.
[39] FIORINI E, VEGHINI L, CORBO V. Modeling cell communication in cancer with organoids: making the complex simple[J]. Front Cell Dev Biol, 2020, 8: 166.
[40] FELDMANN K, MAURER C, PESCHKE K, et al. Mesenchymal plasticity regulated by Prrx1 drives aggressive pancreatic cancer biology[J]. Gastroenterology, 2021, 160(1): 346-361.e24.
[41] CHEN X M, SONG E W. Turning foes to friends: targeting cancer-associated fibroblasts[J]. Nat Rev Drug Discov, 2019, 18(2): 99-115.
[42] DI DONATO M, ZAMAGNI A, GALASSO G, et al. The androgen receptor/filamin A complex as a target in prostate cancer microenvironment[J]. Cell Death Dis, 2021, 12(1): 127.
[43] NAKAMURA H, SUGANO M, MIYASHITA T, et al. Organoid culture containing cancer cells and stromal cells reveals that podoplanin-positive cancer-associated fibroblasts enhance proliferation of lung cancer cells[J]. Lung Cancer, 2019, 134: 100-107.
[44] JORGENSEN M, RAMESH P, TORO M, et al. Alginate hydrogel microtubes for salivary gland cell organization and cavitation[J]. Bioengineering (Basel), 2022, 9(1): 38.
[45] YANG H, FENG R, FU Q, et al. Human induced pluripotent stem cell-derived mesenchymal stem cells promote healing via TNF-α-stimulated gene-6 in inflammatory bowel disease models[J]. Cell Death Dis, 2019, 10(10): 718.
[46] MOUSSA L, LAPIÈRE A, SQUIBAN C, et al. BMP antagonists secreted by mesenchymal stromal cells improve colonic organoid formation: application for the treatment of radiation-induced injury[J]. Cell Transplant, 2020, 29: 963689720929683.
[47] CORDERO-ESPINOZA L, DOWBAJ A M, KOHLER T N, et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation[J]. Cell Stem Cell, 2021, 28(11): 1907-1921.e8.
[48] T A N A K A C , F U R I H A T A K , N A G A N U M A S , e t a l . Establishment of a mouse model of pancreatic cancer using human pancreatic cancer cell line S2-013-derived organoid[J]. Hum Cell, 2022, 35(2): 735-744.
[49] ADELSON R P, PALIKUQI B, WEISS Z, et al. Morphological characterization of Etv2 vascular explants using fractal analysis and atomic force microscopy[J]. Microvasc Res, 2021, 138: 104205.
[50] PALIKUQI B, NGUYEN D H T, LI G, et al. Adaptable haemodynamic endothelial cells for organogenesis and tumorigenesis[J]. Nature, 2020, 585(7825): 426-432.
[51] SALMON I, GREBENYUK S, ABDEL FATTAH A R, et al. Engineering neurovascular organoids with 3D printed microfluidic chips[J]. Lab Chip, 2022, 22(8): 1615-1629.
[52] AHN Y, AN J H, YANG H J, et al. Human blood vessel organoids penetrate human cerebral organoids and form a vessel-like system[J]. Cells, 2021, 10(8): 2036.
[53] PRADHAN S, WEISS A A. Probiotic properties of escherichia coli nissle in human intestinal organoids[J]. mBio, 2020, 11(4): e01470-e01420.
[54] PUSCHHOF J, PLEGUEZUELOS-MANZANO C, CLEVERS H. Organoids and organs-on-chips: Insights into human gutmicrobe interactions[J]. Cell Host Microbe, 2021, 29(6): 867-878.
[55] NAKAMOTO N, SASAKI N, AOKI R, et al. Gut pathobionts underlie intestinal barrier dysfunction and liver T helper 17 cell immune response in primary sclerosing cholangitis[J]. Nat Microbiol, 2019, 4(3): 492-503.
[56] NATARAJAN V, SIMONEAU C R, ERICKSON A L, et al. Modelling T-cell immunity against hepatitis C virus with liver organoids in a microfluidic coculture system[J]. Open Biol, 2022, 12(3): 210320.
[57] LEE D, KIM Y, CHUNG C. Scientific validation and clinical application of lung cancer organoids[J]. Cells, 2021, 10(11): 3012.
[58] HAN Y L, DUAN X H, YANG L L, et al. Identification of SARS-CoV-2 inhibitors using lung and colonic organoids[J]. Nature, 2021, 589(7841): 270-275.
[59] HUANG J, HUME A J, ABO K M, et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response[J]. Cell Stem Cell, 2020, 27(6): 962-973.e7.
[60] SHEK D, CHEN D S, READ S A, et al. Examining the gut-liver axis in liver cancer using organoid models[J]. Cancer Lett, 2021, 510: 48-58.
[61] HOLOKAI L, CHAKRABARTI J, BRODA T, et al. Increased programmed death-ligand 1 is an early epithelial cell response to helicobacter pylori infection[J]. PLoS Pathog, 2019, 15(1): e1007468.
[62] SAYED I M, SAHAN A Z, VENKOVA T, et al. Helicobacter pylori infection downregulates the DNA glycosylase NEIL2, resulting in increased genome damage and inflammation in gastric epithelial cells[J]. J Biol Chem, 2020, 295(32): 11082-11098.
[63] XU R, ZHOU X T, WANG S K, et al. Tumor organoid models in precision medicine and investigating cancer-stromal interactions[J]. Pharmacol Ther, 2021, 218: 107668.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言