盘点:利用抗体治疗HIV感染取得重大进展
2016-05-17 佚名 生物谷
2016年5月16日/生物谷BIOON/--近期,利用广泛中和HIV抗体控制和治疗HIV感染取得重大进展,尤其是利用从很好抵抗HIV感染的HIV“精英”控制者体内分离出来的强效广泛中和抗体特别值得研究。科学家们可以采用反向过程探究强效广泛中和HIV抗体在这些“精英”控制者体内的产生过程,从而为最终开发出治愈HIV感染的抗体药物或疫苗奠定坚实基础。那么具体而言,有哪些精彩研究呢?让小编一一道来。
近期,利用广泛中和HIV抗体控制和治疗HIV感染取得重大进展,尤其是利用从很好抵抗HIV感染的HIV“精英”控制者体内分离出来的强效广泛中和抗体特别值得研究。科学家们可以采用反向过程探究强效广泛中和HIV抗体在这些“精英”控制者体内的产生过程,从而为最终开发出治愈HIV感染的抗体药物或疫苗奠定坚实基础。那么具体而言,有哪些精彩研究呢?让小编一一道来。
1. Science:一箭三雕!HIV新靶点助推更强疫苗开发
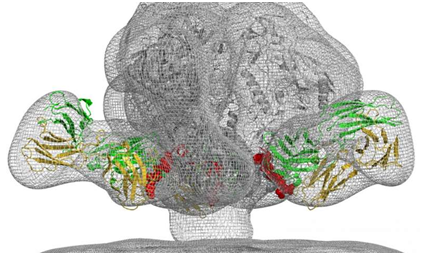
2. 两篇Science揭示抗体疗法有望治愈HIV
3. Science子刊:HIV的“大智慧”——借助免疫耐受阻碍广泛中和抗体形成
免疫系统会妨碍HIV疫苗发挥作用,使其无法诱导产生对抗HIV感染的抗体,最近来自美国杜克人类疫苗研究所的研究人员发现了或可帮助解决该问题的一种新方式。
4. PNAS:重大突破!科学家分离出可有效杀灭HIV的环状结构抗体
5. Cell:史上最全面揭示在HIV感染后发生的最早事件

6. Immunity:首次从中国病人体内分离出“青少年”HIV中和抗体http://news.bioon.com/article/6681151.html 在一项新的研究中,来自中国疾病预防控制中心、北京大学、南开大学和美国斯克利普斯研究所(TSRI)等机构的研究人员描述了有史以来首个在一类强效地抵抗HIV的免疫分子中发现的未成熟的或者说“青少年(teenage)”抗体。论文通信作者为TSRI生物学家Jiang Zhu和中国疾病预防控制中心艾滋病首席专家邵一鸣(Yiming Shao)。论文第一作者为TSRI研究员Yajing Chen、Leopold Kong(之前在TSRI,现在在美国国家卫生研究院)、Linling He和中国疾病预防控制中心科学家Bin Ju、Jiandong Liu和Li Ren。
7. Science:HIV重大突破!史上最详细HIV包膜三维结构出炉!
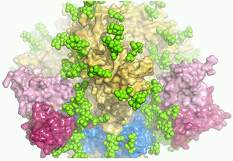
8. Science:大多数人都有潜力产生广泛中和HIV抗体,助推制定新的疫苗策略
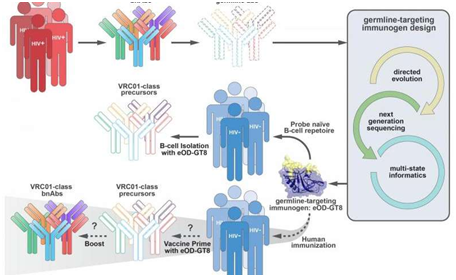
9. Cell:抵抗HIV的强效抗体如何形成的?
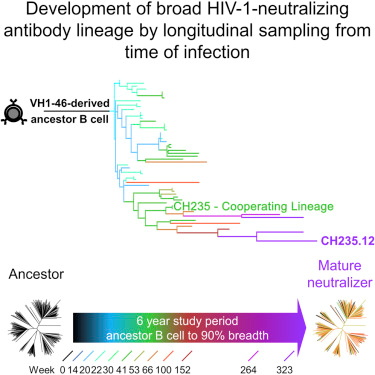
10. Science:研究者或可构建一种更好的HIV疫苗
刊登在近日的国际杂志Science上的一篇研究报告中,来自国外的研究人员设计了一种免疫原,它代表了朝着制造一种可在人体内释放对抗HIV-1的广谱中和抗体疫苗所迈出的重要的第一步。
俄勒冈州国家灵长类动物研究中心的科学家今天透露,将暴露在SHIV(具有HIV包膜蛋白的嵌合猴病毒)的婴猴于24小时内用抗体治疗,能将病毒彻底清除。这项研究在Nature Medicine杂志发表,表明给暴露在SHIV的婴猴进行抗体给药能够成功清除病毒,这是艾滋病科学界的重大进展。
12. Science子刊:注射强力抗体抑制血液中HIV病毒
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#重大进展#
30