Advanced Science:优化肿瘤治疗效果!科研团队发现缺氧耐药性新机制
2023-06-28 iMedicines iMedicines 发表于上海
该研究强调了ac4C在糖酵解成瘾调控中的关键作用,并提出了一种通过将阿帕替尼与ac4C抑制相结合来克服抗血管生成治疗的耐药性的有效策略。
长期以来,抗血管生成治疗一直被认为是实体瘤治疗的有效策略。对缺氧的内在耐药性是抗血管生成治疗失败的主要原因,但尚不清楚其潜在机制。
2023年6月16日,南方医科大学李国新、Ye Gengtai及Li Fengping共同通讯在Advanced Science 在线发表题为“N4-Acetylcytidine Drives Glycolysis Addiction in Gastric Cancer via NAT10/SEPT9/HIF-1α Positive Feedback Loop”的研究论文,该研究新发现了一种mRNA修饰物——N4-乙酰胞苷(ac4C),通过诱导过度糖酵解来增强胃癌(GC)细胞的缺氧耐受性。具体而言,乙酰转移酶NAT10的转录受缺氧诱导因子-1α(HIF-1α)的调控,缺氧诱导因子是细胞对缺氧反应的关键转录因子。
acRIP测序、核糖体测序、RNA测序和功能研究证实,NAT10通过介导SEPT9 mRNA的ac4C修饰,进而激活HIF-1途径和随后的糖代谢重编程。NAT10/SEPT9/HIF-1α正反馈回路的形成促使HIF-1途径过度激活,并诱导糖酵解成瘾。抗血管生成和ac4C抑制的联合应用可降低体内缺氧耐受性并抑制肿瘤进展。该研究强调了ac4C在糖酵解成瘾调控中的关键作用,并提出了一种通过将阿帕替尼与ac4C抑制相结合来克服抗血管生成治疗的耐药性的有效策略。

尽管胃癌(GC)研究十年来已取得显著进展并改善了手术和综合治疗效果,但其仍是2020年全球第五大最常见的癌症和第四大与癌症相关的死亡原因。抗血管生成治疗(如贝伐单抗、阿帕替尼)是各种肿瘤的公认疗法,可改善无进展存活期(PFS)和总生存期(OS)的晚期GC患者。然而,抗血管生成治疗也会在肿瘤内引起强烈的缺氧。为了响应缺氧微环境,肿瘤细胞通过萄糖代谢重编程快速且大量地产生ATP,以维持细胞存活和增生性生长,限制了抗血管生成治疗的效果。因此,有必要解开代谢重编程的机制,找出打破肿瘤细胞耐缺氧的治疗靶点。
缺氧是肿瘤微环境的主要特征之一,触发细胞葡萄糖代谢重编程,说明癌细胞严重依赖糖酵解而不是线粒体氧化磷酸化(OXPHOS)来维持基本的生物学功能。作为细胞缺氧反应的关键介质,HIF-1α的积累激活了参与缺氧稳态反应的基因,如己糖激酶(HK)、乳酸脱氢酶(LDH)和丙酮酸脱氢酶激酶(PDK),以促进糖酵解并抑制OXPHOS过程。因此,过度活跃的HIF-1信号传导导致糖酵解成瘾。越来越多的证据表明,mRNA修饰广泛参与代谢重组过程,如N6-甲基腺苷(m6A)通过激活mTOR信号通路或上调代谢酶(如HK2和PDK4)的表达来增强癌细胞中的葡萄糖代谢重组。同样,作者新发现了一种mRNA修饰物——N4-乙酰胞苷(ac4C),其在缺氧GC细胞中大量富集,表明ac4C和缺氧耐受性之间存在密切联系。然而,尚不清楚ac4C调节肿瘤细胞缺氧耐受性的机制。
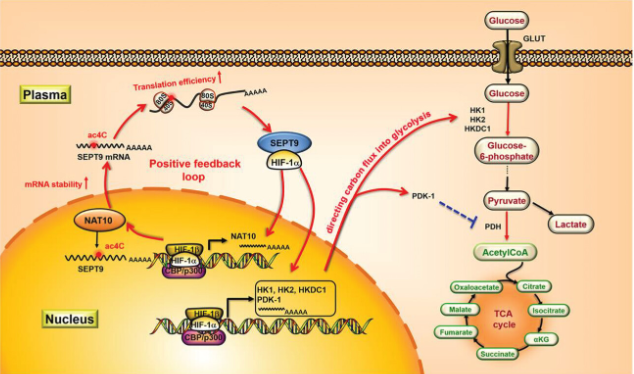
NAT10/SEPT9/HIF-1α调节胃癌细胞糖酵解成瘾的正反馈回路机制示意图(摘自Advanced Science )
最初在tRNAs和18S rRNA中了发现ac4C,最近发现其广泛存在于整个人类转录组中。作为唯一已知的ac4C“writer”蛋白,Nat10同时具有乙酰基转移酶和RNA结合活性,提高了mRNA的稳定性和翻译效率。越来越多的证据表明,ac4C的失调在许多疾病的发病机制中起着重要作用,如HIV和肠道病毒71(EV71)的复制、骨质疏松、心肌细胞凋亡和精原细胞分化失败,且ac4C与肿瘤进展密切相关(如多发性骨髓瘤、胰腺癌、膀胱癌和胃癌)。Nat10通过介导BCL9L、Sox4和AKT1的mRNA ac4C修饰来调节膀胱癌细胞的细胞周期和癌症干性。此外,Nat10通过乙酰化多发性骨髓瘤中的CEP170 mRNA促进细胞增殖。虽然有研究表明Nat10通过直接介导COL5A1 mRNA的ac4C修饰来促进GC细胞的上皮向间充质转化(EMT)过程,但尚不清楚ac4C在GC中的功能作用。
该研究揭示了mRNA ac4C修饰与缺氧之间的关系,为解释ac4C在GC中的作用机制提供了新参考。通过结合acRIP测序(acRIP-seq)、核糖体分析测序(Ribo-seq)和RNA测序(RNA-seq)分析,该团队揭示了一种NAT10/SEPT9/HIF-1α正反馈环促进糖酵解成瘾的新机制,并基于这一机制提出了一种有效的GC治疗策略,将阿帕替尼与ac4C抑制相结合,以克服抗血管生成治疗耐药性并优化肿瘤治疗效果。
参考来源:https://onlinelibrary.wiley.com/doi/10.1002/advs.202300898
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习了,谢谢分享
43