Nat Commun:基于6千余例肿瘤样本体细胞SNV分析揭示lncRNA突变可增强肿瘤细胞适应性
2023-06-26 测序中国 测序中国 发表于上海
该研究证明了驱动分析在绘制促癌lncRNA图谱中的实用性,并揭示体细胞突变可以通过lncRNA发挥作用,增强癌细胞的适应性。
癌细胞中会大量积累在正常细胞中没有的体细胞突变,这些突变可使癌细胞具有适应性优势,进而导致癌症的发生、发展。其中,仅有少数为“驱动突变”,能被正选择,驱动正常细胞向增殖癌细胞转化。因此,识别驱动突变及其作用的“驱动基因”,是理解和治疗癌症的关键一步。
大多数体细胞单核苷酸突变(SNV)位于蛋白质编码基因之外,随着人们对非编码基因组元件的认知不断提高,科研人员探究了非蛋白质编码突变能否影响癌细胞的适应性,并重点关注长非编码RNA(lncRNA)。lncRNA表达水平的致病性变化与癌症相关,lncRNA基因也被发现容易在肿瘤DNA中发生高度突变(如NEAT1)。但目前尚不清楚lncRNA是否也可以通过体细胞“驱动突变”来影响肿瘤细胞的适应性,因此“驱动lncRNA”是否存在也无法确定。
近日, 瑞士伯尔尼大学、爱尔兰都柏林大学学院等机构的科研人员合作在国际著名期刊Nature Communications上在线发表了题为“Tumour mutations in long noncoding RNAs enhance cell fitness”的文章。为验证驱动lncRNA的存在,研究团队开发了一个强化的驱动lncRNA识别框架ExInAtor2。利用该框架,从2,583个原发性和3,527个转移性肿瘤的体细胞SNV中筛选候选驱动lncRNA,并对其临床和基因组特性进行评估。该研究证明了驱动分析在绘制促癌lncRNA图谱中的实用性,并揭示体细胞突变可以通过lncRNA发挥作用,增强癌细胞的适应性。

文章发表在Nature Communications上
基于ExInAtor2发现驱动lncRNA
驱动基因可以通过作用于体细胞突变的正向选择信号来识别。其中,两个主要信号是突变负担(MB)和功能影响(FI),即预测突变影响编码功能的程度,其必须与适当的背景值相比较,以代表中性选择下的突变。
为识别具有驱动活性的lncRNA,研究团队开发了一个具有高灵敏度的计算框架“ExInAtor2”,其存在两个关键的创新:集成MB和FI信号以及估算经验背景值(图1)。ExInAtor2与基因/功能元件的生物型无关,允许已建立的蛋白质编码基因数据进行独立的基准测试。
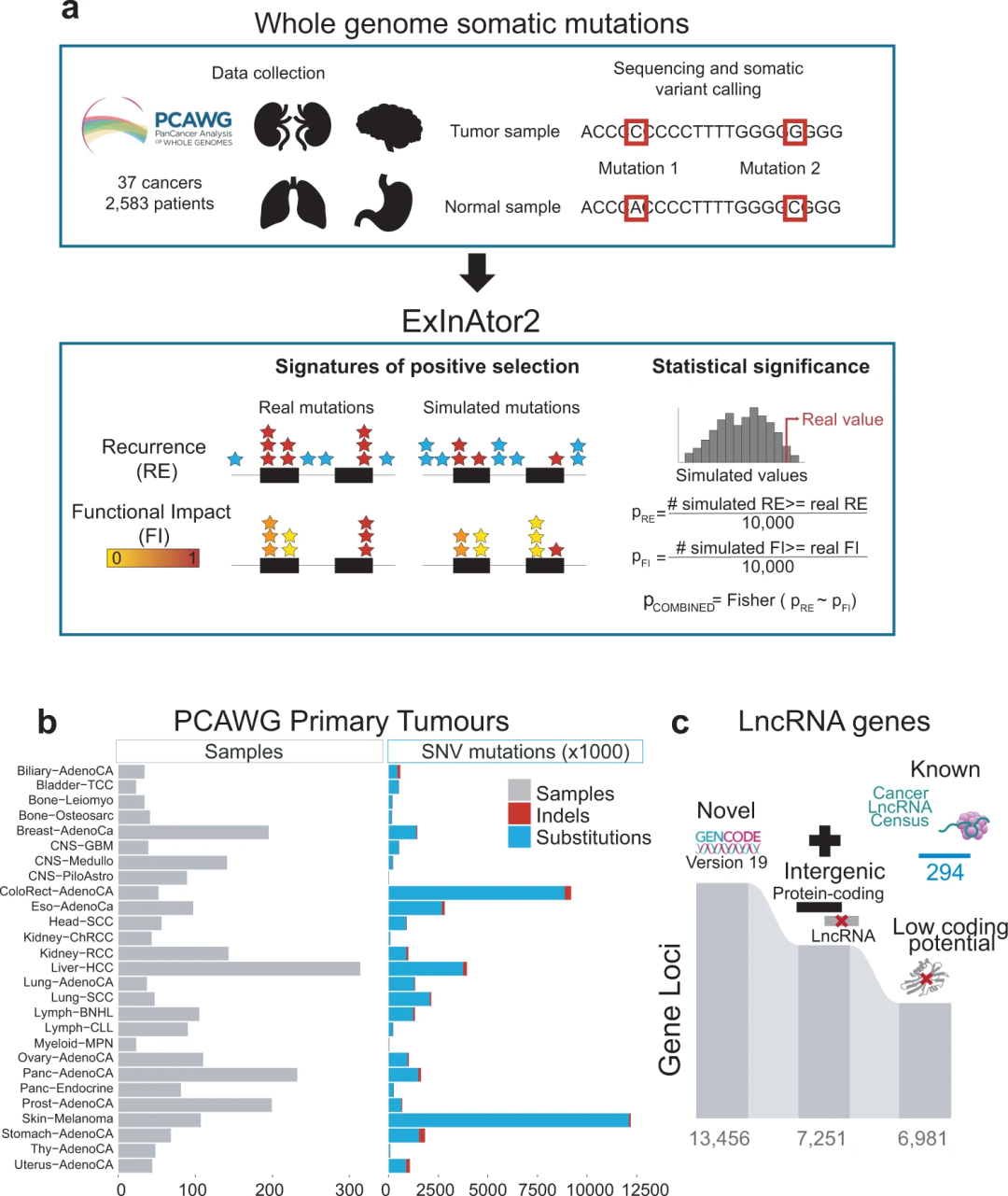
图1. 使用ExInAtor2识别驱动lncRNA的框架流程。
研究团队使用全基因组泛癌分析(PCAWG)项目的肿瘤基因组体细胞SNV图谱对ExInAtor2进行基准测试,共包含来自2,583名参与者的45,704,055个SNV(图2)。为最大限度地提高灵敏度和特异性,研究团队准备了过滤的lncRNA注释,分离出缺乏蛋白质编码能力的基因间lncRNA,最终得到一个包含7,275个基因的lncRNA集。
研究团队将ExlnAtor2与10种先进的驱动因素发现方法等进行了性能比较。结果显示,当错误发现率(FDR)截止值<0.1时,ExInAtor2的F1评分较高且显示出最佳的总体准确性。进一步性能检测发现,ExInAtor2表现良好,假阳性预测率较低。综上,ExInAtor2能以较低且可控的错误发现率识别已知的驱动基因。
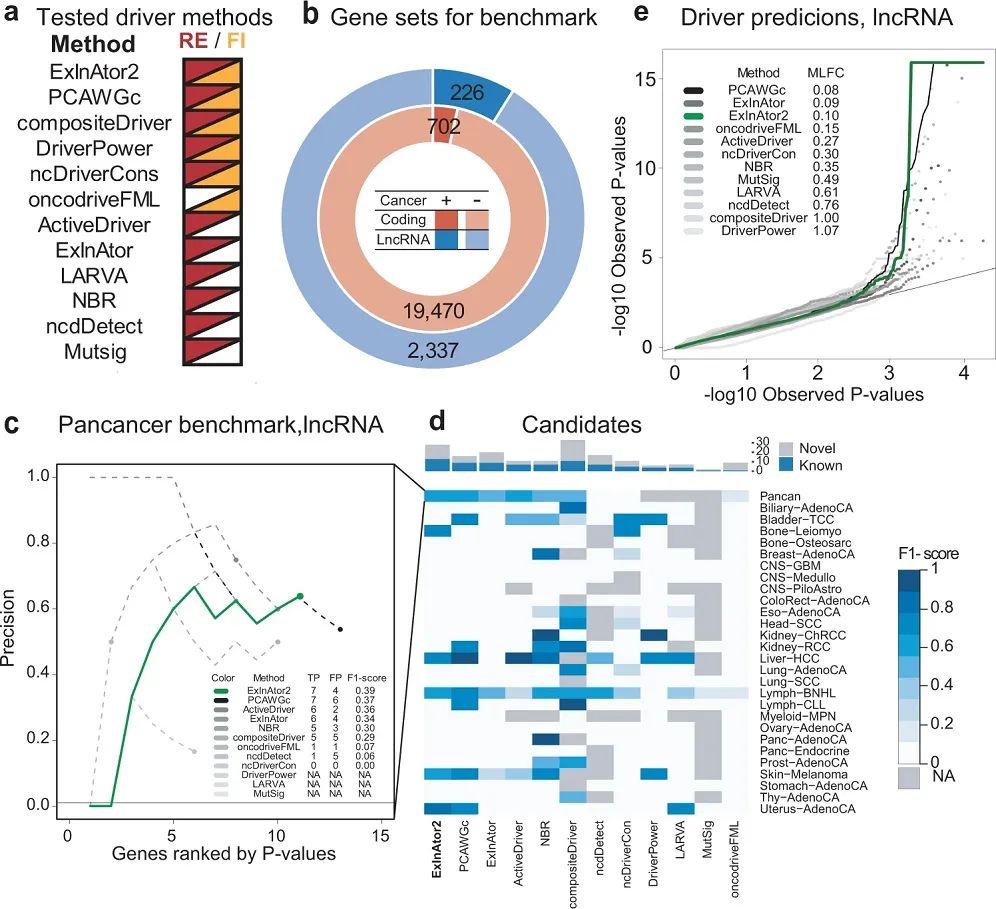
图2. ExlnAtor2可准确识别驱动基因。
驱动lncRNA在原发性人类肿瘤中的全景图谱
接下来,研究团队绘制了人类原发性肿瘤中突变lncRNA的全基因组图谱(图3)。来自PCAWG的肿瘤被分为37个队列,规模从两个肿瘤类型、314个肿瘤类型到整个泛癌组不等。在去除可能的假阳性关联后,ExInAtor2共发现21个独特的癌症-lncRNA关联,涉及17个lncRNA,这些lncRNA也是预测的驱动lncRNA,其在已知癌症lncRNAs中高度富集。
驱动lncRNA的剪接长度往往较长,并具有癌症基因的临床特征。与正常组织相比,驱动lncRNA在肿瘤中的平均表达量高158倍。上述结果表明,驱动lncRNA在健康器官中表现出更高的进化序列保守性和稳态水平。
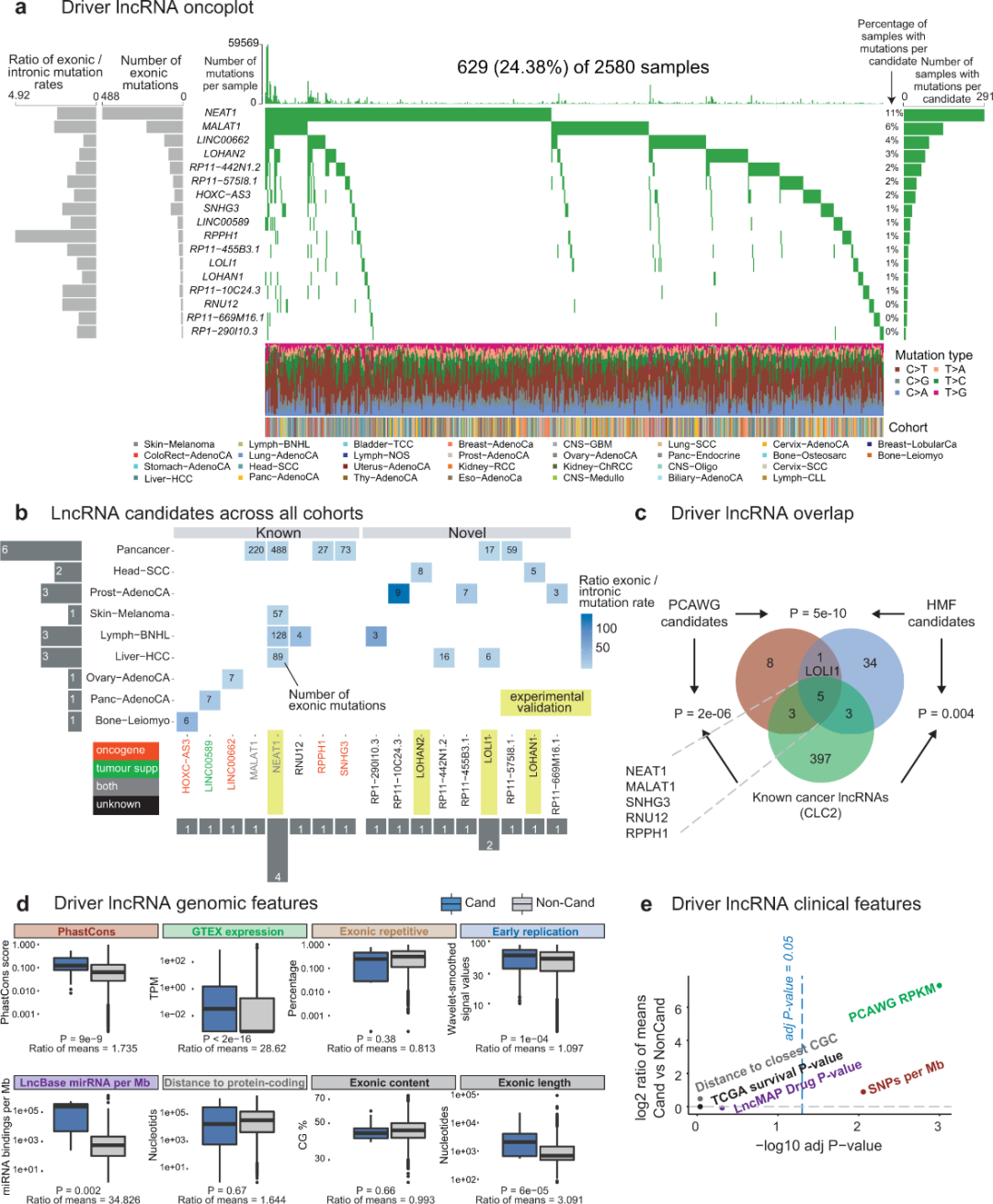
图3. 驱动lncRNA在原发肿瘤中的分布。
NEAT1突变提高癌细胞适应性并与生存率相关
为了解增强适应性的驱动突变如何通过lncRNA发挥作用,研究团队选择了基因NEAT1进行深入分析,其目前已有可靠的机制和功能数据(图4)。基于ExInAtor2分析,NEAT1突变横跨整个基因长度,并分别产生长度为3.7kb和22.7kb的两种异构体(称为NEAT1_1 / NEAT1_2),其在基因5′处完全重叠。
接下来,研究团队根据突变密度、进化保守性和已知功能选择了NEAT1的六个区域(以下简称Reg1、Reg2...),使用15个sgRNA对其进行靶向,并量化了突变对细胞适应性的影响。与预期一致,NEAT1_1缺失的细胞生长降低,对照sgRNA则无影响。值得注意的是,在NEAT1敲除背景下,靶向NEAT1的sgRNA作用消失,这表明细胞适应性变化是NEAT1突变引起的。
研究团队使用裸鼠模型在现实体内环境中进一步检测了NEAT1突变的驱动潜力,将携带Reg2和Reg3突变的HCT116细胞植入小鼠皮下,并检测所产生突变的生长情况。结果显示,携带Reg2突变的肿瘤明显大于对照组,这表明Reg2处的NEAT1突变可提高细胞适应性。
最后,研究团队分析了NEAT1突变是否与患者生存率相关。在PCAWG队列的淋巴癌患者中,NEAT1突变与不良预后显著相关。综上,在一系列遗传背景下,NEAT1突变可持续增加体外和体内细胞的适应性,并与淋巴癌患者的不良预后相关。
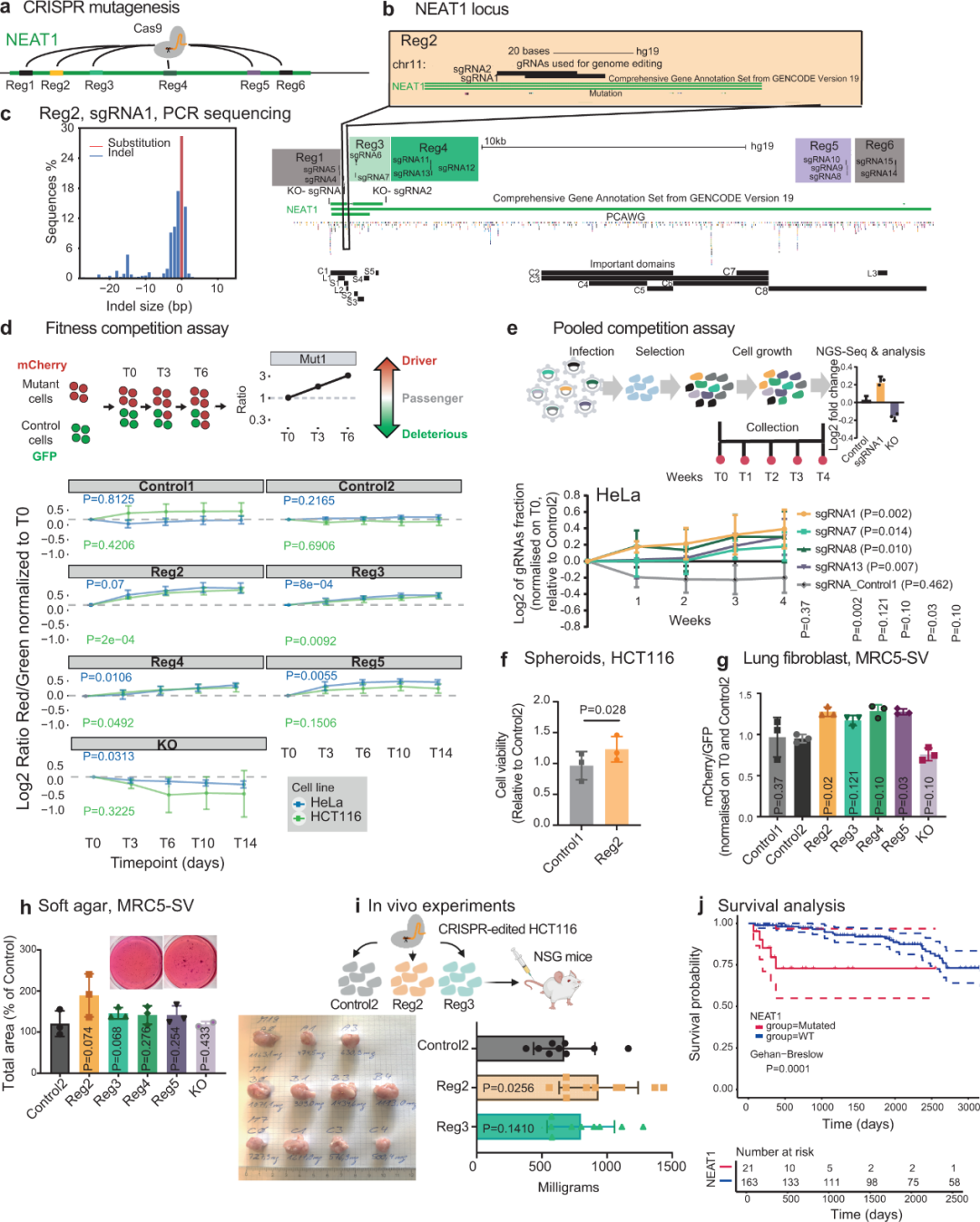
图4. NEAT1突变促进细胞适应性并与生存率相关。
结 语
综上所述,为识别驱动lncRNA,研究团队开发了一种名为“ExInAtor2”的方法,并使用其对来自数千个原发性和转移性肿瘤的体细胞SNV进行分析,创建了候选驱动lncRNA集。该研究提供了实验证据,证明了lncRNA突变可增强肿瘤细胞适应性,这为未来阐明驱动lncRNA的范围和机制提供了基础。
参考文献:
Esposito, R., Lanzós, A., Uroda, T. et al. Tumour mutations in long noncoding RNAs enhance cell fitness. Nat Commun 14, 3342 (2023). https://doi.org/10.1038/s41467-023-39160-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







很好,学习
36
学习了
37