PLOS ONE:癌细胞和白细胞杂交可形成转移性肿瘤
2013-07-15 Alexa 译 cmt
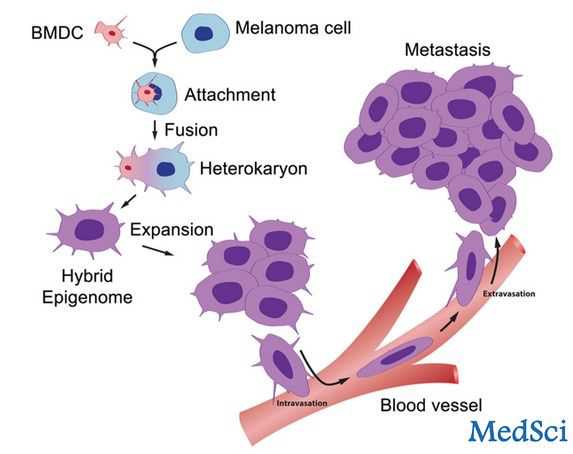
耶鲁大学癌症中心、丹佛警察犯罪实验室、美国科罗拉多大学的科学家们共同进行了一项研究证实,人白细胞和肿瘤细胞进行了基因融合杂交后,可形成人转移性肿瘤,相关研究结果发表在《影响因子(PLOS ONE)》上。科学家将解答,癌细胞如何从原发肿瘤的部位扩散到远处的器官和组织这一致命的转移过程。 首次提出人类癌症转移理论是在一个世纪以前,但是直至现今,该理论仍尚未被证实,因为同一个病人细胞
耶鲁大学癌症中心、丹佛警察犯罪实验室、美国科罗拉多大学的科学家们共同进行了一项研究证实,人白细胞和肿瘤细胞进行了基因融合杂交后,可形成人转移性肿瘤,相关研究结果发表在《影响因子(PLOS ONE)》上。科学家将解答,癌细胞如何从原发肿瘤的部位扩散到远处的器官和组织这一致命的转移过程。
首次提出人类癌症转移理论是在一个世纪以前,但是直至现今,该理论仍尚未被证实,因为同一个病人细胞基因间的差异无法区分。为了解决这个问题,科学家分析了一组继发性恶性肿瘤患者的基因组DNA,患者发生了黑色素瘤脑转移,并接受了自己兄弟的骨髓进行了骨髓移植。
科学家发现,无论是患者本人还是供体的肿瘤细胞标记基因,均提供了一手证据:来源于供体的白细胞可与癌细胞融合,启动肿瘤转移发生。
本文的通讯作者、耶鲁大学癌症中心和耶鲁大学医学院皮肤科研究学院的John Pawelek教授说:“我们的研究结果首次为人类肿瘤转移理论提供了证据,证实了1911年德国病理学家的理论。当白细胞和癌细胞基因融合杂交后肿瘤发生转移。这项研究将打开癌症治疗的新目标。但仍需要很多工作要完善,比如确定基因是如何融合的,再人类癌症中这种杂交的频率、杂交体再癌症转移中的潜在作用等。”

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Plos one#
46
#癌细胞#
26
#转移性#
32