血管周围间隙扩大不是脑小血管病的独立类型,是其发病危险因素
2023-02-16 ANDs ANDs 发表于安徽省
关键词:脑小血管病;血管周围间隙扩大随着影像学技术的发展,脑小血管病的临床诊断已越来越清晰。
关键词:脑小血管病;血管周围间隙扩大
随着影像学技术的发展,脑小血管病的临床诊断已越来越清晰。2013年我国《脑小血管病的诊治专家共识》列出了影像学的四个主要临床表现:腔隙性脑梗死、脑白质病变、脑微出血和血管周围间隙扩大(Enlarged perivascular space, EPVS)[1]。在一定意义上,脑小血管病据此而进行了临床上的分类,EPVS常常被人们认为是脑小血管病的一个临床类型。
血管周围间隙(perivascular space,PVS),又称V-R(Virchow-Robin)间隙,为血管周围淋巴间隙,PVS是神经系统内的正常解剖结构。大量临床资料表明EPVS见于老年脑、高血压、糖尿病、神经变性性疾病、脑白质病变、脑积水、多发性硬化、中枢神经隐球菌感染、儿童脑发育性疾病等。所以,EPVS不是一个特定的疾病,是一个贯穿于整个年龄段的病理生理过程,更不是属于某一个疾病的类型。EPVS与脑小血管病的关系需要进一步明确,EPVS是不是脑小血管病的一个临床类型?我们的结论是:EPVS是脑小血管病发生的危险因素,不是脑小血管病的一个独立临床类型。
血管周围间隙
血管周围间隙(perivascular space,PVS),又称V-R(Virchow-Robin)间隙,也有称之为血管周围淋巴间隙。PVS是神经系统内的正常解剖结构,具有一定的生理和免疫功能。PVS是在一个多世纪前由德国病理学家Rudolf Virchow(1812-1902年)与法国解剖学家Charles Phillippe Robin(1821-1885年)对其进行描述,因此又命名为Virchow-Robin间隙(VRS)。
PVS包绕在经蛛网膜下腔进入脑实质的小血管(动脉、小动脉、静脉、小静脉)壁周围,并不与蛛网膜下腔直接相通,是软脑膜随着穿通动脉和流出静脉进出脑实质的延续而成。PVS将血管与周围的脑组织分离开来,是神经系统内的正常解剖结构。过去一直认为,PVS是蛛网膜下腔伴随穿通血管进入脑实质的延伸,与蛛网膜下腔是相通的。目前认为,PVS是与软脑膜下腔接续的,大脑半球的PVS与蛛网膜下腔并不直接相通,PVS是软脑膜随着穿通动脉和流出静脉进出脑实质的延续而成。PVS的外界是神经胶质界膜,内界是血管外层,随着血管树一直延伸至毛细血管水平,最后,胶质界膜与血管外层融合成盲端,进而形成组织间隙(图1和2)。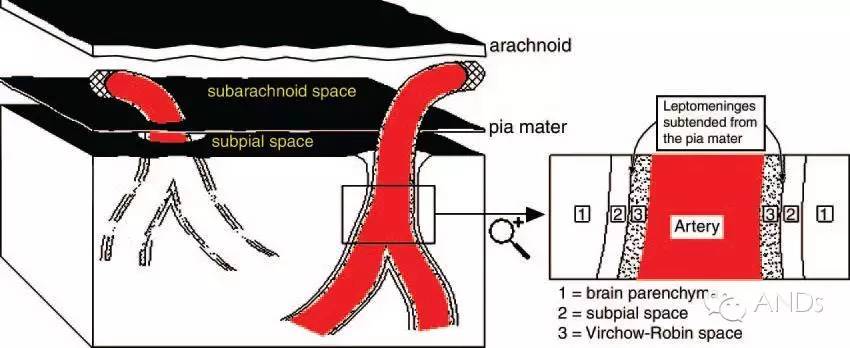
图1:PVS解剖学结构。左侧黑色方框标记处显示PVS环绕的皮层动脉穿过蛛网膜下腔和软脑膜下腔进入脑实质。右侧局部放大图显示动脉、PVS和脑实质之间的解剖关系。PVS是介于血管和软脑膜之间的组织间隙。1:脑实质(Brainparenchyma);2:软脑膜下间隙( Subpialspace );3:VRS ( Virchow-Robin space ) 即血管周围间隙(Perivascularspace,PVS)。Arachnoid:蛛网膜;Artery:动脉;Pia mater: 软脑膜;Subarachnoid space: 蛛网膜下腔。
图2:PVS组织学结构。前穿通动脉冠状面示两个动脉(直箭头)和环绕的VRS(弯箭头),即PVS。
PVS生理意义:PVS直径约1~2mm,充满组织间液,而不是脑脊液。PVS的重要生理功能是作为脑组织间液排出的一个主要通路。PVS内液体主要含有淀粉样蛋白P组分、内氨酰胺基肽酶S和N、载脂蛋白E、蛋白多糖、免疫球蛋白G、白蛋白、乳转铁蛋白等。PVS与头颈部淋巴通路相连接,构成了组织间液经脑脊液排入淋巴系统的直接通道。PVS也提供了外来抗原进入脑、细胞间液和脑脊液的机会或可能,所以,PVS还可能作为疾病扩散或肿瘤细胞转移的一个常见途径。从病理生理学角度来看,PVS内有小胶质细胞,参与局部免疫调节作用,出现局部性免疫反应,参与神经免疫性疾病的发病进程(比如脑炎、多发性硬化等)。
血管周围间隙扩大
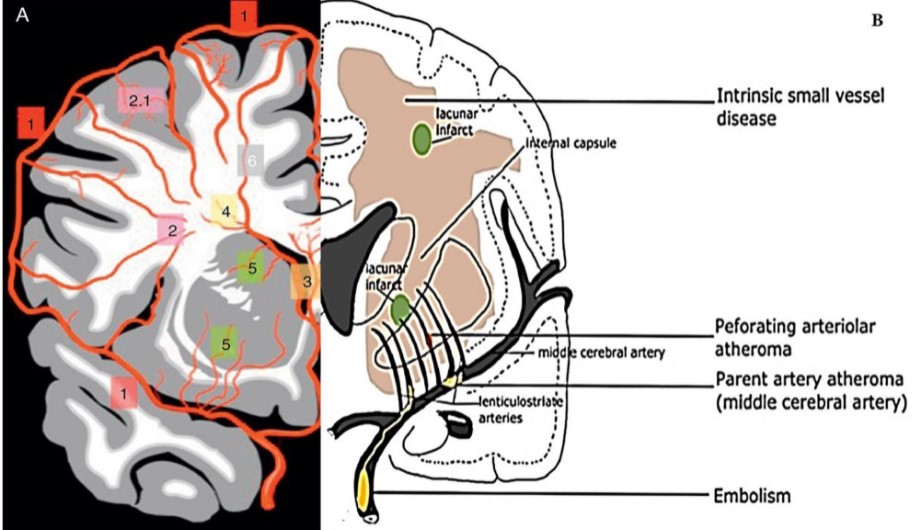
在PVS内的穿通动脉直径<0.4mm,血管周围约有0.3mm很窄的间隙,在MRI上是看不到的。只有当PVS扩大到一定程度(直径>0.66mm)后,MRI才能显示。一般认为,直径<2mm的PVS属正常解剖结构,见于各个年龄组的健康人。直径>2mm的PVS被认为是PVS扩大(Enlarged perivascular space,EPVS),还见有巨大PVS、海绵状PVS等。EPVS的形态学特征是边界光滑清楚,可呈椭圆形、圆形、线状或管状,通常双侧对称、边界清楚,直径在5mm以下,与穿通动脉的行径相一致。
对于EPVS发生的机制还不清楚,目前提出的主要解释有:①节段性坏死性血管炎或其他原因引起动脉壁通透性增高;②脑脊液回流受阻使组织间液排出障碍,从而导致PVS扩大;③ EPVS与年龄明显相关,在老年脑,血管硬化和扭曲,管腔变细和慢性脑缺血,造成EPVS;脑实质的萎缩也可引起EPVS扩大,又称作“拉空现象”。血管迂曲及脑萎缩导致细胞间液的蓄积;④沿动脉长轴分布的血管周围间隙纤维化和闭塞阻碍了液体流动;⑤组织间液经脑实质内小孔从细胞外向微血管周围软脑膜下间隙逐渐渗漏。
EPVS与神经系统疾病
大量临床资料表明EPVS与神经系统疾病有着密切联系。EPVS被认为是一些神经系统疾病的MRI生物标志物,涉及到神经炎症疾病、神经变性疾病、脑血管疾病、代谢性疾病、以及遗传性疾病等[2,3]。
首先,EPVS与儿童发育性脑疾病及神经精神障碍有关。儿童期EPVS常常不是孤立单独存在,常常与儿童发育性疾病共存,比如胼胝体发育不良、透明隔发育不全、大脑皮质发育不良、脑室扩大、蛛网膜下腔增宽、脑囊肿、巨颅症、以及脑白质异常等[4]。儿童期EPVS> 5.7毫米罕见,EPVS的大小并不随年龄的增加而增加。也有巨大PVS的形成:在解剖学上高度一致,分布在全脑半球,连接大脑凸面、基底池及脑室系统[5]。在脑干部位,在形态上EPVS高度类似于囊性肿瘤,容易误判[6]。儿童期EPVS 主要临床症状是认知功能损害、智能发育迟滞和精神障碍、神经痛、头痛和癫痫发作等[7,8]。Cohen等[9]报道一无症状的10岁女孩,MRI检查发现神经纤维瘤病1型伴随巨大囊性脑病变,与EPVS共存。儿童偏头痛、儿童自闭症和粘多糖沉积症也被发现与EPVS共存。而且发育性的EPVS可能具有常染色体隐性特征,比如Hartel等[10]报道姐弟俩同患家族性巨颅症,头颅MRI均显示脑室周围PVS呈囊性扩大。而且,Artigas等[11]对二例伴半卵圆中心EPVS的巨颅症患儿分别进行了1-4年和5-9年的追访,发现二例患儿神经发育过程正常,表明在巨颅症患儿神经系统发育过程中EPVS是良性预后的征象。
EPVS与中枢神经系统血管炎有关:已有报道中枢神经系统原发性血管炎(Primary angiitis of the central nervoussystem, PACNS)是EPVS形成的重要原因[12]。毛细血管前后的小动脉和小静脉周围的软脑膜被炎症浸润,引起动脉壁通透性增高,造成PVS的扩大。Campi等[12]对6例PACNS进行MRI和病理研究,其中4 例有EPVS,可能与软脑膜的浸润有关。活检病理显示受累血管为毛细血管前后的小动脉和小静脉,提示小血管疾病。
EPVS与中枢神经系统感染有关:中枢神经系统隐球菌病有很多表现,EPVS扩大可以是最早的表现之一,随病情进展而出现脑膜脑炎、脑实质内隐球菌性肉芽肿或脑脓肿。最主要的表现是EPVS和脑膜增强,其次有隐球菌性肉芽肿、出血性梗死和脑桥脓肿等。
EPVS与脑外伤有关:已有文献支持脑外伤是EPVS的重要原因[13]。脑外伤后引起的脑实质损伤修复后容积缩小是导致EPVS形成的重要物理学因素。
EPVS与脑积水有关:无论是原发性还是继发性脑积水,由于脑脊液循环动力学的原因,会导致组织间隙液的回流不畅,从而促进了EPVS的形成[14,15]。当然,EPVS有时也是脑积水的重要原因[16]。
EPVS与年龄有关:年龄是EPVS形成的另一个重要因素。影像学资料显示在老年人群中,无论是EPVS的数目还是在不同的脑区,都高于年轻人[17]。线性回归分析显示,血管周围间隙的数目、直径均与年龄呈正相关[18]。在老年脑内,血管硬化和扭曲,管腔变细和慢性脑缺血,造成EPVS;老年脑实质的萎缩也可引起EPVS扩大,造成“拉空效应”,导致细胞间液的蓄积。
EPVS是一个病理生理过程
PVS也称血管周围淋巴间隙,可见于任何年龄,是神经系统内的正常解剖结构,具有一定的生理和免疫功能。EPVS好发生于前连合两侧、近大脑凸面半卵圆中心、脑干大脑脚、外囊等, MRI成像各种序列显示与脑脊液信号完全一致。EPVS也可以见于各个年龄组的健康人。20岁以下出现率23%,21-40岁出现率33%,41-60岁出现率28%,61-80岁出现率33%,超过80岁者出现率18%。EPVS见于老年脑、高血压、糖尿病、神经变性性疾病、脑白质病变、脑积水、多发性硬化、中枢神经隐球菌感染、儿童脑发育性疾病等。所以,EPVS不是一个特定的疾病,是一个贯穿于整个年龄段的病理生理过程,更不是属于某一个疾病。
EPVS是认知功能损害和痴呆的危险因素
临床研究资料证明EPVS是认知功能损害和痴呆的危险因素[19]。首先,EPVS是神经变性性疾病的认知功能损害和痴呆的重要因素,比如帕金森病和阿尔茨海默病[20,21]。Lee等报道了巨大PVS与帕金森痴呆有着密切联系[20]。其次,流行病学显示EPVS是逐渐进展的认知障碍、人格和情感障碍的贡献者,也是血管性认知功能损害和血管性痴呆的重要危险因素[22]。
临床资料证实EPVS与脑白质病变有着相似的危险结果,且EPVS的大小和数目与脑白质病变的范围相关。临床上显示脑白质病变增加与老年人认知功能下降有着密切关系,也发现EPVS的数目增加与认知功能下降相关,尤其是非文字想象和视空间能力[23]。
EPVS是脑小血管病的危险因素
EPVS是脑小血管病发生的重要危险因素。腔隙性脑梗死是脑小血管病最为重要的一类。腔隙性脑梗死是位于大脑皮质下深部或脑干的小梗死灶,起源于大脑中动脉、后动脉、基底动脉,少数由大脑前动脉、椎动脉的穿通动脉阻塞引起。前穿质和基底节区上2/3的空腔通常为腔隙性脑梗死,而下1/3的空腔为豆纹动脉分支的PVS。通常EPVS和腔隙性脑梗死共存,有EPVS的患者更易于患腔隙性脑梗死。MRI研究证实,EPVS与脑白质病变相关,在单侧颈总动脉狭窄伴有EPVS更是如此[24]。脑白质病变作为脑小血管病病理改变的重要标识,EPVS会加速推进脑白质病变进程。通过多元有序Logistic回归分析,EPVS的严重程度与脑白质疏松症和腔隙性脑梗死的严重程度呈正相关[25]。作为另一种脑小血管病的“脑微出血”,影像学资料也显示EPVS与其共存,EPVS的严重程度与脑微出血的数目和严重程度呈正相关。
EPVS也是脑梗死发生的重要危险因素。不同部位和类型的血管周围间隙分别与不同的脑血管病危险因子相关,与脑梗死发病相关,是脑梗死发病的预知因子。曲红等[26]研究发现年龄与基底节上2/3多发的血管周围间隙相关,基底节多发的血管周围间隙与收缩压有关,基底节上2/3多发的血管周围间隙与糖尿病和高血压病相关,多发的皮质下白质和海马部的血管周围间隙也与血管性危险因子相关,基底节部位尤其是上2/3多发的血管周围间隙与脑梗死发病相关。
EPVS是独立的脑小血管病之一?
脑小血管病系指颅内小血管病变,包括颅内小动脉、微小动脉,以及毛细血管和小静脉的血管病变。近年来,随着MRI影像学的检查普及,人们对于脑小血管病的临床诊断也越见清晰。根据我国2013年《脑小血管病的诊治专家共识》,脑小血管病的影像学主要表现为腔隙性脑梗死、脑白质病变、EPVS和脑微出血。常常人们就把EPVS作为脑小血管病的一个临床亚型。
EPVS的发生可以和许多疾病联系着,甚至与儿童年幼患者更为精密,因此,EPVS不是脑血管疾病的专有,是许多疾病发生的一个病理生理过程。
从以上表述中,我们不难看出PVS是实际存在的血管附属结构,不是真正意义上的血管组成部分。PVS改变不是血管的改变,所以,EPVS应该不在脑小血管病范畴内,但与脑小血管病的发生有着密切联系。因此,EPVS是脑小血管病的危险因素,但不能把EPVS看作是独立的脑小血管病之一。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言