氧化苦参碱联合黄芪甲苷调节免疫:实现低毒高效抗三阴性乳腺癌
2024-03-05 网络 网络 发表于上海
前期研究发现,氧化苦参碱(Oxymatrine, Om)可通过调控上皮-间质转化过程和纤维化相关蛋白的积累,从而抑制癌症相关成纤维细胞的活化
乳腺癌是全球女性发病率最高的恶性肿瘤,临床放化疗可能会导致严重的副作用,而手术切除则有很高的复发率,因此要达到最佳治疗效果非常具有挑战性。三阴性乳腺癌(triple negative breast cancer, TNBC)是侵袭性最强的乳腺癌亚型,虽然目前肿瘤免疫疗法是临床上治疗肿瘤很有前景的方法,但是,由于TNBC中存在免疫抑制微环境,靶向PD 1/PD-L1抑制剂对其疗效有限,而且,TNBC缺乏有效的药物治疗特异性靶点。因此,治疗 TNBC 迫切需要创新的治疗策略。
前期研究发现,氧化苦参碱(Oxymatrine, Om)可通过调控上皮-间质转化过程和纤维化相关蛋白的积累,从而抑制癌症相关成纤维细胞(Cancer associated fibroblasts, CAFs)的活化,减少肿瘤间质增殖;黄芪甲苷(Astragaloside IV,As)具有潜在的增强肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)抗肿瘤活性的作用,然而,Om 和 As 对 TNBC 的潜在联合作用及其机制仍不确定。
日前,一篇发表在《International Immunopharmacology》杂志,名为“Combination of oxymatrine (Om) and astragaloside IV (As) enhances the infiltration and function of TILs in triple-negative breast cancer (TNBC)”的论文探讨了氧化苦参碱(Om)和黄芪甲苷Ⅳ(As)联用可增强TNBC中TILs的浸润和功能。

图1 论文首页
Om在体外抑制CAFs活化并增强T细胞浸润
经 5 ng/mL TGF-β1 处理 NIH3T3 细胞,建立CAFs的细胞模型,观察Om 对 CAFs 的影响。结果显示,Om 对 CAFs 增殖呈剂量依赖性的抑制作用(图 2A);对 CAFs 关键细胞标志物α-SMA 在 NIH3T3 中的表达升高呈抑制作用(图 2B-C)。此外,较低浓度的 Om能明显减少 TGF-β1 在 NIH3T3 细胞中的 FAP 表达(图2D)。进一步通过流式细胞术检测发现,在没有 Om 的情况下,T 细胞穿过成纤维细胞迁移到下腔的能力明显增强,表明 Om的处理能使 CAFs 失活(图2E-F)。
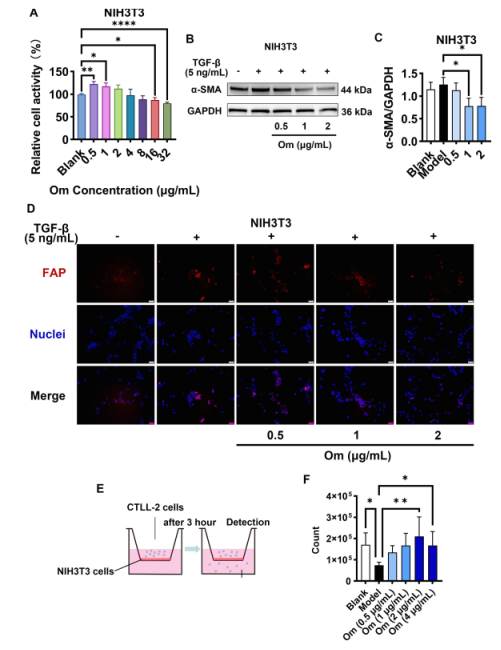
图2 Om 可抑制 CAFs 的活化并增强 T 细胞的浸润
As增强 T 细胞的功能活性
利用Transwell小室建立CTLL - 2细胞与4T1细胞的共培养体系,评估As对T细胞线粒体功能的影响。TEM图像显示,共培养条件下CTLL - 2中线粒体形态不规则,线粒体内嵴数量减少,表明T细胞中线粒体受损。经As处理后,线粒体体积和线粒体内嵴数量显著增加。
此外,在As处理组中,可观察到线粒体融合,表明受损的线粒体有改善(图3A-C)。进一步地,通过线粒体压力测试,评估CTLL - 2在不同处理条件下的呼吸能力(图3D )。共培养体系下CTLL- 2的基础OCR明显降低,而As处理后CTLL - 2的基础OCR显著增加,并呈剂量依赖性(图3E )。通过FCCP测定线粒体解偶联后的最大呼吸,在共培养组中细胞OCR显著降低,而在As组中趋势相反(图3F)。ELISA结果显示,经As处理后,T细胞中IFN -γ的释放增加(图3G )。不同浓度的As处理可增加与4T1共培养的CTLL - 2细胞中Granzyme B 的表达(图3H )。As处理CTLL - 2细胞后,4T1细胞的凋亡率增加(图3I - L)。这些结果表明,As 可通过调节线粒体活性增强TILs的肿瘤杀伤能力。
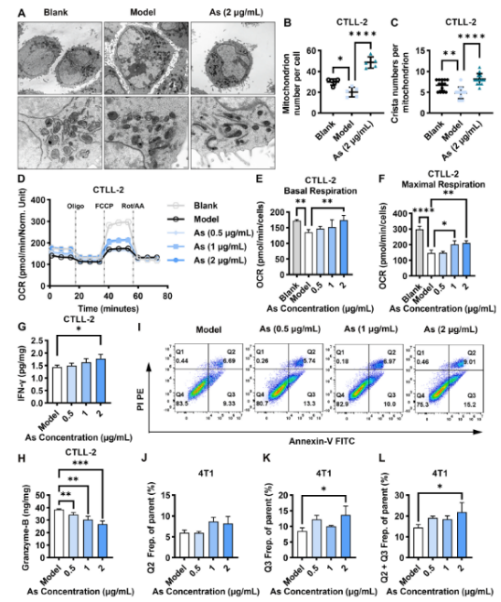
图3 As增强 T 细胞的功能活性
Om与As 联用对体外CAFs和T细胞的影响
首先利用 CAFs 和 CTLL-2 细胞模型筛选出 Om-As 的最佳比例。结果显示,Om-As与TGF-β1的比例为2:1时,可抑制TGF-β1诱导的NIH3T3细胞的增殖(图4A),而显著促进CTLL-2细胞的增殖(图4B)。Trans-CAFs 迁移实验结果显示,Om-As(2:1)可显著增加与单层 CAFs 共培养下室中 CTLL-2 细胞的数量(图 4C)。同时,细胞凋亡分析证实,与经 Om-As(2:1)处理的 CTLL-2 共培养的 4 T1 细胞凋亡率增加(图4D-G)。
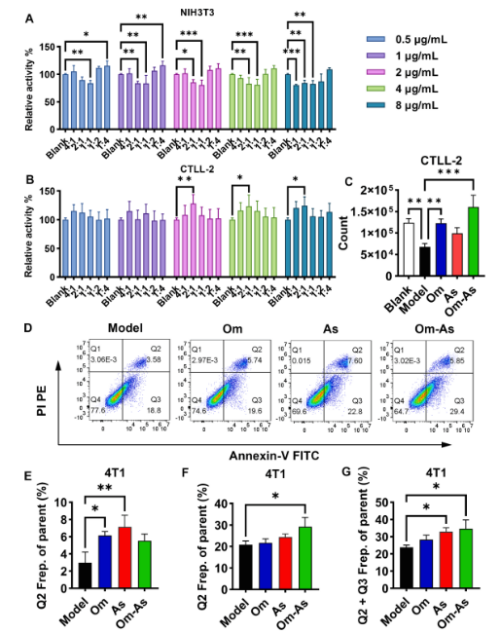
图4 Om与As联用对体外抗肿瘤治疗效果
Om –As体内抗乳腺癌药效研究
通过将 4 T1-luc 细胞接种到小鼠的乳腺脂肪垫内建立原位乳腺癌模型,注射 48h后,将小鼠分为不同剂量的 Om-As 处理组,以评估 Om-As 的抗肿瘤功效(图 5A)。给药后第 10 天,处死小鼠提取肿瘤组织并称重,与对照组相比,Om-As 组的抗肿瘤效果呈上升趋势(图 4B)。与生理盐水组(图4D - H)相比,Om - As治疗组的肿瘤重量、肿瘤体积和肿瘤指数均显著降低。H & E染色显示,Om-As 治疗后肿瘤细胞核面积明显缩小,肿瘤组织大面积坏死(图 6A)。与所有治疗组相比,未治疗组的 Ki67 增殖标记蛋白表达量较高(图 6B)。TUNEL 荧光检测证实,Om-As 组诱导了大量肿瘤细胞凋亡,这与肿瘤抑制率数据一致(图 6C)。上述结果表明,Om和As联合治疗不仅取得了显著的抗肿瘤效果,且无明显的不良反应。
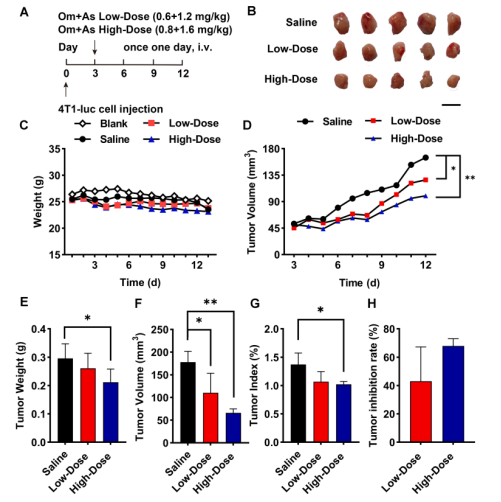
图5 Om - As的体内抗肿瘤治疗作用
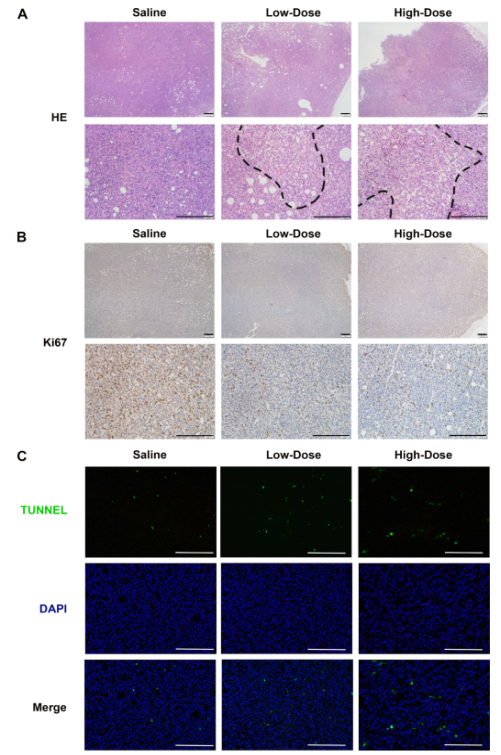
图6 Om - As体内抗肿瘤组织染色
Om-As 改善 TILs瘤内浸润
为探究Om - As抗TNBC机制,收集了4T1 - luc肿瘤组织进行流式分析。结果显示,与生理盐水组相比,Om-As(低剂量和高剂量)组均不同程度地增加了CD4+T和CD8+T细胞的数量(图7A-F)。此外, Om-As 组高剂量组显著提高了 CD4/CD8 比值(图 7G-H),改善了肿瘤免疫抑制微环境。

图7 Om - As可以改善肿瘤免疫抑制微环境
Om-As 可抑制 CAFs 并改善体内 TILs 的功能
共聚焦免疫荧光显示,生理盐水组α-SMA蛋白表达量显著增加,表明肿瘤内CAFs大量存在,而瘤内CD8 + T细胞浸润程度较低。经 Om-As 处理后,α-SMA 表达减少,瘤内 CD8 + T 细胞浸润增强(图 8A)。Masson染色表明 Om-As处理可减少 CAFs 的胶原沉积,从而抑制其活化(图 8B)。与生理盐水组相比,Om-As 增加了肿瘤内IFN-γ和Granzyme B 的表达(图 8C-D)。总体而言,Om - As通过抑制CAFs增加TILs的浸润,增强其抗TNBC作用。
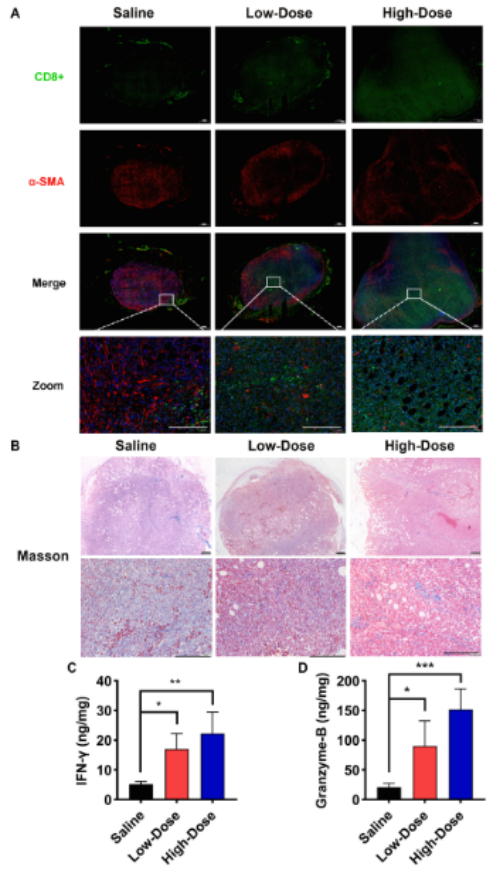
图8 Om-As 在乳腺癌原位模型 4 T1-luc 中的抗肿瘤活性
结论
Om和As-都可以提高TILs的功能水平,但作用方式不同,二者联合可增强TILs的浸润和功能,从而改善乳腺癌免疫抑制的肿瘤微环境。该研究可为开发低毒高效的抗肿瘤辅助药物提供理论支持。
参考文献:Wang H, Wei L, Mao D, Che X, Ye X, Liu Y, Chen Y. Combination of oxymatrine (Om) and astragaloside IV (As) enhances the infiltration and function of TILs in triple-negative breast cancer (TNBC). Int Immunopharmacol. 2023 Dec;125(Pt A):111026. doi: 10.1016/j.intimp.2023.111026. Epub 2023 Oct 23. PMID: 37866315.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







