Clin Cancer Res:ZUMA-7亚组分析:≥65岁患者中CAR-T优于移植
2023-04-03 聊聊血液 网络 发表于上海
老年 R/R LBCL 患者对有效和可耐受的根治性治疗的需求仍远未得到满足。
老年复发性/难治性 (R/R) 大 B 细胞淋巴瘤 (LBCL) 患者存在结局较差和无法耐受二线标准治疗 (SOC) 化疗的风险,鉴于 SOC 治疗的毒性风险增加(包括恶心、疲乏和感染), SOC 治疗方案后生活质量 (QoL) 也会显著降低。此外因为LBCL 诊断时的中位年龄为66岁,老年 R/R LBCL 患者对有效和可耐受的根治性治疗的需求仍远未得到满足。
Axicabtagene ciloleucel (axi-cel)是CD19 CAR-T细胞治疗产品,ZUMA-7研究头对头对比axi-cel和SOC作为R/R LBCL的二线治疗获得成功。在 ZUMA-7 的主要分析中,与 SOC 相比,axi-cel可显著改善无事件生存期 (EFS) (HR=0.398,P<0.0001),且中位 EFS 更长(8.3 vs.2.0个月)、估计24个月 EFS 率更高(40.5% vs. 16.3%)。此外axi-cel的不良事件 (AE) 特征与既往在难治性 LBCL 患者中进行的研究一致。生活质量 (QoL) 是患者选择治疗方法时的重要考虑因素,也可能是老年患者的决定因素;ZUMA-7研究中,与 SOC 患者相比,axi-cel患者达到有临床意义的 QoL 改善。
近日《Clinical Cancer Research》报告了预先计划的≥65岁 R/R LBCL 患者亚组分析的结果,评估了 ZUMA-7 研究中二线 axi-cel 与 SOC 相比的临床结局和患者报告结局(PRO)。


患者
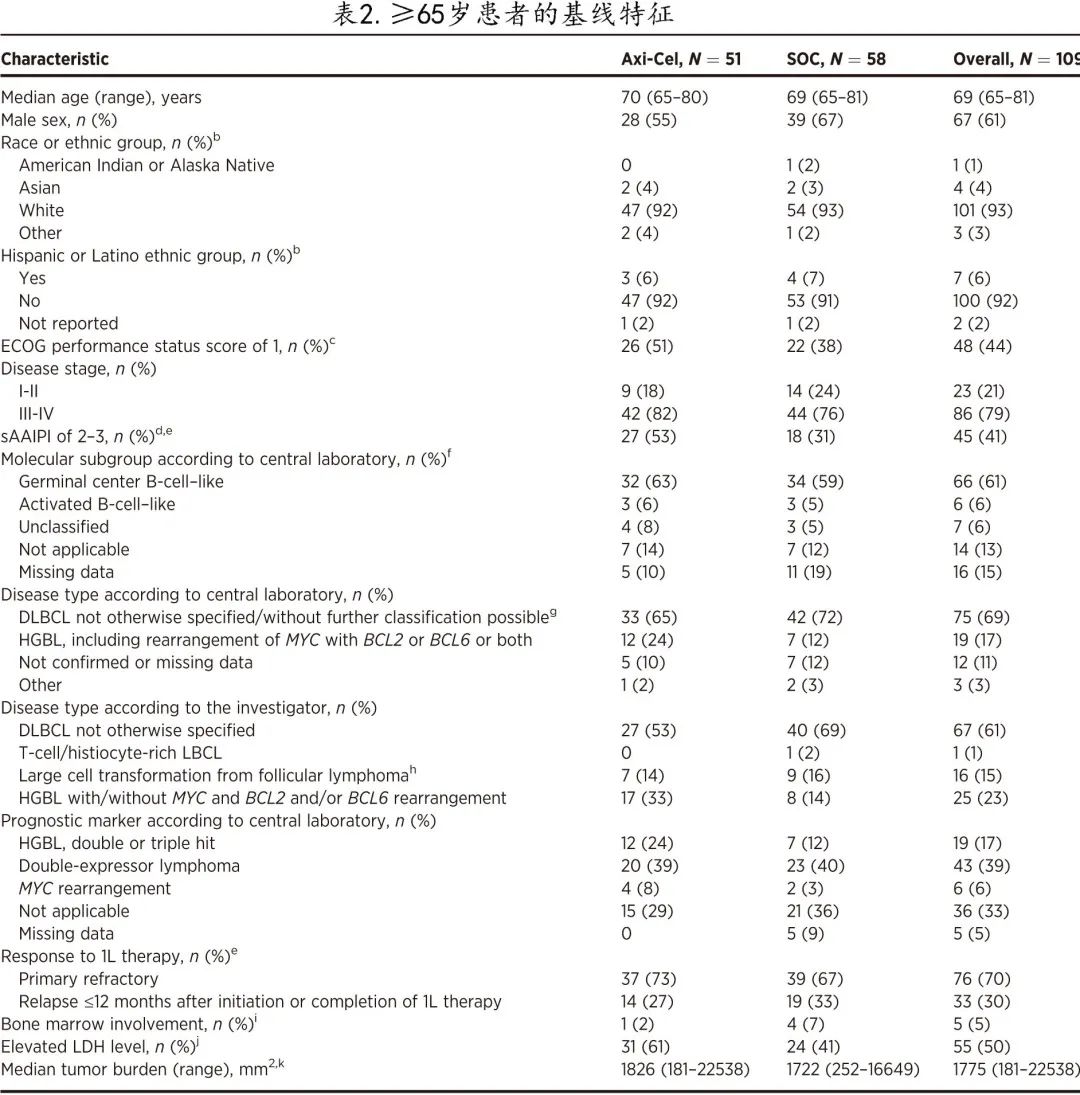
ZUMA-7研究359例患者中有109例患者≥65岁(axi-cel组51例和SOC组58例;图1),其中53例≥70岁(axi-cel组26例和SOC组27例)。

截至2021年03月18日,随机化后的中位随访时间为24.3个月。所有≥65岁患者的中位年龄为69岁。70%的患者为原发性难治。axi-cel 组和 SOC 组之间的基线特征大体平衡,但axi-cel 组具有高危特征的患者多于 SOC 组,包括高sAAIPI 2-3 (53% vs. 31%)、乳酸脱氢酶升高 (61% vs. 41%) 和高级别 B 细胞淋巴瘤(根据研究者评估;33% vs. 14%;表1)。
≥65岁患者的 axi-cel 生产成功率为100%,在随机分配至 axi-cel 组的51例患者中49例 (96%) 接受了 axi-cel 治疗。在随机分配到 SOC 的58例患者中,55例 (95%) 启动二线化学免疫治疗,仅20例 (34%) 实现HDT-ASCT(图1)。对于接受 axi-cel 治疗的患者,从白细胞单采至产品放行的中位时间为12天,从白细胞单采至在研究中心axi-cel 交付的中位时间为18天。在≥70岁的患者中,axi-cel 组24例 (92%) 患者接受了 axi-cel 治疗,SOC组6例 (22%) 患者接受了HDT-ASCT。
疗效
与 SOC 组相比,axi-cel组≥65岁患者 EFS (主要终点)显著延长(HR=0.276; P<0.0001;图2A),中位 EFS 分别为21.5个月和2.5个月,axi-cel 组24个月 EFS 率的 Kaplan-Meier 估计值为47.8%,SOC组为15.1%;≥70岁患者中12个月 EFS 率的Kaplan—Meier估计值,axi-cel组为42.3%,SOC组为3.7%。
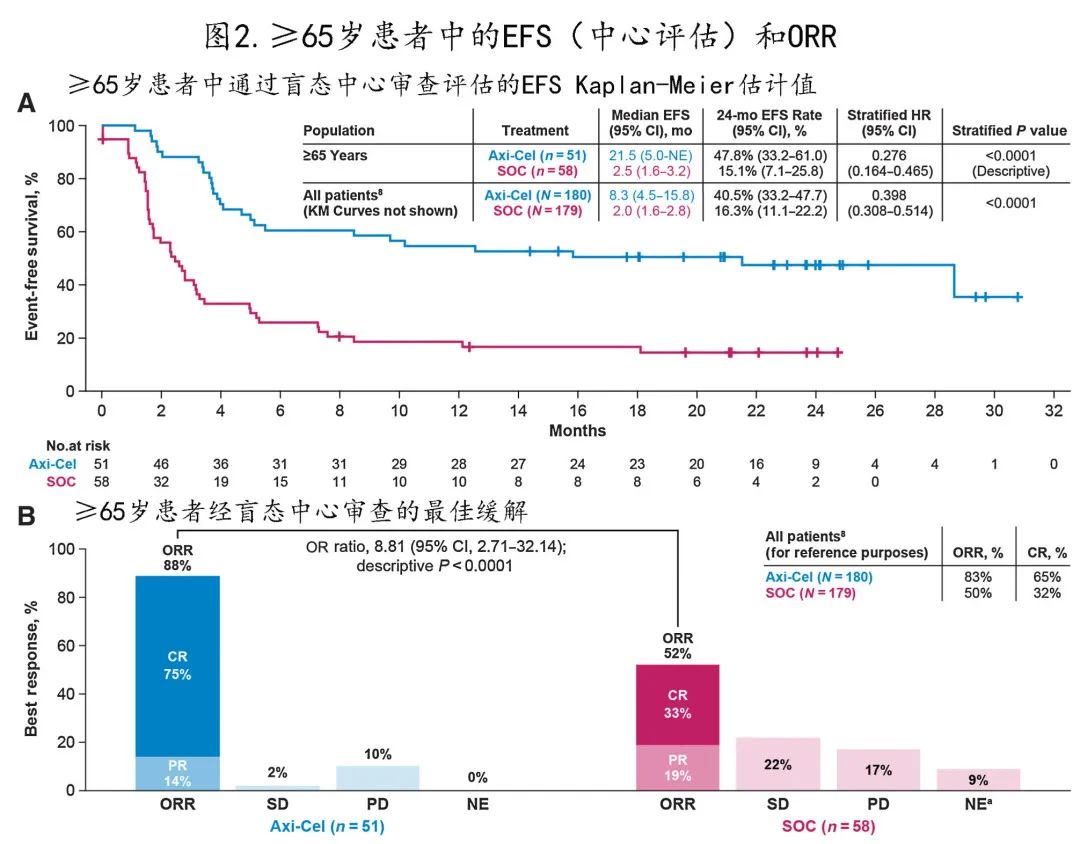
多变量分析显示,校正基线特征差异后,EFS结果与上述相似(HR=0.23;P<0.0001)。在≥65岁的患者中,axi-cel组的 ORR显著高于SOC 组 [88% vs. 52%;OR=8.81;P<0.0001);图2B];≥70岁的患者中同样如此(88% vs.41%;P<0.001)。校正≥65岁患者的基线特征差异后,达到客观缓解的几率仍有利于axi-cel(OR=9.61;P<0.001)。此外在≥65岁的患者中,axi-cel的CR率高于SOC[75% vs. 33%;OR=8.95;P<0.0001],≥70岁患者中也是如此(69% vs. 22%;P<0.01)。
≥65岁患者中作为预先计划的中期分析评估的OS,axi-cel组长于SOC 组(HR=0.517;图3A)。校正基线特征后的多变量分析结果相似(HR=0.40),≥70岁患者结果也相似(HR=0.260)。≥65岁的患者中第2年 OS 的 Kaplan-Meier 估计值,axi-cel组和 SOC 组分别为64%和51%。33例 (57%) SOC 患者接受了市售或研究用 CAR T 细胞治疗(方案外)作为后续治疗,校正 SOC 组后续 CAR T 细胞治疗的敏感性分析也提示 axi-cel 与 SOC 相比具有 OS 获益(HR=0.364)。
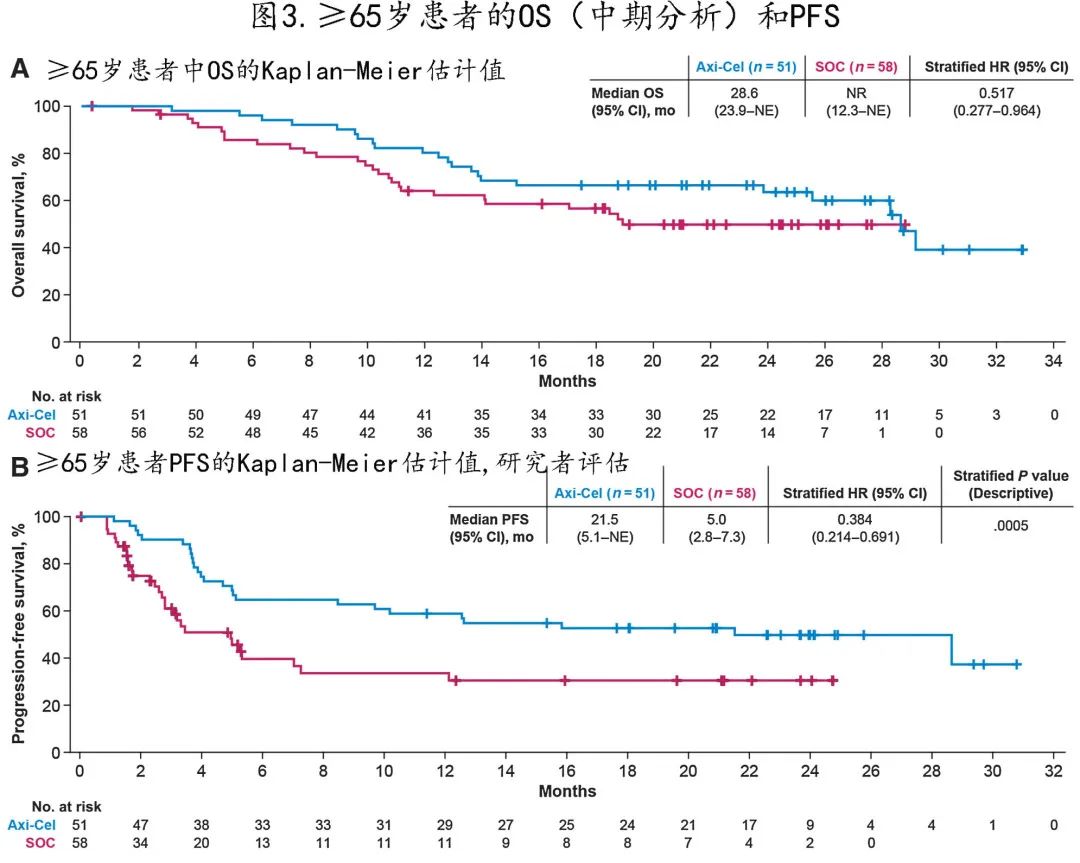
≥65岁的患者中,axi-cel组的中位 PFS 为21.5个月,SOC组为5.0个月(HR=0.384;P=0.0005;图3B)。多变量分析显示,校正基线特征差异后的PFS结果与上述相似(HR=0.31;P<0.002)。axi-cel 组和 SOC 组的2年 PFS 估计值分别为50%和30%;在≥70岁的患者中,中位 PFS 分别为11.4个月和2.7个月(HR=0.206;P<0.001)。
与 SOC 相比,Axi-cel显著改善了≥65岁患者的疗效结局,与总体 ZUMA-7 主要分析人群相当。
安全性
在安全性分析人群(axi-cel 组49例,SOC 组55例)中,所有≥65岁的患者均发生≥1起任何级别AE。axi-cel 组和 SOC 组中≥3级治疗中出现的 AE 的发生率分别为94% (46/49) 和82% (45/55),最常报告的≥3级 AE 为中性粒细胞减少,两组分别为80%和44%(表2)。分别有59%和47%发生严重AE。axi-cel 组49例治疗患者中的6例 (12%) 和SOC组20例治疗患者中的2例 (10%) 在确定性治疗开始后≥90天发生≥3级长期血细胞减少。此外分别有21例和26例患者发生致死性事件,分别有0例和1例(心脏停搏)患者发生5级治疗相关AE。

在≥65岁的患者中,49例 axi-cel 患者中有48例 (98%) 发生CRS,4例 (8%)≥3级(表2)。67%的 axi-cel 患者接受了托珠单抗治疗,29%接受了糖皮质激素治疗,6%接受了血管加压药治疗,用于 CRS 管理。CRS 发作的中位时间为3天,中位持续时间为8天。未发生与 CRS 相关的死亡。
axi-cel 组49例患者中32例 (65%) 和SOC组55例患者中的14例 (25%) 发生神经系统事件(表2),≥3级神经系统事件分别有13例 (27%) 和1例 (2%) 。axi-cel 组45%的患者使用糖皮质激素治疗神经系统事件。axi-cel 组至神经系统事件发生的中位时间为7天,SOC组为26天;中位持续时间分别为9天和39天。第30天时axi-cel组6例患者(意识模糊状态、震颤、嗜睡、精神状态改变、震颤和认知障碍)和 SOC 组5例患者(感觉异常和嗜睡)发生未消退的神经系统事件,第90天时分别有4例患者(震颤、味觉障碍、感觉减退和认知障碍)和4例患者(幻视、嗜睡、谵妄和感觉异常)发生未消退的神经系统事件。死亡时或数据截止时,分别有3例患者(震颤、味觉障碍和感觉减退)和1例患者(感觉异常)发生未消退的神经系统事件。未发生与神经系统事件相关的死亡。
与ZUMA-7研究总体人群相比,≥65岁患者中≥3级 CRS 和≥3级神经系统事件的发生率在数值上更高,但未预先规定或进行正式的统计分析。此外≥65岁患者与<65岁患者相比血清炎症特征升高。在≥65岁的患者中,任何级别和≥3级的 CRS 发生率分别为98%和8%,而ZUMA-7 总体人群中分别为92%和6%。总体人群中任何级别和≥3级神经系统事件的发生率分别为60%和21%,而≥65岁患者中为65%和27%。
患者报告结局
在所有≥65岁的患者中,QoL分析集的基线特征相当。患者报告结局、身体功能、情绪、食欲等评分均有利于axi-cel。

本分析结果表明,在≥65岁的 R/R LBCL 患者中,axi-cel二线治疗的临床获益优于SOC。在 ZUMA-7 中,老年患者的临床结局与总人群相似,axi-cel的临床疗效和 QoL 均优于SOC,且毒性相似且可控。此外,基线时≥65岁和<65岁患者的 CAR-T 细胞扩增和血清炎症特征相当;尽管与<65岁的患者相比,≥65岁的患者在 axi-cel 输注后许多血清炎症和免疫调节分析物升高,但毒性是可控的。在≥65岁的患者中,随机分配至 axi-cel 组的患者接受确定性治疗的比例(96%)几乎是SOC 组(34%)患者的3倍。
总的来说,该分析数据表明,年龄不应禁止考虑对 LBCL 患者进行细胞治疗。既往由于年龄和/或合并症,老年患者通常认为不适合接受根治性移植治疗,因此没有其他治愈性治疗选择。而本分析结果清楚地表明,老年患者可以安全地接受 axi-cel 二线治疗,并且观察到优越的疗效和 QoL 改善(与 SOC 相比),这些数据表明,axi-cel应视为≥65岁 R/R LBCL 患者的二线治疗。
参考文献
Jason R Westin,et al. Safety and Efficacy of Axicabtagene Ciloleucel versus Standard of Care in Patients 65 Years of Age or Older with Relapsed/Refractory Large B-Cell Lymphoma. Clin Cancer Res . 2023 Mar 31;OF1-OF12. doi: 10.1158/1078-0432.CCR-22-3136.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言