BLOOD:del(1p32)是NDMM不良预后,双等位基因删失更是超高危
2022-11-18 聊聊血液 网络
对于多发性骨髓瘤(MM),恶性浆细胞的细胞遗传学异常 (CA) 具有很强的预后影响,已知del(17p) 是最不利的,影响约8%的新诊断多发性骨髓瘤 (NDMM) 患者。
del(1p32)
对于多发性骨髓瘤(MM),恶性浆细胞的细胞遗传学异常 (CA) 具有很强的预后影响,已知del(17p) 是最不利的,影响约8%的新诊断多发性骨髓瘤 (NDMM) 患者。
事实上,del(1p32)在NDMM中的占比也较高(11%),已有研究明确证实其对患者的负面影响。此外,Perrot等2019年发表于JCO的报道证实, del(1p32) 是骨髓瘤中第二大不良异常,不良影响仅次于del(17p),对预后有显著影响。
为了在大样本患者中证实del(1p32) 对NDMM患者队列预后的影响,法国Jill Corre教授等分析了法国骨髓瘤协作组(IFM)的2551例NDMM患者的数据,证实了 del(1p32) 在 MM 中的不利影响,且del(1p32)的拷贝数也很重要。研究结果近日发表于《BLOOD》。

研究结果
作者分析了IFM相关医院2551例 NDMM 患者,患者随访≥36个月或在治疗后36个月内死亡或进展。在基线时采集骨髓样本并进行FISH分析,包括gain(1q)、del(1p32)、del(17p)和t(4;14)。
患者特征见表1。中位随访时间为67.4个月。基于del(1p32) 状态未发现患者之间方案分配有显著差异。
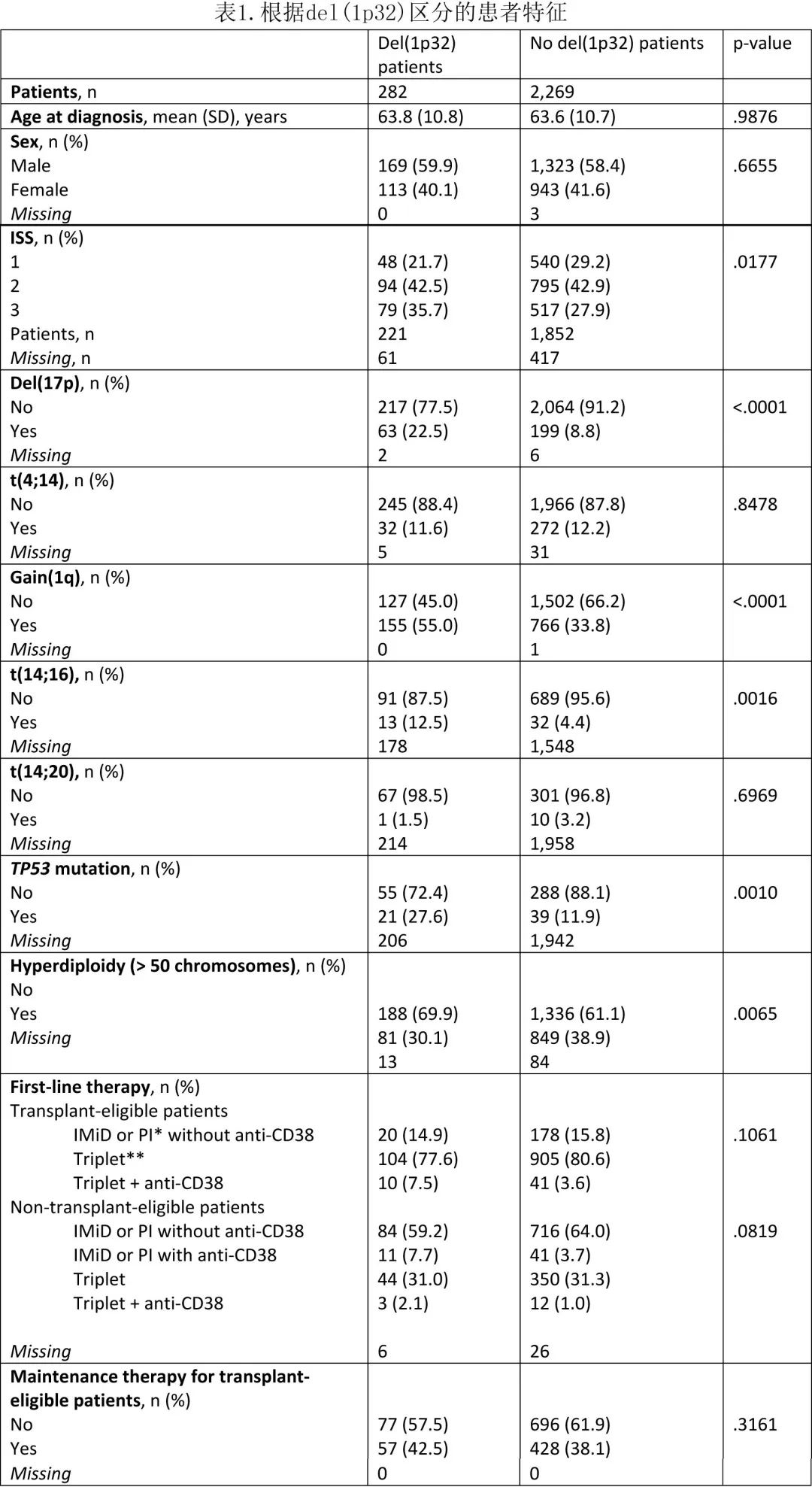
患者中11.1%携带del(1p32),携带 del(1p32) 患者的 OS 显著劣于不携带 del(1p32) 的患者(中位OS分别为49.1个月和123.9个月,p< 0.0001)(图1A),且PFS 也显著缩短(中位PFS分别为17.7个月和29.2个月,p< 0.0001)(图1B)。如果重点关注接受强化治疗(适合移植)的患者(n=1258),也观察到相似的结局(del(1p32) vs.无del(1p32)的中位PFS 24.9 vs. 36.8个月,p< 0.0001;中位OS 66.9 vs. 127.4个月,P= 0.0009)(图 1C 和1D)。
作者随后假设双等位基因 del(1p32) 对预后的影响应高于单等位基因丢失。282例 del(1p32) 患者中281例患者的 1p32 拷贝数可用,作者将其分为“双等位基因del(1p32)”(0个拷贝)和“单等位基因del(1p32)”(1个拷贝)。双等位基因 del(1p32) 患者的 OS 显著短于单等位基因 del(1p32) 患者(中位OS分别为24.6和60.4个月,p< 0.0001)(图2A),PFS 也相似(中位PFS分别为9.6和19.6,P< 0.0001)(图2B)。这些数据显示,1p32的单等位基因缺失仍然对预后有不利影响,即使它比双等位基因缺失的不利影响稍好一些。此外双等位基因和单等位基因 del(1p32) 之间的del(17p) 频率无差异 (27.6% vs. 21.3%,p= 0.49),因此排除了与del(17p)同时存在而可能产生的偏倚。

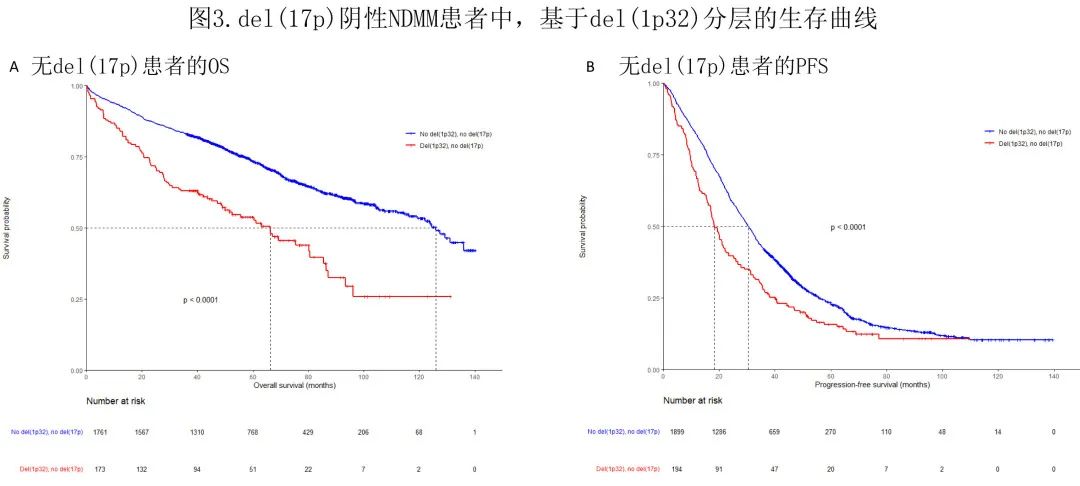
作者接下来回到整个 del(1p32) 队列,发现携带del(1p32) 的患者中25%也携带del(17p),是一般 NDMM 人群的2倍。为了评估生存率低是否来源于这种较高水平的相关性,作者还根据 del(17p) 状态研究了生存率,结果在无 del(17p) 的患者中,结局与整个队列的结果相当:del(1p32) 患者与无 del(1p32) 患者相比,PFS和 OS 均显著降低(中位PFS 18.3 vs. 30.4个月,p< 0.0001;中位OS 66.3个月vs. 126.0个月,P< 0.0001)(图3)。
为评估生存率低是否是由于与已知不良细胞遗传学的相关性水平较高,作者重点关注了无主要高危细胞遗传学异常(HR CA)的 del(1p32) 患者,HR CA 定义为存在del(17p)、t(4;14) 和/或gain(1q)。无 HR CA 的患者携带 del(1p32) 时 PFS 和 OS 仍较低(del(1p32) vs无del(1p32)的中位PFS 23.0 vs. 34.9个月,p= 0.0003;中位OS 80.6 vs.136.1个月,P= 0.0002)。
累积 HR CA 会恶化预后,因此作者又评估了伴额外 HR CA 对 del(1p32) 患者预后的影响。结果当del(1p32)联合其他 HR CA 同时存在时,del(1p32) 患者的中位OS显著降低:单独del(1p32)为80.6个月,合并1个HR CA del(1p32)为42.2个月,合并≥2个HR CA为30.8个月,p= 0.0001)(图4)。

在单变量分析中,携带del(1p32)、del(17p)、gain(1q) 或t(4;14) 的患者的进展风险和死亡风险均增加。同样,在比较 ISS II 期与 ISS I 期和 ISS III 期与 ISS I 期患者时,风险也显著更高。在多变量分析中,del(1p32) 似乎是预后不良的因素。校正年龄和治疗类型后,携带 del(1p32) 的患者进展风险高1.3倍 (p=0.0065),死亡风险高1.9倍 (p< 0.0001)(表2)。

讨论
本研究是伴del(1p32) NDMM患者中的最大样本研究(n=282,高于既往报道的85和34例),证实了del(1p32)的不良影响。本研究也是首次首次对比1p32 位点的双等位基因缺失和单等位基因缺失,表明1p32的双等位基因缺失会显著恶化预后。
本研究也证实了del(1p32)联合多种细胞遗传学异常的累积风险,del(17p)、t(4;14) 和gain(1q) 均会恶化携带 del(1p32) 患者的预后。
多发性骨髓瘤的治疗日新月异,虽然本研究证实了 del(1p32) 在适合移植和不适合患者(多为三联治疗)中的不良影响,但本研究没有足够的数据来探索二代 IMiD 和蛋白酶体抑制剂的影响,也包括CD38 等免疫治疗。
尽管有证据表明其预后不佳,但尚无官方指南推荐在诊断时对 del(1p32) 进行系统评估,且未将其纳入 R2-ISS 或MASS中。
总之,本研究再次证明了在诊断时检测 del(1p32) 的重要性,因为其对预后有巨大影响。此外del(1p32) 拷贝数也很重要,双打击患者的预后显著较差。并且在这个风险分层治疗策略的时代,我们应直视del(1p32)患者令人沮丧的预后,因此主张在诊断时系统地检测 del(1p32) 进行风险评估。
参考文献
Schavgoulidze A, Talbot A,Perrot A,et al. Biallelic deletion of 1p32 defines ultra-high-risk myeloma, but monoallelic del(1p32) remains a strong prognostic factor.Blood . 2022 Nov 14;blood.2022017863. doi: 10.1182/blood.2022017863.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








