中国药品审评审批用时进一步压缩,创新药物审评审批再提速
记者6日从全国药品监管工作座谈会上获悉,我国药品审评审批用时进一步压缩,待审评的药品注册申请已由2015年高峰时的2.2万件降至3200件以内。创新药物和医疗器械审评审批进一步加快,截至今年6月底,共对29批597件药品注册申请进行优先审评审批,审核批准了39个创新医疗器械和4个优先审批医疗器械产品。国家药品监督管理局局长焦红介绍,今年以来,通过持续深化药品医疗器械审评审批制度改革,境外新药上市明
新华社 - 药品,审批,创新 - 2018-07-06
药品注册审评审批效率进一步提升
5月23日,国家药品监督管理局、国家卫生健康委员会联合公布的《关于优化药品注册审评审批有关事宜的公告》(以下简称《公告》),围绕提高创新药上市审批效率、科学简化审批程序,推出一系列重要政策措施。
中国医药报 - 药品注册,审评审批效率 - 2018-05-24
完善审评审批制度 加快急需药品和器械上市速度
国家食药监总局10月9日举行新闻发布会,介绍药品医疗器械审评审批改革鼓励创新工作有关情况,解读相关文件。
央视网 - 医疗器械,药品,CFDA - 2017-10-09
基于《中国医疗机构药品评价与遴选快速指南(第二版)》的口服抗凝药物临床综合评价
通过《指南(第二版)》对OACs进行遴选评价,可为医疗机构药品遴选与科学、合理、安全用药提供依据。
医药导报 - 口服抗凝药物 - 2023-09-22
基于《中国医疗机构药品评价与遴选快速指南(第二版)》的血凝酶类药物临床综合评价
血凝酶类药物整体得分偏低,有替代药品时可优选其他止血药物,其中注射用尖吻蝮蛇血凝酶得分大于60分,在医疗机构中为弱推荐。本研究可为医疗机构血凝酶类药物遴选提供参考,也为临床合理用药提供依据。
医药导报 - 血凝酶类药物 - 2024-05-07
国家药监局:加快罕见病治疗药品审评审批 提高用药供应保障水平
中国国家药品监督管理局29日发布消息称,为鼓励罕见病治疗药品研发,截至2019年5月,已将69件治疗罕见病的药品注册申请纳入优先审评程序。下一步将继续加快罕见病治疗药品的审评审批,提高罕见病用药的供应保障水平。
中国新闻网 - 罕见病治疗药品,审评审批 - 2019-09-30
药品审评审批信息公开办法征求意见:等效性试验数据应公开
1月16日,食药监总局发文公开征求《药品审评审批信息公开管理办法(征求意见稿)》意见,《办法》对药品神评审批受理、过程、结果等多个环节列出了信息公开要点。记者注意到,在受理环节,《办法》规定药审中心在受理药品注册申请后10个工作日内,应按照中药、化学药品和生物制品的分类,向社会公开注册申请品种的受理号、药品名称、受理日期等信息。药审中心还应当定期对药品注册重复申报情况进行统计分析,公开同一品种
澎湃新闻 - 药品,审批,意见 - 2018-01-19
药品注册管理办法修订稿征求意见:设立优先审评审批制度
中办国办日前发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。为贯彻落实,国家食药监总局正组织对《药品注册管理办法》进行修订。10月23日,食药监总局官网发布了总局起草的《药品注册管理办法(修订稿)》,向社会公开征求意见,要求于2017年11月25日前将有关意见以电子邮件形式反馈至国家食品药品监督管理总局(药品化妆品注册管理司
澎湃新闻 - 药品注册管理办法,修订稿,审批 - 2017-10-24
国家药监局关于改革完善放射性药品审评审批管理体系的意见
为满足临床需求,鼓励放射性药品研发,结合药品监管工作实际,提出改革意见。
国家药品监督管理局 - 放射性药品审评审批管理体系 - 2023-05-02
提速上市审评审批、降价入医保、质量严格对标 多举措保障药品供应
只有创新才能研发出更多质量高、疗效优的新药好药,中国在仿制药国际标准化体系建设、药品质量、疗效等方面的工作进一步加强。
人民网-人民日报海外版 - 药品供应,仿制药,审评审批 - 2017-11-21
里程碑意义的文件印发 药品医疗器械审评审批改革深化
10月8日,中共中央办公厅和国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。
人民健康网 - 药品,医疗器械 - 2017-10-09
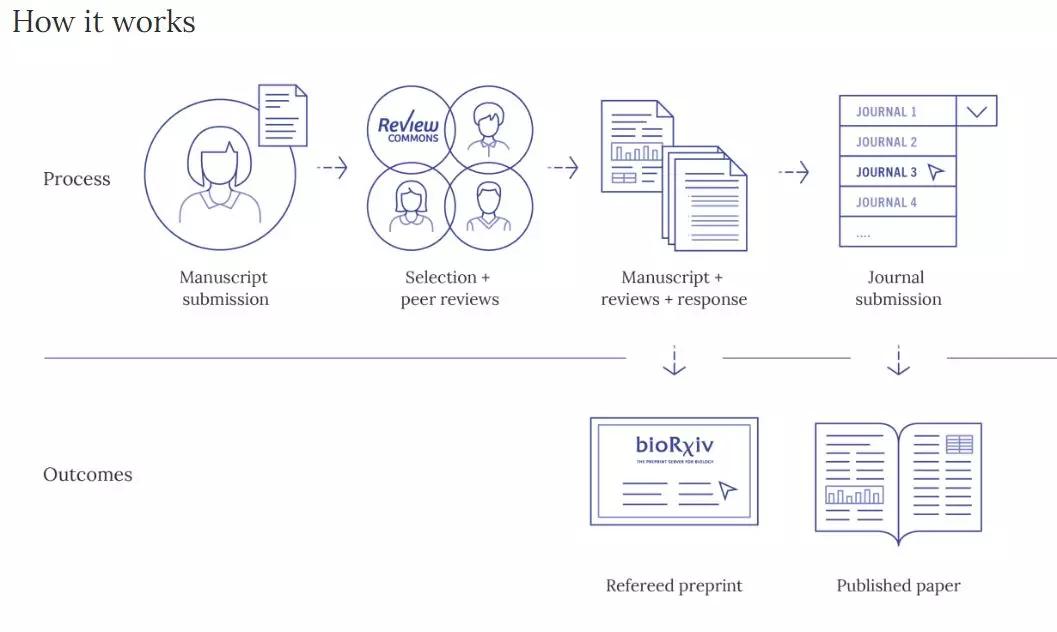
Review Commons:先于期刊同行评审之前的评审
ASAPbio和 EMBO Press于2019年12月9日推出了 Review Commons,这是一个高质量,独立于期刊的,用于对生命科学领域稿件进行同行评审,然后再提交给期刊同行评审平台。作者可以将预印本或未出版的手稿提交给Review Commons进行专家级同行评审。最终的 “ Refered Preprint”(包含稿件,审稿人报告以及作者回复审稿人意见)
网络 - 同行评审,评审 - 2020-02-13
关于进口药品注册审评审批有关事项的公告(征求意见稿)
依据中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),优化审评审批程序,提高进口药品再注册申请审评审批质量与效率,国家食品药品监督管理总局药
NMPA - 进口药品 - 2022-08-09
药品附条件批准上市申请审评审批工作程序(征求意见稿)
为配合新修订《药品注册管理办法》的贯彻实施,我中心组织起草了《药品附条件批准上市申请审评审批工作程序(征求意见稿)》,现在中心网站予以公示
CDE - 新药审评,药品审评 - 2021-06-27
积极应对 我国药品审评审批用时进一步压缩
记者6日从全国药品监管工作座谈会上获悉,我国药品审评审批用时进一步压缩,待审评的药品注册申请已由2015年高峰时的2.2万件降至3200件以内。创新药物和医疗器械审评审批进一步加快,截至今年6月底,共对29批597件药品注册申请进行优先审评审批,审核批准了39个创新医疗器械和4个优先审批医疗器械产品。国家药品监督管理局局长焦红介绍,今年以来,通过持续深化药品医疗器械审评审批制度改革,境外新药上市
新华网 - 药品,审批,审评 - 2018-07-06
为您找到相关结果约500个