【JCO】多发性骨髓瘤的基因组分类和个体化预后
2024-01-17 聊聊血液 聊聊血液 发表于陕西省
近期全基因组、全外显子组和靶向测序相关研究确定了一些复发性和预后性的基因组特征。
NDMM的基因组分类
新诊断多发性骨髓瘤(NDMM)的临床结局存在较大的异质性,总生存期(OS)介于数月到10年以上。基于荧光原位杂交(FISH)的国际分期系统(ISS)经过更新,可以更好地定义NDMM的风险,但它们在临床实践中的应用仍受到多个因素的限制,例如:(1)在同一风险组中,患者之间仍有较大差异;(2)它们可定义具有相似特征的一组患者的进展或死亡的相对风险,但无法用于预测个体患者的结局;(3)未包括治疗因素,从而限制了指导治疗决策的能力;(4)忽略多个与预后相关的基因组和时间依赖性特征。
近期全基因组、全外显子组和靶向测序相关研究确定了一些复发性和预后性的基因组特征,但目前NDMM仍是基于FISH和基因表达谱(GEP)模型进行临床分类,这也反映出开发稳健的聚类(clustering)和分类手段用以纠正不同基因组特征的共现(co-occurrence)状态存在困难。对于多发性骨髓瘤这样的异质性疾病,通过类似的大规模数据整合,或可识别预计将从特定治疗(例如大剂量美法仑联合自体干细胞移植[HDM-ASCT])获益的独特患者群体。
Sylvester 综合癌症中心的Francesco Maura教授牵头开展一项研究,收集了具有临床、人口统计学、基因组学和治疗数据的 NDMM 患者的大型训练集 (N=1933) 和验证集 (N=256),以开发 NDMM 的全面基因组分类,并开发了第一个能够结合异质性临床和基因组信息来预测个体 MM 患者对特定治疗方案反应的个体化预测模型(在线计算器:https://irmma-risk-calculator.miami.edu/)。研究结果近日发表于《Journal of Clinical Oncology》。

研究结果
MM基因组驱动基因景观
NDMM中1727例 (89.3%) 有可用的单核苷酸变异(single nucleotide variants)和插入缺失识别(indel calls),共确定90个假定的驱动基因显著富集非同义突变,其中10个未曾报道过(图1A)。
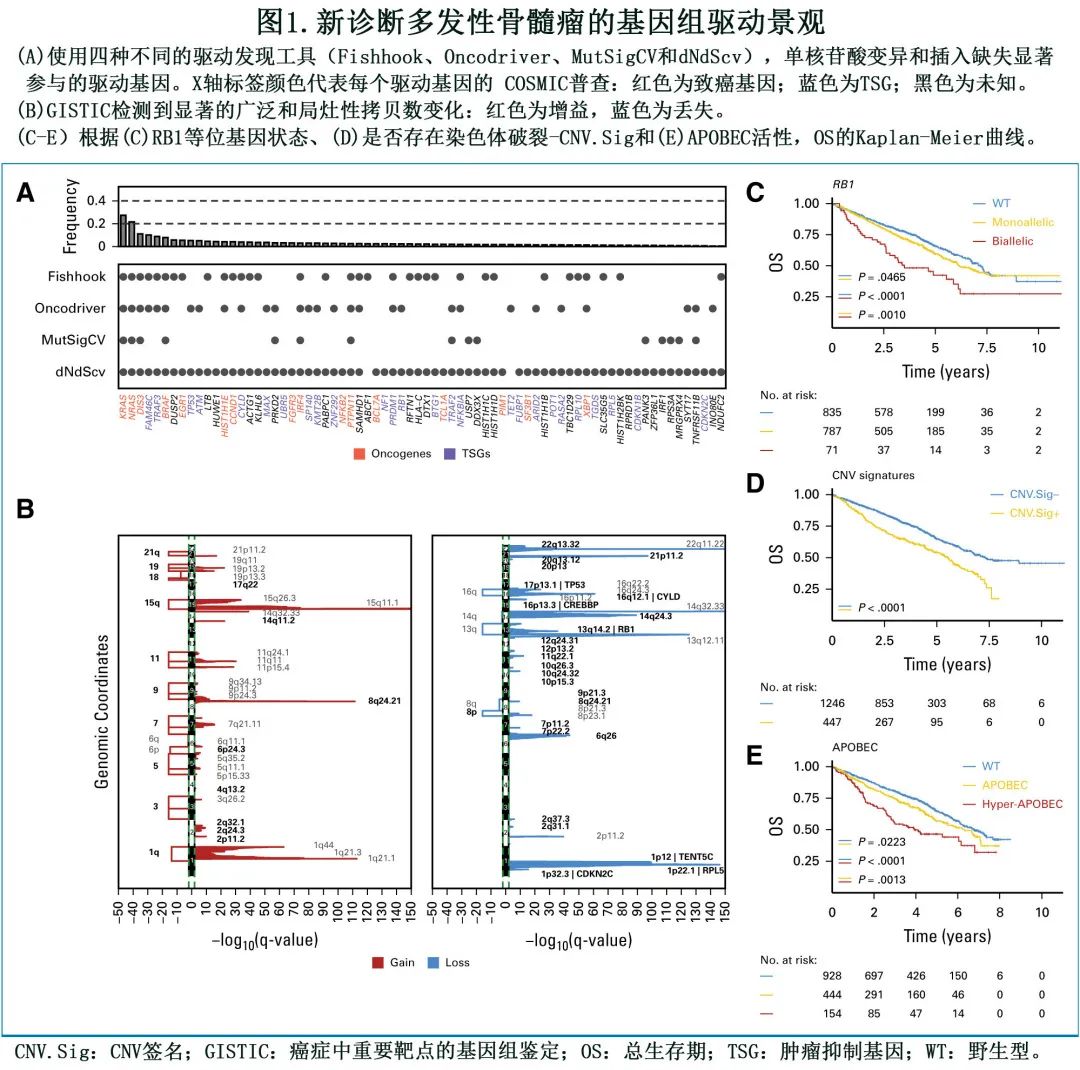
与既往证据一致,最常见的突变驱动基因为KRAS(24.3%)、NRAS(20.1%)、DIS3(9.4%)、TENT5C(8.6%)、BRAF(7.8%) 和TRAF3(6.6%)。79%的患者在90个驱动基因中至少有一个存在至少一个非同义突变。通过拷贝数变异 (CNV) 景观,发现88个位点反复参与CNV:34个局灶性缺失(deletion),5个大片段缺失,30个局灶性增益(gain)和19个大片段增益(图1B)。总体而言, 77.8%的患者存在至少一种复发性非整倍体。53%的患者在奇数染色体上至少有两个大的染色体增益,定义为超二倍体 (hyperdiploid,HRD)。
MM 的 CNV 分析和聚类在历史上一直很困难,因为大的 CNV 往往会影响多个驱动基因和癌症重要靶点的基因组鉴定 (Genomic Identification of Significant Targets in Cancer,GISTIC) 峰值,导致很难识别相关驱动基因和最小缺失/获得染色体区域的独立性。为定义和校正同一染色体内不同 CNV之间的依赖性并避免重复,作者研究了每个 GISTIC 峰,包括CNV 大小和拷贝数(即>3个拷贝数,这里定义为扩增[amplification)])的影响、与其他 GISTIC 峰的关系、对 GEP 的影响和临床结局(图1C)。涉及1q、HRD染色体、8p、16q和 13q 上多个 GISTIC 峰的大型(>5Mb) 和局灶型 (<5Mb)CNV事件,与局灶性相比未显示任何重大差异,因此将这些染色体内的每个局灶性 GISTIC 峰聚集。在染色体 amp 中,只有 1q 显示 CNV 对 GEP 累积效应。总体而言,32个肿瘤抑制基因 (TSG) 在509例 (32.8%) 患者中发生双等位基因失活,双等位基因事件最常复发的是TRAF3(7.9%)、CYLD(4.7%)、TP53(3.7%)、RB1(4.1%)、MAX(3.8%)、TENT5C(3.3%) 和CDKN2C(2.3%)。通过单等位基因和双等位基因丢失定义 TSG 不仅从细胞生物学,也从预后的角度相关。事实上,在这些事件中,与单等位基因事件相比,RB1、TP53和 DNMT3A 的双等位基因缺失与无事件生存期 (EFS) 和总生存期 (OS) 显著缩短相关。
染色体碎裂是一种复杂的结构变异,与 NDMM 预后不良密切相关。为捕获该重要特征,作者使用 CNV 签名,从全外显子测序 (WES) 和靶向测序数据准确预测染色体碎裂的存在。在26.4%的病例中检测到与染色体破裂相关的 CNV 签名,并与较短的 EFS 和 OS 相关(图1D)。
为完成NDMM 基因组分析,作者估计了有 WES 数据的患者 (n=1526;79%) 的 APOBEC 突变签名贡献情况,598例 (39%) 患者有明确的 APOBEC 活性证据,此处定义的前10百分位数(即>11%)为hyper-APOBEC(n=154;10%)。与无 APOBEC 的患者相比,高 APOBEC 患者的结局显著较差(图1E)。
MM基因组分类
尽管已经报告了多种基因组事件和驱动基因共现(co-occurrence)模式,但 MM 分子学分类在过去15年中没有显著变化,仍然依赖于 FISH 和 GEP 数据(即 FISH 易位和细胞周期蛋白 D[TC] 和阿肯色大学医学科学 [UAMS]分类);这主要是由于难以将不同的 MM 基因组驱动因子整合到聚类方法中,以校正MM 中常见的多种共现模式。为解决该历史问题,作者分析了1434例 (74%) 患者,他们具有上述所有基因组驱动因子的可用数据,并实施三种不同手段:(1) 每个单一基因组事件之间的成对分析;(2) 在成对方法中结合基因组事件与强共现模式高级别相互作用(即hierarchical Dirichlet过程); (3) 报告 TSG 为野生型、单等位基因和双等位基因丢失。总体而言,不考虑已建立的免疫球蛋白易位和HRD,还观察到另外两种基因组模式(图2)。
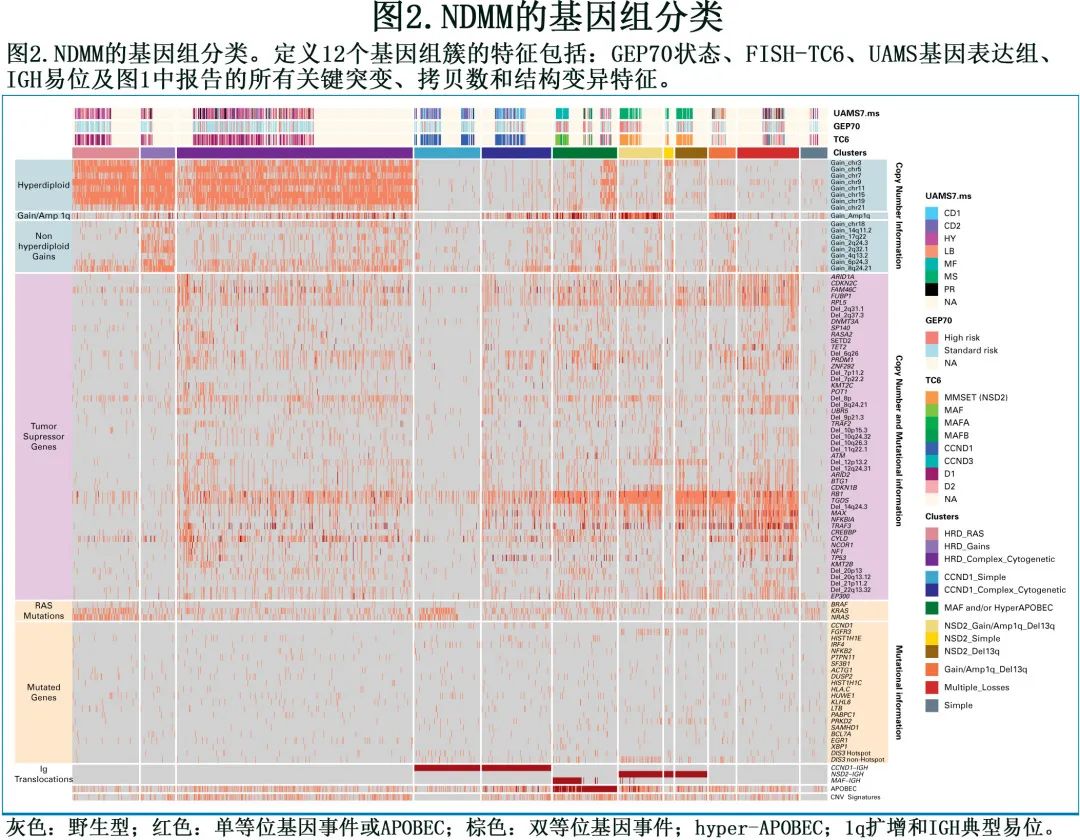
第一个的特征为存在 RAS 通路突变(NRAS、KRAS和BRAF)和复发性非整倍体和双等位基因事件的低比例/缺失;第二个与第一个相互排斥,并且基因组复杂性比例更高,包括共现多个大片段缺失、双等位基因事件、染色体破裂-CNV 签名 (CNV.Sig)、高APOBEC和 1q gain/amp。与其复杂的基因组谱相一致,第二个与第一个相比 OS 缩短(P=0.002)。将这些发现整合到 FISH-TC 分类中,可将 NDMM 分为12个主要的 MM 基因组簇(图2)。将无 Ig 易位的 HRD 病例(既往分配至 D1 和 D2 TC 组)细分为3个基因组;第一个命名为HRD_RAS(9%) ,其特征为HRD、RAS突变和缺乏多个非整倍体的简单基因组,第二个簇 (HRD_Complex;32%) 富集非整倍体和染色体碎裂-CNV.Sig。第三组 (HRD_Gains;4.6%) 包含简单基因组,不存在 RAS 突变,在2、4q、6p、8q和 17q 染色体上存在较大gain。既往 TC1 组包含t(11;14),分为两个CCND1_Complex(9.4%) 和CCND1_Simple(8.9%)。首先,CCND1易位可与多个缺失、1q gain/amp 和染色体破裂-CNV.Sig共现,反映出复杂的基因组谱;而CCND1_Simple要么有 RAS 通路基因 IRF4 的突变,要么有并发的 HRD 谱,而无与基因组复杂性相关的特征。有趣的是,与CCND1_complex相比,CCND1_Simple患者具有更好的生存率 (P=0.028),从而提供了t(11;14) 生物学的更高分辨率,目前一致认为是低危或中危。既往包含t(4;14) 的 TC4 组分为3组:在NSD2_1q_13q(5.9%) 中,t(4;14) 与del13q、1q gain/amp 和 DIS3 的非热点突变(即D479、D488和R780)共现,NSD2_13q(4.3%)有 del13q和t(4;14),但无1q gain/amp,而在NSD2_Simple(1.2%) 中,t(4;14)与 1q gain/amp 或 del13q 均无关,染色体gain大,但基因组复杂性低。
由于 del13q 和 1q gain/amp 同时出现在数据集中的发生率很高,且独立于simple和complex基因组模式,因此创建了一个额外的基因组簇,其携带这两个基因组的驱动因子而无 NSD2 易位 (1q_13q;3.6%)。有趣的是,虽然在基因组学上是不同的,但这四个集群的结局差异。携带 MAF/MAFB 易位的既往 TC5 组显示与高 APOBEC 相关的复杂基因组特征,考虑到其总体基因组特征和临床结局的相似性,将这些患者与无 MAF/MAFB 易位的高 APOBEC 患者合并(MAF_APOBEC;8.7%)。
最后,其余先前归类为 D1 和 D2 而无 HRD 和 Ig 易位的病例分为另外两个簇:一个具有多个非整倍体和染色体碎裂-CNV.Sig (multiple_Losses;8.3%),一个具有低复杂性基因组 (Simple;3.6%)。相关变化也与基于 UAMS GEP 的分类相关,高危增殖 (PR) 组分布于两个复杂组中:HRD_complex(54%) 和Multiple_Losses(14%)。总体而言,这种新的基因组分类可以更好地破译与 TC 和 UAMS 组相比的临床和生物学异质性。
NDMM 的个体化风险 (IRMMa)模型
中位随访43个月,1041例 (53.8%) 患者复发,其中285例 (14.7%) 发生于诱导期(阶段Ⅰ)。总体而言,646例 (33%) 患者死亡,其中483例 (24%) 死于MM。结合临床、人口统计学、基因组和治疗数据,作者开发了 IRMMa 模型来预测 OS 和 EFS 的个体化风险(c指数分别为0.726和0.687;图 3A 和3B)。IRMMa 的准确性显著高于所有现有预后模型:ISS(EFS,0.563;OS,0.61)、R-ISS(EFS,0.539;OS,0.572) 、R2-ISS(EFS,0.563;OS,0.625;图 3C 和3D)。
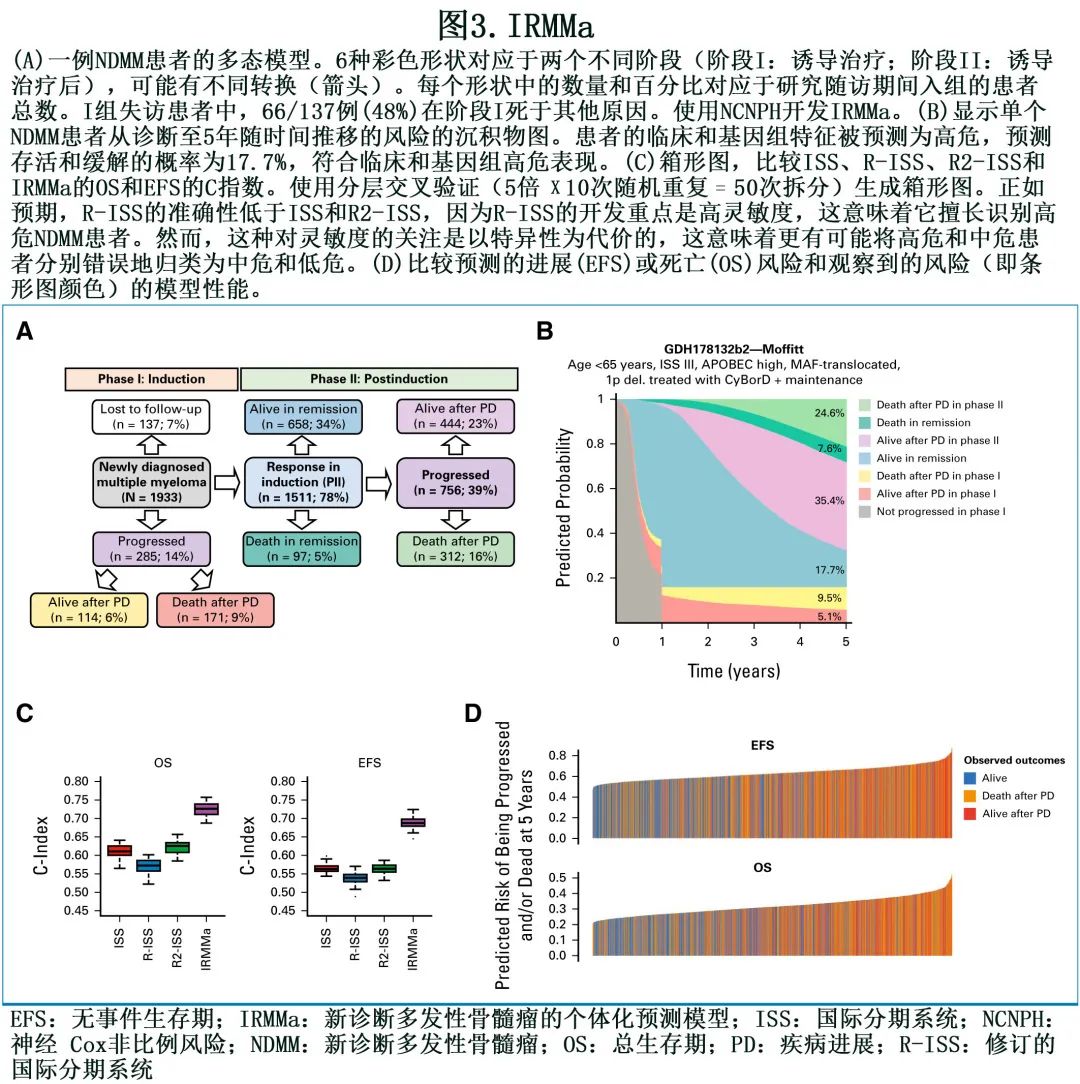
在检测的所有132个基因组特征中,20个可显著提高模型准确性,包括 1q21 gain/amp、TP53丢失、t(4;14;NSD2;IGH)、染色体碎裂-CNV.Sig、hyper-APOBEC和 1p 缺失(图4A)。基因组学在预测诱导期间进展的患者(即难治性NDMM)方面发挥重要作用,并显著提高OS 的准确性。在检测的不同临床特征中,年龄和 ISS 对模型准确性最重要。相比之下,性别、东部肿瘤协作组、人种和乳酸脱氢酶 (LDH) 的影响有限。一线治疗选择是风险的关键决定因素,表明有效治疗可能改变与临床和基因组变量相关的风险,因此可能在个体患者的背景下产生不同的影响。重要的是,由于 IRMMa 为多态模型,可以整合和量化时间依赖性特征的影响,如 HDM-ASCT 和维持/连续治疗。与之前的模型相比,这是一个关键的方法学改进,可纠正和量化两种诱导后治疗的临床影响。与最近的文献一致,HDM-ASCT和维持/连续治疗在阶段II (诱导后)对 EFS 有重大影响,在阶段 II 对 OS 有较小影响(图4A)。总体而言,这些数据证明了纳入基因组和治疗特征在预测 NDMM 患者 OS 和 EFS 中的重要性。作为一个代表性的例子,具有低危基因组特征的患者EFS可能较短,原因在于其特定疾病子集缺乏有效治疗暴露;但同一患者的 OS 可能不受影响,因为有不同和可能更有效的后续治疗的影响。相比之下,具有高危基因组特征的患者通常对大多数治疗耐药,反映为较短的 EFS 和OS。
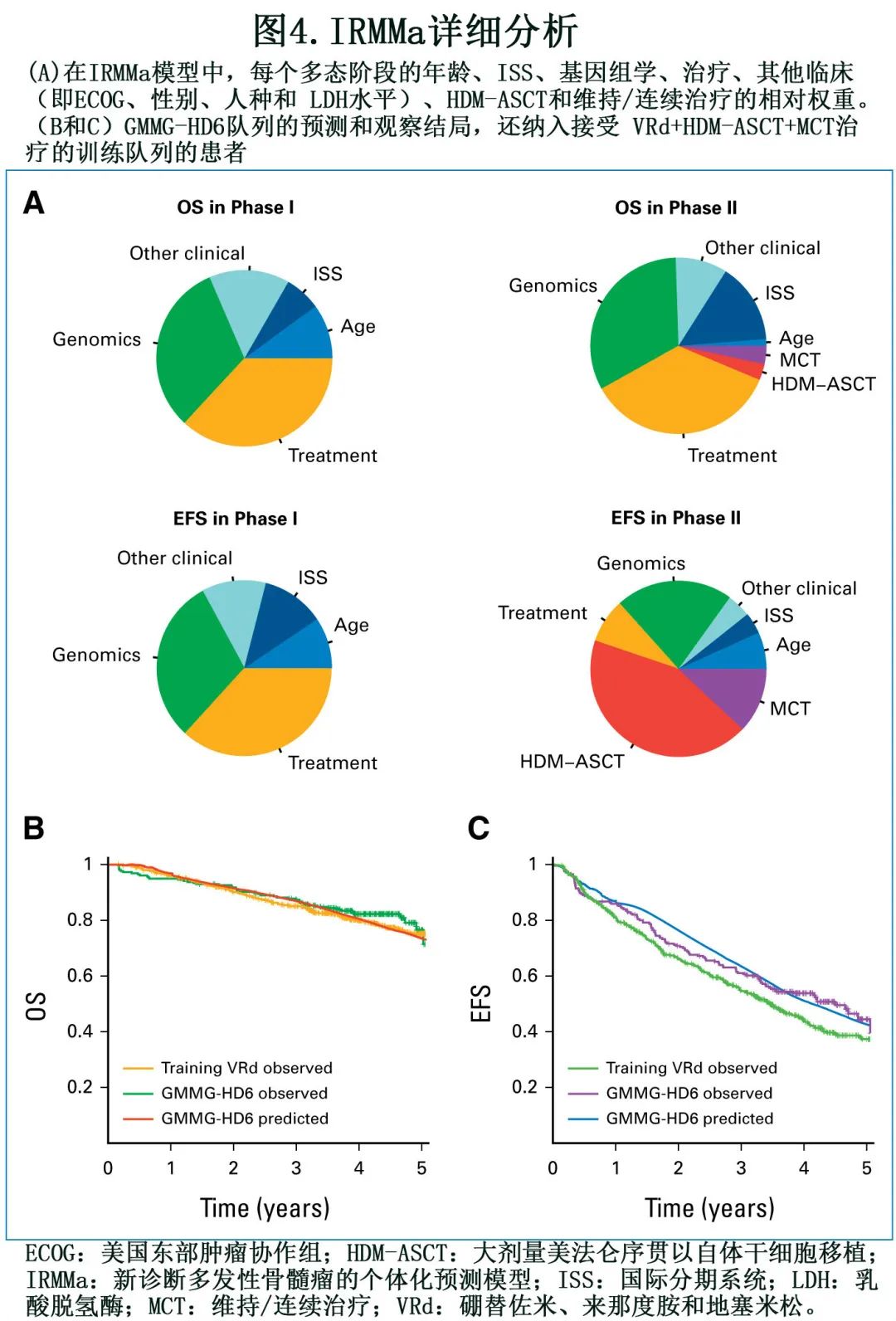
尽管纳入所有特征可改善模型,但 IRMMa 已被开发为一种灵活的工具,能够预测数据不完整的结局。具体而言,由于在目前的 NDMM 临床实践中很少进行基因组谱分析,因此在没有基因组数据的情况下测试了 IRMMa 性能。尽管如此,IRMMa在 OS 和 EFS 方面仍优于ISS、R-ISS和R2-ISS(图3C)
最后,在入组 GMMG-HD6 研究且具有可用基因组数据的256例患者中验证了 IRMMa 模型性能。总体而言,与ISS、R-ISS和 R2-ISS 相比,IRMMa在预测临床结局方面显示出更高的 EFS 和 OS 准确性。此外,为了验证模型的准确性,利用 IRMMa 作为知识库来预测 GMMG-HD6 队列的结局,结果预测风险和观察结局之间高度一致(OS和 EFS c 指数分别为0.65和0.58;图 4B 和4C)。
NDMM的治疗差异
作为与 NDMM 其他预后模型相比的关键创新,IRMMa还允许在校正关键基因组和临床特征后,根据给予的治疗预测每个阶段的风险。具体而言,本研究中基于免疫调节剂 (IMID)、蛋白酶体抑制剂 (PI) 和化疗(例如环磷酰胺、低剂量美法仑、含铂方案)确定了8种诱导策略,以及4种可能的诱导后策略:观察、HDM-ASCT、HDM-ASCT+维持/连续治疗和无 HDM-ASCT 的维持/连续治疗,共32个可能的疗程。在每个可能的疗程中,预测每例患者在5年时无进展和/或死亡的风险(无进展生存期[PFS]),将同一患者疗程之间的 PFS 差异定义为治疗方差(variance)。为在当前治疗背景下评价有意义的模式,作者探索了VRd诱导后 HDM-ASCT 和维持/连续治疗的影响(图5A)。综合所有4种可能的治疗组合(即 VRd ±HDM-ASCT ±维持/连续治疗)的预测结局和治疗方差,确定6个主要簇(clusters)。在簇1(n=554) 中,HDM-ASCT+维持/连续治疗的强化联合治疗可有效将不良结局转换为有利结局(图5B)。在簇2(n=476) 中,患者具有较高的治疗变异性,接受 HDM-ASCT 可显著获益,而接受维持/连续治疗的优势相对较小(图5C)。在簇3(n=717) 中,患者通常年龄小于65岁,ISS低,基因组复杂性低。任何巩固策略均提供优势,而HDM-ASCT和其他维持/连续治疗之间无显著差异(图5D)。其他三簇患者较少,簇4(n = 13) 与有利结局相关,与诱导后策略无关;簇5(n=155) 富集具有高危基因组和临床特征以及不良结局的患者,通过 HDM-ASCT 可部分改善;簇6(n=18) 包括少量具有侵袭性临床和基因组特征且治疗方差有限的患者。入组 GMMGHD6 的患者主要被分配至簇1和簇3,表明即使没有HDM-ASCT,也有部分患者可能具有有利结局。
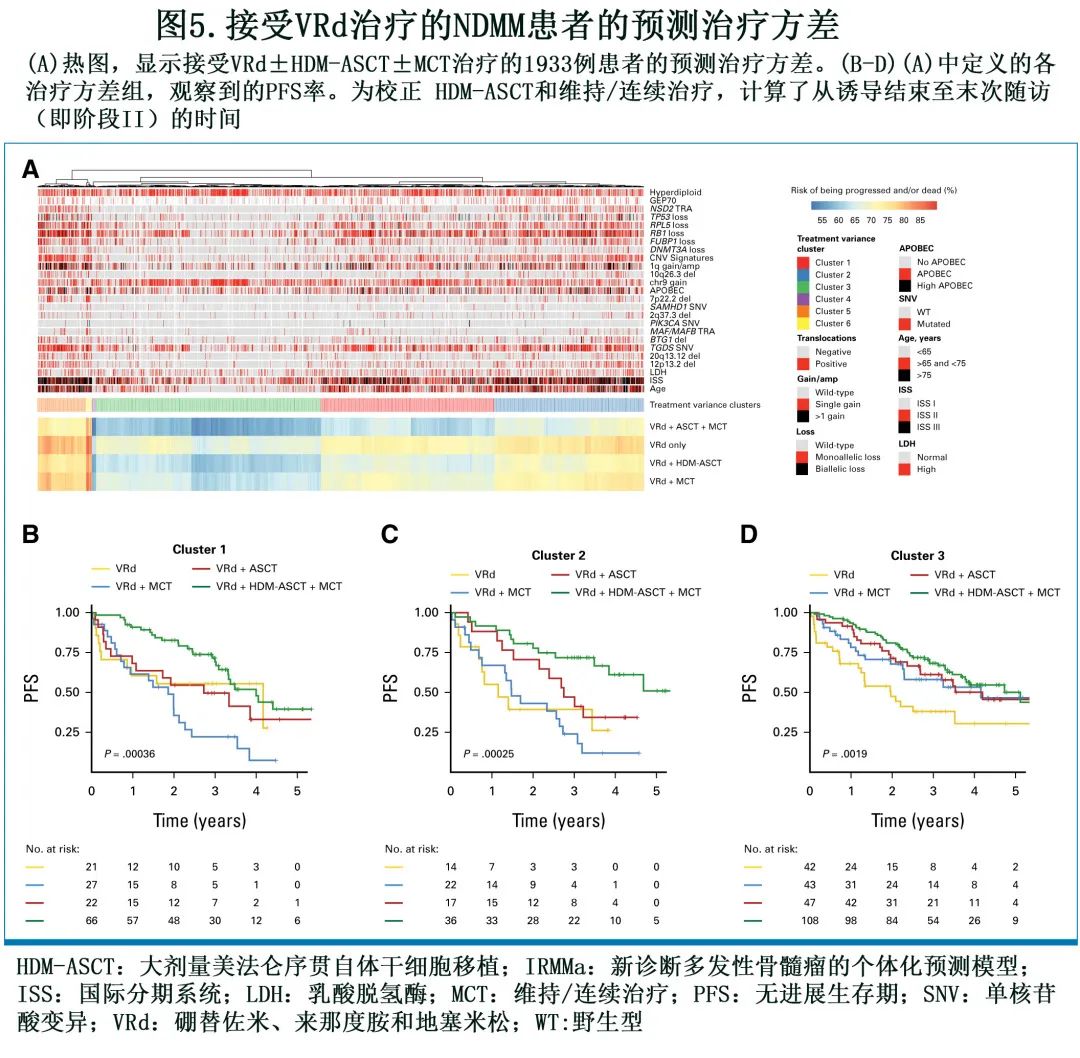
12个基因组之间的治疗方差存在显著差异,每个基因组对不同治疗具有可预测的敏感性(图2)。具体而言,基因组不太complex的组(HRD_RAS、HRD_Gains、CCND1_Simple和Simple)倾向于分组为簇3,表明对 VRd±HDM-ASCT高度敏感。CCND1_Complex、HRD_Complex和 Complex 主要分为簇1和簇3。NSD2_HRD、MAF_APOBEC和1q_13q被分为簇1和簇2。最后,NSD2_1q_del13q和NSD2_13q主要在簇2和簇5中,表明对 HDM-ASCT 强化治疗的潜在敏感性。
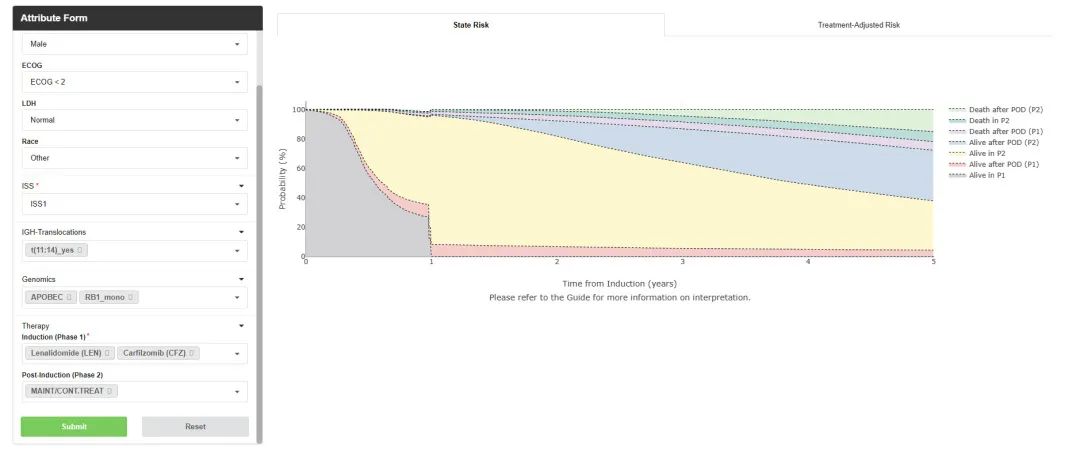
IRMMa 可用于估计 NDMM 的个体化风险和治疗方差,作为研究界的在线工具(IRMMa风险计算器:https://irmma-risk-calculator.miami.edu/,界面如图)。
讨论
本研究中,作者利用 NDMM 患者的大型和多样化数据集来确定关键的基因组驱动因素,并提出更全面的基因组分类,能够更好地捕获定义的分子亚组之间的异质性,从而为更好地破译临床异质性和治疗敏感性创造机会。与其他风险分层研究相比,本研究有三个关键优势:(1) 更大的样本量;(2) 分析工作流程考虑更多的基因组驱动因素、多种混杂因素和共现模式,这在以前的工作中部分忽视;(3) 与既往研究主要关注个体驱动事件不同,该新分类系统强调检查共线的基因组模式(例如complex v simple)。
尽管R-ISS 和R2-ISS等新模型可以确定高危患者的一个亚组,但它们没有针对不同的治疗方法进行校正,也并非为了预测患者水平的个体风险而设计。而本研究将基因组分类中定义的关键特征与临床、人口统计学和治疗数据相结合,是利用深度神经网络开发NDMM 患者结局个体化风险的首个预测模型(即IRMMa)。与既往预后模型相比,IRMMa具有几个关键优势。首先,IRMMa整合基因组特征(这些特征是根据其预后相关性选择的,且是在校正临床、人口统计学和治疗特征后)。纳入20个高度相关的基因组特征可显著提高 IRMMa 识别原发难治性和早期进展患者的能力,并提高 OS 的准确性,证实在 NDMM 预测中需要扩大基因组表征。其次,IRMMa允许估计 NDMM 个体患者的进展或死亡风险,调整治疗和巩固策略。HDM-ASCT 和维持/连续治疗可显著改善EFS,但由于其时间依赖性,在既往预后模型(R-ISS和R2ISS)的开发中从未考虑过。IRMMa 多态设计允许包含这些功能,可提高 EFS 的总体准确性。此外,捕获每个患者特定治疗差异的能力代表着一种关键工具,可以帮助选择最有效的治疗,并避免过度治疗(较少甚至没有益处)。具有相关性的是,IRMMa可识别从 HDM-ASCT 中获益或无获益的患者。几项随机 III 期研究探索了 HDM-ASCT 作为 IMID 和/或 PI 后巩固策略的优势,大多数研究中HDM-ASCT与总体 PFS 优势相关,但与 OS 无关。这些观察结果提出了临床重要问题,即如何为 NDMM 患者提供咨询,尤其是在未来新型有效免疫治疗的时代。最后,IRMMa的实施需要将ISS、年龄和治疗作为强制性特征纳入。因此,即使一致率降低,IRMMa即使在没有基因组数据的情况下也有能力生成估计值,超过R2-ISS、R-ISS和 ISS 的预测准确性,提供在没有全面基因组学的情况下改善预测的机会。
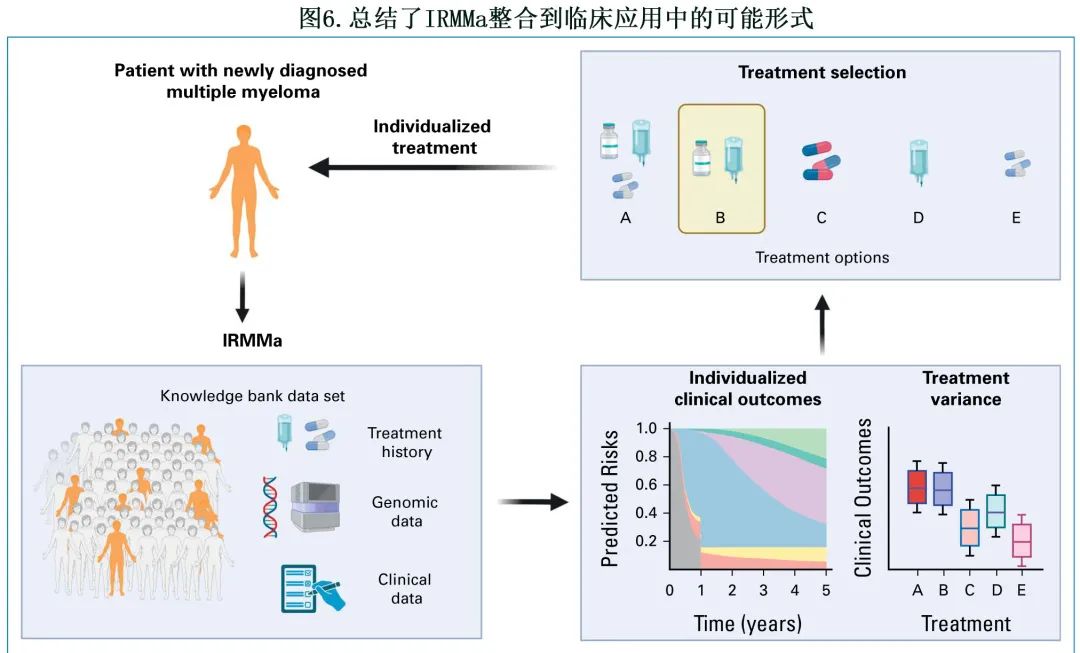
总体而言,IRMMa也还有一些局限性:(1) 训练集中使用的样本量小于用于开发 R-ISS 和 R2-ISS 的样本量;(2)IRMMa是使用单个骨髓部位的基因组数据构建的,不考虑不同解剖部位基因组驱动的潜在影响(即空间异质性);未来骨髓和液体活检方法的整合可能会进一步提高 IRMMa 的性能和分辨率。(3) 最后,当前 IRMMa 模型无法提供新药(例如抗 CD38 抗体)和不同时间依赖性特征(例如微小残留病)的估计值,因为尚未获得足够大队列的数据。然而与其他模型(如R-ISS)相比,IRMMA仍是灵活和知识驱动的模型,可通过整合额外的基因组驱动因子、新型治疗及其对治疗方差的影响,随时间推移而继续发展壮大(图6)。
总之,IRMMa代表着一个创新的机会,可以更好地研究目前过度简化的 NDMM 患者的异质性,以提高对既往和未来临床试验结果的理解。
参考文献
Maura F, et al.Genomic Classification and Individualized Prognosis in Multiple Myeloma.J Clin Oncol . 2024 Jan 9:JCO2301277. doi: 10.1200/JCO.23.01277.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#多发性骨髓瘤# #基因组分类#
24