Nature Communications:杨运桂/杨鹏远/李伟/杨莹合作揭示m5C调控Th17细胞命运及结肠炎发生机制
2023-02-18 “生物世界”公众号 “生物世界”公众号 发表于上海
研究阐明了小鼠CD4+ T细胞中RNA 5-甲基胞嘧啶(m5C)甲基转移酶Nsun2缺失特异性抑制Th17细胞分化,并减轻Th17细胞诱导的结肠炎发生的功能机制,为自身免疫性疾病治疗提供了潜在靶点。
辅助性T细胞17(Th17细胞)是CD4+ T细胞的主要亚群之一,对自身炎症免疫应答至关重要。Th17细胞受其谱系特异性转录因子RoRγt调控,表达和分泌炎症相关细胞因子,如IL-17A和IL-17F等,参与结肠炎、系统性红斑狼疮、硬皮病、银屑病和类风湿性关节炎等自身免疫性疾病。近年来,研究报道DNA甲基化和组蛋白修饰等表观遗传因素参与调控Th17细胞分化过程,然而,RNA甲基化修饰是否调控Th17细胞功能目前仍不清楚。
近日,中国科学院北京基因组研究所(国家生物信息中心)杨运桂、杨莹,中国科学院生物物理研究所杨鹏远和中国科学院动物研究所李伟作为共同通讯作者在 Nature Communications 期刊发表了题为:Nsun2 coupling with RoRγt shapes the fate of Th17 cells and promotes colitis 的研究论文。
该研究阐明了小鼠CD4+ T细胞中RNA 5-甲基胞嘧啶(m5C)甲基转移酶Nsun2缺失特异性抑制Th17细胞分化,并减轻Th17细胞诱导的结肠炎发生的功能机制,为自身免疫性疾病治疗提供了潜在靶点。

在这项研究中,合作团队观察到Nsun2在小鼠胸腺、淋巴结和脾脏等免疫器官,尤其是Th17细胞中的高表达。通过构建T细胞条件性敲除Nsun2小鼠,发现Nsun2缺陷特异性抑制了Th17细胞分化,但不影响其它免疫细胞亚群。Nsun2与Th17细胞关键转录因子RoRγt直接作用,但不影响Th17细胞的染色质开放性和新生RNA生成。
通过进一步机制解析,发现RoRγt募集Nsun2到其靶标基因Th17细胞特异性细胞因子的染色质区域,通过转录偶联催化m5C,其中包括Il17a和Il17f。通过分别在Nsun2缺失的na?ve CD4+ T细胞中进行回补野生型(Nsun2-WT)和m5C催化酶酶活位点突变体(Nsun2-C321A),发现Nsun2介导的m5C修饰调控了Th17细胞的稳态并增强了Il17a和Il17f mRNA的稳定性。
通过构建葡聚糖硫酸钠盐(DSS)诱导和CD4+CD25-CD45RBhi T细胞过继性两种小鼠结肠炎模型,发现Nsun2缺失可减轻Th17细胞诱导的结肠炎进展,并且该表型能够通过回补Nsun2的靶标基因产物IL-17A/IL-17F蛋白逆转。通过在DSS诱导结肠炎的单细胞转录组测序分析,发现Nsun2缺失破坏了Th17细胞与IL-17受体细胞之间的细胞间通讯平衡,抑制了结肠炎的进程。
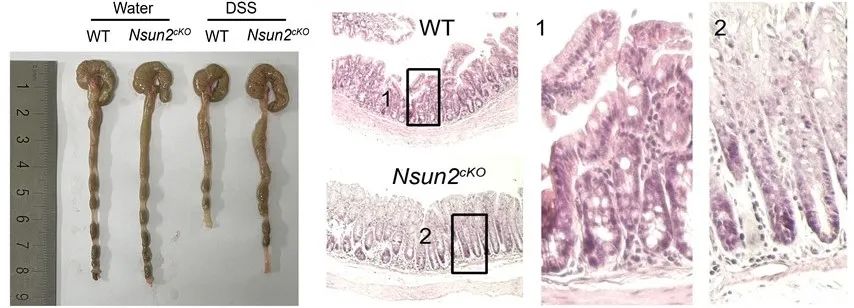
综上所述,这项研究解析了Th17细胞中RoRγt偶联Nsun2,特异性催化Th17细胞关键细胞因子转录本上m5C修饰的形成,促进其靶基因mRNA的稳定性,为Th17细胞诱导的肠炎等自身免疫疾病机制提供研究线索。
原始出处:
Yang, WL., Qiu, W., Zhang, T. et al. Nsun2 coupling with RoRγt shapes the fate of Th17 cells and promotes colitis. Nat Commun 14, 863 (2023). https://doi.org/10.1038/s41467-023-36595-w.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













