[摘要] 背景与目的:
胃癌同时性肝转移(gastric cancer with synchronous liver metastases,GCLM)患者是否接受肝切除仍存在争议。本研究通过分析GCLM患者的临床病理学特征及治疗方式,探究其与患者预后的关系,希望为该病的临床治疗及预后评价提供参考依据。方法:回顾性分析2006年3月—2018年8月复旦大学附属肿瘤医院收治的经术后病理学检查诊断为胃腺癌,影像学检查提示伴有肝转移的患者资料,包括性别、年龄、原发灶大小、部位、浸润深度、淋巴结转移、分化程度、肝转移灶大小、分布、数目、治疗方法及甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)等肿瘤标志物水平,并进行随访。采用Kaplan-Meier生存曲线分析患者的总生存期(overall survival,OS),用log-rank检验进行单因素分析,COX回归模型进行多因素分析,探究影响GCLM患者生存的独立预后因素,通过亚组分析筛选最佳的肝切除对象。结果:79例纳入本研究的GCLM患者的中位发病年龄为63岁,男女比例为5.58∶1.00。中位OS为11个月,1、3和5年OS率分别为46.0%、23.3%和6.9%。单因素分析结果显示,影响OS的因素包括胃原发灶大小、分化程度、肝转移灶的分布、确诊时血清AFP水平及肝切除。多因素分析结果显示,影响OS的独立危险因素为双叶肝转移(HR=37.253,P=0.008),保护因素为肝切除(HR=0.149,P = 0.044)。进一步亚组分析显示,对转移灶最大直径 ≤3 cm、单发肝转移灶、单叶转移、确诊时血清AFP及CEA水平正常者,肝切除有可能改善其OS。结论:回顾性研究表明肝切除有可能改善部分GCLM患者的预后。
在全球范围内,胃癌是癌症相关死亡的主要原因之一[1]。因为缺乏特异性的症状,许多患者在初诊时已是晚期[2-4]。肝脏是胃癌最常见的远处转移部位,美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐了许多替代疗法及多学科治疗方案,包括系统性化疗、肝动脉化疗栓塞、射频消融、分子靶向治疗、支持治疗及其他姑息治疗。最近一些证据表明,对胃癌和肝转移同时进行R0切除能够提高胃癌同时性肝转移(gastric cancer with synchronous liver metastases,GCLM)患者的生存率[5-6]。目前,对GCLM患者是否进行肝切除仍存在争议[7],因为GCLM患者都有其各自的临床病理学特点,存在其他远处转移、广泛淋巴结转移、双侧多发转移或严重内科合并症的GCLM患者不适合肝切除[8]。因此,筛选最佳的肝切除对象尤为关键。本研究回顾性分析79例GCLM患者的临床病理学资料,探讨影响预后的因素及肝切除的疗效,旨在为GCLM的治疗模式探索提供参考。
1 资料和方法
1.1 一般资料
收集复旦大学附属肿瘤医院2006年3月—2018年8月收治的GCLM患者的临床资料并进行分析。纳入标准:① 病理学检查确诊为胃腺癌,经影像学或病理学检查证实为肝转移;② 临床诊疗记录及后续随访资料完整。排除标准:① 胃癌除肝转移外还伴有其他脏器转移,如肺、卵巢、腹膜转移(纳入的患者均在术中或探查后发现无腹膜转移);② 患有其他部位原发性肿瘤;③ 其他病理学类型的胃癌(图1)。
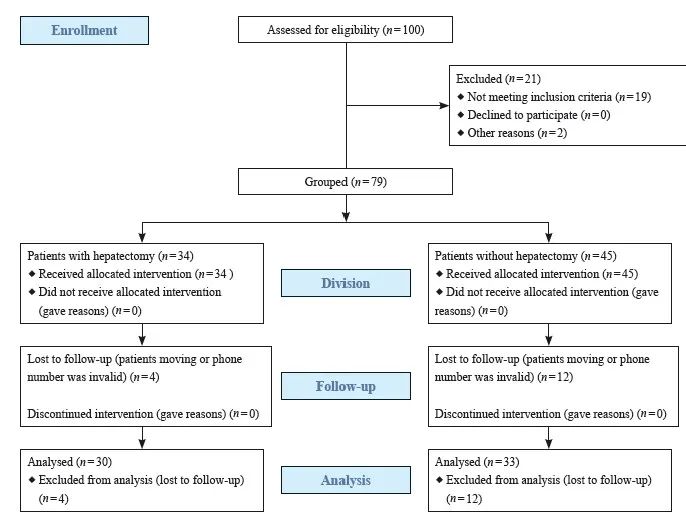
图1 研究设计及患者筛选流程图
Fig. 1 The flow chart of study design and patient inclusion
1.2 观察指标和治疗情况
观察指标包括性别、年龄、胃癌原发灶大小及部位、分化程度、淋巴结转移、浸润深度、肝转移灶大小及分布、是否肝切除等。术后TNM分期参照美国癌症联合会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union for International Cancer Control,UICC)胃癌第8版TNM分期标准。79例GCLM患者中,胃切除联合肝切除者34例(43%),单纯胃切除者22例(28%),开腹探查者23例(29%)。参照NCCN胃癌临床实践指南(2022年第2版),患者术后均根据其身体情况行化疗、肝动脉化疗栓塞、射频消融或分子靶向治疗等综合治疗,小部分患者行新辅助化疗,化疗方案以铂类药物、5-氟尿嘧啶及紫杉类药物为主。
1.3 随访
通过术后定期复查、电话或短信的方式随访,随访起始时间定义为首次诊断为胃癌同时性肝转移的时间,随访时间截至2020年9月或患者死亡。
1.4 统计学处理
所有数据采用SPSS 25.0软件进行统计分析,采用log-rank检验进行生存分析,Kaplan-Meier法进行单因素分析,COX比例风险回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 临床病理学特征
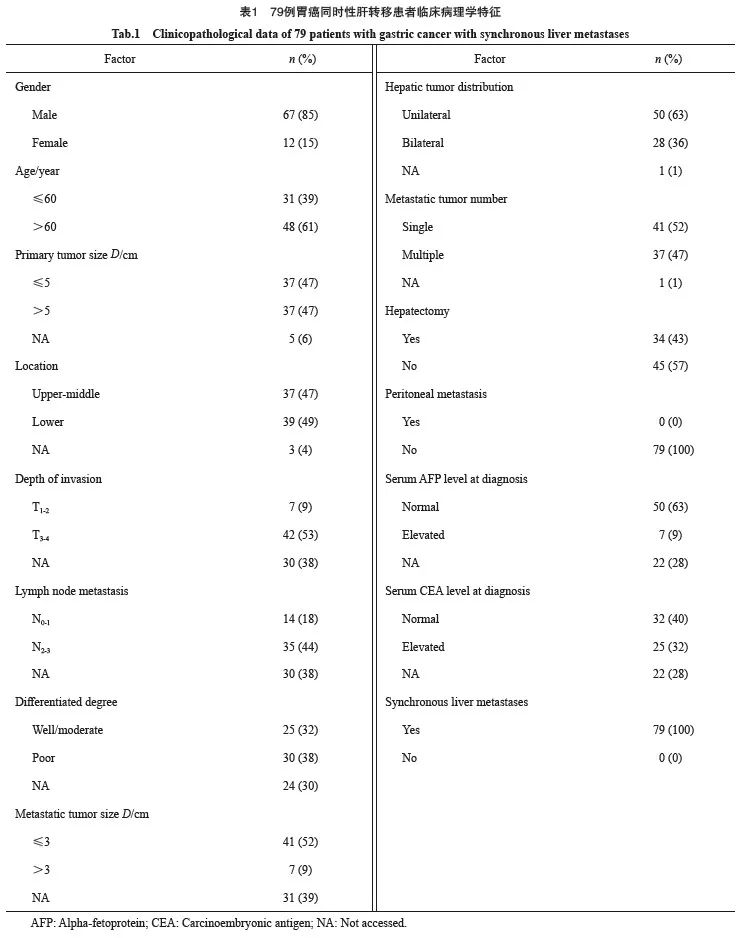
成功纳入的患者共79例,男性67例(85%),女性12例(15%)。中位发病年龄为63(42~79)岁,其中≤60岁的为31例(39%),>60岁的为48例(61%)。肝切除患者34例(43%),未行肝切除患者45例(57%)。所有患者均为同时性肝转移,无腹膜转移。患者的临床病理学特征见表1。
2.2 GCLM患者预后相关因素分析
79例GCLM患者中位总生存期(overall survival,OS)为11个月,1、3和5年OS率分别为46.0%、23.3%和6.9%。单因素分析显示,影响预后的因素包括原发灶大小(P=0.046)、分化程度(P=0.001)、肝转移灶的分布(P=0.038)、确诊时血清甲胎蛋白(alpha fetoprotein,AFP)水平(P<0.001)及肝切除(P<0.001),而年龄、性别、原发灶的部位、浸润深度、淋巴结转移、肝转移灶的大小和数目以及确诊时血清癌胚抗原(carcinoembryonic antigen,CEA)水平与GCLM患者预后无关(P>0.05)。多因素分析显示,肝转移灶的分布(HR=37.253,P=0.008)及肝切除(HR=0.149,P=0.044)是影响GCLM患者OS的独立预后因素(表2,图2)。
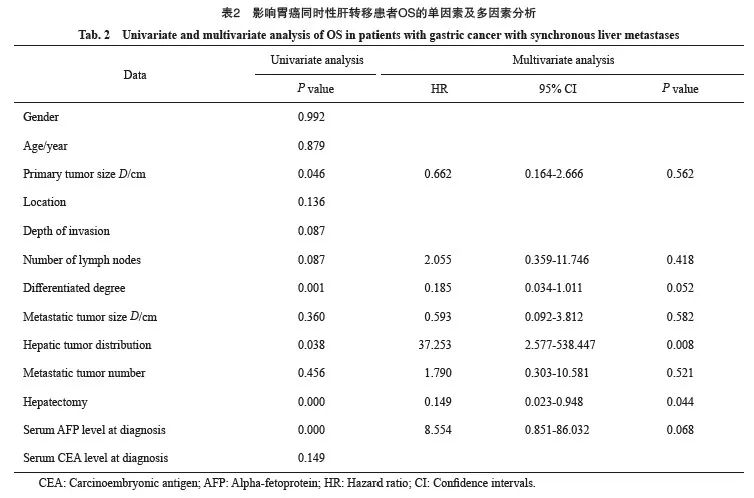
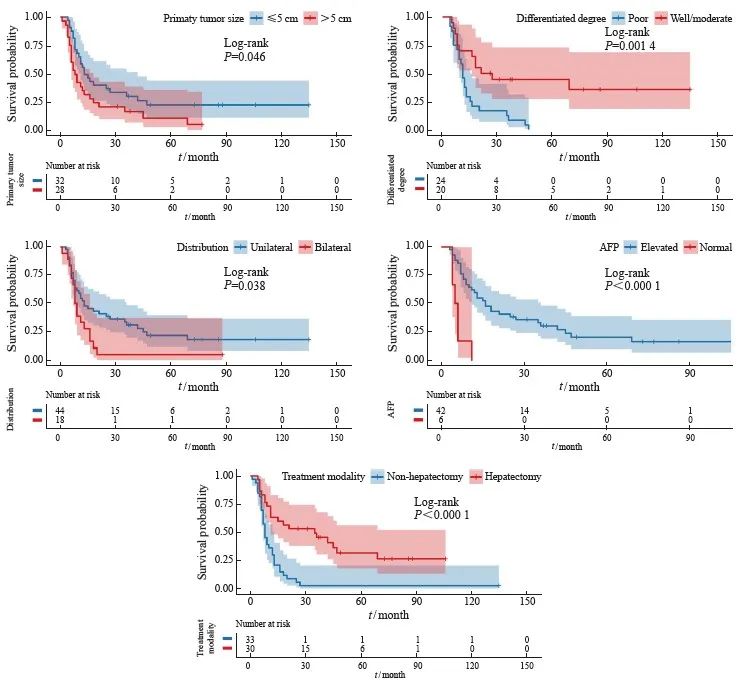
图2 部分预后变量的生存曲线
Fig. 2 Survival curves for several prognostic variables
2.3 肝切除对GCLM患者预后的影响
根据是否行肝切除将79例患者分为两组,肝切除组34例和非肝切除组45例。肝切除组与非肝切除组患者1、3及5年OS率分别为63.3%、45.7%、32.0%和30.3%、9.1%、3.0%,两组患者中位OS分别为35和 8个月。亚组分析结果显示,转移灶的最大直径≤3 cm、单发肝转移灶、单叶转移、确诊时血清AFP及CEA水平正常的亚组,肝切除有可能改善其OS(图3)。
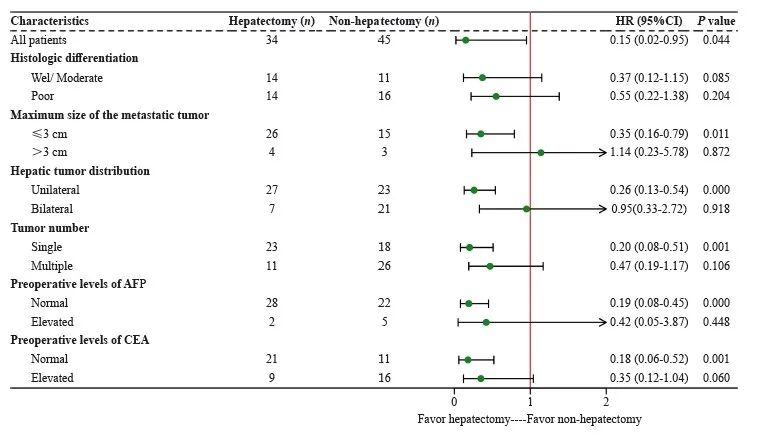
图3 79例胃癌同时性肝转移患者预后的亚组分析
Fig. 3 Overall survival by subgroup analysis of 79 patients with gastric cancer with synchronous liver metastases
3 讨 论
随着胃镜筛查的普及和治疗手段的发展,胃癌患者的预后有了显著改善。胃癌同时性肝转移发生率为2.0%~9.6%,低于结直肠癌。胃癌肝转移目前有手术、姑息化疗、射频消融等治疗方法,但大多数患者的治疗效果并不理想。REGATTA试验结果表明,与单纯化疗相比,姑息性切除加化疗并不能提高Ⅳ期胃癌患者的OS率,这让人质疑手术在转移性胃癌中的价值[9]。鉴于新出现的证据证明肝转移灶切除对少数转移性胃癌患者有益[4,10-13],我们对胃癌同时性肝转移患者进行了回顾性分析。
研究[5-6]表明,胃癌同时性肝转移患者接受肝切除后的OS率显著提高。本研究34例GCLM患者同时行根治性胃切除和肝切除,中位生存时间为35个月,1、3及5年的OS率分别为63.3%、 45.7%和32.0%。多因素分析发现,肝切除及肝转移灶的部位是GCLM患者的独立预后因素。值得注意的是,目前的研究结果应该考虑到它的局限性。在本研究中,我们仅根据患者是否行肝切除分为肝切除组和非肝切除组,未考虑新辅助化疗或胃切除等混杂因素对研究结果的影响。
由于肝切除并不适用于所有的GCLM患者,因此,患者筛选在GCLM治疗中尤为关键。由于缺乏胃癌肝转移手术治疗的随机对照临床研究,目前还没有明确的患者选择标准。我们的亚组分析结果显示,单个肝转移灶、肝转移灶直径≤ 3 cm及单叶分布的患者更适合行肝切除。Ochiai等[14]报道,在没有原发胃癌浆膜侵犯的患者中,应该尝试肝切除。就肝转移病灶的数量和大小而言,文献[15-16]报道,孤立转移或直径<3 cm的肝转移瘤患者可能会有更好的OS率。有研究[17]推荐对单发肝转移伴原发灶淋巴结转移分期N0或N1期的患者行肝切除治疗。在本研究中,由于T1或T2、N0或N1期的样本量过小,未对该因素进行亚组分析。当然,行同步肝切除的患者,必须原发灶可切除、无肝外转移以及具有良好的器官功能储备[18]。总的来说,在考虑行同步肝切除时,原发肿瘤侵犯浆膜或较高的原发肿瘤N分期、肝转移灶多发或直径≥3 cm和不能R0切除可能是非肝切除的选择标准[15,19-21]。
肝转移灶的局部治疗方式还包括射频消融(radiofrequency ablation,RFA),用于治疗因肿瘤数量、位置或大小等因素限制而无法切除的肝转移灶。存在以下情况时不推荐RFA,一种是远端胆道梗阻,导致胆管内压力过高,增加病灶胆汁渗漏风险。其次,靠近肝包膜的病变,特别是位于膈下间隙的病变,因为这些患者在RFA治疗后很可能发生腹腔出血。此外,位于尾状叶及胆囊或肝血管附近(距离小于10 mm)的肿瘤也不适合做RFA[22]。对于多发肝转移瘤,可考虑RFA联合肝切除。
在本研究中,小部分患者行术前化疗,我们未就术前化疗进一步探究其对GCLM患者预后的影响。专家共识[23]建议,对于Ⅰ型胃癌肝转移(live metastasis from gastric cancer,LMGC),可预先同时切除或术前化疗后同时切除, Ⅰ型LMGC是指仅限于技术上可切除的1~3个肝转移瘤,其最大直径不超过4 cm,或位于单侧肝脏而不累及主要血管或胆管的LMGC。根据一项国际调查,对于同时患有LMGC的患者,欧洲更常推荐术前化疗,而在日本,前期手术是首选方法[24]。目前,由于缺乏比较研究,术前化疗的真正益处还不清楚。术前化疗最重要的优势似乎是更好地选择患者[8],因为化疗应答者的无进展生存(progression-free survival,PFS)率高于无应答的患者[25]。除化疗外,近期有研究[26]表明,免疫治疗对胃癌肝转移患者也有一定的 疗效。
这是一项回顾性研究,部分患者临床病理学资料不够完整,可能对研究结果造成影响。此外,样本量相对较小也局限了本次研究结果,目前发表的大多数相关研究也只有少量的病例,这既反映了本研究相对严格的纳入标准,也反映了接受肝切除的患者数量较少。因此,我们应当谨慎看待研究结果。为了克服这些局限性,需要未来开展多中心研究,或更好的随机对照临床研究,评估积极的手术方法对这些患者预后的影响。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] FERLAY J, STELIAROVA-FOUCHER E, LORTETTIEULENT J, et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012[J]. Eur J Cancer, 2013, 49(6): 1374-1403.
[3] SHAH M A, KELSEN D P. Gastric cancer: a primer on the epidemiology and biology of the disease and an overview of the medical management of advanced disease[J]. J Natl Compr Canc Netw, 2010, 8(4): 437-447.
[4] CONDE MONROY D, IBAÑEZ-PINILLA M, SABOGAL J C, et al. Survival outcomes of hepatectomy in gastric cancer liver metastasis: a systematic review and meta-analysis[J]. J Clin Med, 2023, 12(2): 704.
[5] GARANCINI M, UGGERI F, DEGRATE L, et al. Surgical treatment of liver metastases of gastric cancer: is local treatment in a systemic disease worthwhile? [J]. HPB (Oxford), 2012, 14(3): 209-215.
[6] MIKI Y, FUJITANI K, HIRAO M, et al. Significance of surgical treatment of liver metastases from gastric cancer[J]. Anticancer Res, 2012, 32(2): 665-670.
[7] ROMANO F, GARANCINI M, UGGERI F, et al. Surgical treatment of liver metastases of gastric cancer: state of the art[J]. World J Surg Oncol, 2012, 10: 157.
[8] CHEN L, SONG M Q, LIN H Z, et al. Chemotherapy and rep for gastric cancer with synchronous liver metastases[J]. World J Gastroenterol, 2013, 19(13): 2097-2103.
[9] FUJITANI K, YANG H K, MIZUSAWA J, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial[J]. Lancet Oncol, 2016, 17(3): 309-318.
[10] GRANIERI S, ALTOMARE M, BRUNO F, et al. Surgical treatment of gastric cancer liver metastases: systematic review and meta-analysis of long-term outcomes and prognostic factors[J]. Crit Rev Oncol Hematol, 2021, 163: 103313.
[11] MINCIUNA C E, TUDOR S, MICU A, et al. Safety and efficacy of simultaneous rep of gastric carcinoma and synchronous liver metastasis-a western center experience[J]. Medicina (Kaunas), 2022, 58(12): 1802.
[12] YAMAGUCHI T, TAKASHIMA A, NAGASHIMA K, et al. Evaluating the efficacy of post-operative chemotherapy after curative rep of stage Ⅳ gastric cancer with synchronous oligo metastasis: a multicenter retrospective study[J]. Gastric Cancer, 2023, 26(2): 307-316.
[13] CUI J K, LIU M, SHANG X K. Hepatectomy for liver metastasis of gastric cancer: a meta-analysis[J]. Surg Innov, 2019, 26(6): 692-697.
[14] OCHIAI T, SASAKO M, MIZUNO S, et al. Hepatic rep for metastatic tumours from gastric cancer: analysis of prognostic factors[J]. Br J Surg, 1994, 81(8): 1175-1178.
[15] MARTE G, TUFO A, STECCANELLA F, et al. Efficacy of surgery for the treatment of gastric cancer liver metastases: a systematic review of the literature and meta-analysis of prognostic factors[J]. J Clin Med, 2021, 10(5): 1141.
[16] OHKURA Y, SHINOHARA H, HARUTA S, et al. Hepatectomy offers superior survival compared with non-surgical treatment for≤3 metastatic tumors with diameters < 3 cm from gastric cancer: a retrospective study[J]. World J Surg, 2015, 39(11): 2757-2763.
[17] OKI E, TOKUNAGA S, EMI Y, et al. Surgical treatment of liver metastasis of gastric cancer: a retrospective multicenter cohort study (KSCC1302)[J]. Gastric Cancer, 2016, 19(3): 968-976.
[18] WANG Y N, SHEN K T, LING J Q, et al. Prognostic analysis of combined curative rep of the stomach and liver lesions in 30 gastric cancer patients with synchronous liver metastases[J]. BMC Surg, 2012, 12: 20.
[19] KINOSHITA T, KINOSHITA T, SAIURA A, et al. Multicentre analysis of long-term outcome after surgical rep for gastric cancer liver metastases[J]. Br J Surg, 2015, 102(1): 102-107.
[20] TIBERIO G A, MINISTRINI S, GARDINI A, et al. Factors influencing survival after hepatectomy for metastases from gastric cancer[J]. Eur J Surg Oncol, 2016, 42(8): 1229- 1235.
[21] UGGERI F, RIPAMONTI L, PINOTTI E, et al. Is there a role for treatment-oriented surgery in liver metastases from gastric cancer? [J]. World J Clin Oncol, 2020, 11(7): 477-494.
[22] CHEN J, TANG Z, DONG X, et al. Radiofrequency ablation for liver metastasis from gastric cancer[J]. Eur J Surg Oncol, 2013, 39(7): 701-706.
[23] ZHANG K C, CHEN L. Chinese consensus on the diagnosis and treatment of gastric cancer with liver metastases[J]. Ther Adv Med Oncol, 2020, 12: 1758835920904803.
[24] KATAOKA K, KINOSHITA T, MOEHLER M, et al. Current management of liver metastases from gastric cancer: what is common practice? New challenge of EORTC and JCOG[J]. Gastric Cancer, 2017, 20(5): 904-912.
[25] VIGANÒ L, VELLONE M, FERRERO A, et al. Liver rep for gastric cancer metastases[J]. Hepato-gastroenterology, 2013, 60(123): 557-562.
[26] YUKAMI H, KAWAZOE A, LIN Y T, et al. Updated efficacy outcomes of anti-PD-1 antibodies plus multikinase inhibitors for patients with advanced gastric cancer with or without liver metastases in clinical trials[J]. Clin Cancer Res, 2022, 28(16): 3480-3488.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言