【专家述评】| 2022年度胃癌研究和诊疗新进展
2023-07-18 中国癌症杂志 中国癌症杂志 发表于上海
本文对2022年度胃癌研究进展进行总结,为更深入开展临床转化研究及临床实践的方案制订提供新的思路和建议。
[摘要] 胃癌是中国高发的消化道恶性肿瘤之一,5年相对生存率在40%左右,具有早诊率低、肿瘤负荷大、异质性强和患者预后差等特点。近20年,多学科团队诊疗模式、个体化精准决策成为公认的有效提升胃癌综合治疗效果的措施。在抗肿瘤药物治疗方面,已逐渐从“千人一方”的简单循证模式逐渐过渡到“精准免疫治疗”模式。2022年,胃癌的基础、临床和转化研究领域均取得了若干进展,覆盖分子机制探索、诊断技术及治疗策略等,其中尤以临床转化、精准医疗和免疫治疗等为研究热点。靶向药物的研究主要聚焦在为数不多的热门靶点(如CLDN18.2、FGFR2b)。免疫治疗领域国产程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂逐渐崭露头角(RATIONALE 305研究),且更关注毒性的降低(Moonlight研究)及治疗新模式的探索(靶向治疗联合免疫治疗如LEAP-015临床研究、免疫治疗联合放疗如Neo-PLANET临床研究)。本文对2022年度胃癌研究进展进行总结,为更深入开展临床转化研究及临床实践的方案制订提供新的思路和建议。
[关键词] 胃癌;发病机制;基础研究;靶向治疗;免疫治疗
[Key words] Gastric cancer; Pathogenesis; Basic research; Targeted therapy; Immunotherapy
2020年全球胃癌确诊病例超过100万,死亡病例达76.8万,为全球第五大常见癌症和第四大癌症死亡原因[1]。尽管近年来胃癌发病率和死亡率均有所下降,但胃癌仍是造成全球癌症负担的重要因素。就抗肿瘤药物研发和应用而言,历经传统化疗时代、分子靶向治疗时代,再到现在的免疫治疗时代,与肺癌、乳腺癌、结直肠癌等肿瘤相比,胃癌领域的发展可谓举步维艰。本文对2022年度胃癌研究领域的重要进展进行总结。
1、病因研究
流行病学、临床和基础研究结果证实,胃癌发病相关的风险因素主要包括遗传易感性因素和外界环境因素[2]。根据Lauren分型,可将胃癌分为肠型、弥漫型和混合型。通常认为弥漫型胃癌与遗传易感因素显著相关,而肠型胃癌与幽门螺杆菌(Helicobacter Pylori,HP)感染及人们的生活方式密切相关。
在遗传性弥漫型胃癌(hereditary diffuse gastric cancer,HDGC)研究领域,Garcia-Pelaez等[3]报道,其遗传易感因素归咎于CDH1基因和CTNNA1基因的胚系致病性或可能致病性突变,而APC基因启动子1B单核苷酸变异则与胃腺癌和胃近端息肉病(gastric adenocarcinoma and proximal polyposis of the stomach,GAPPS)显著相关。
家族性肠型胃癌(familial intestinal gastric cancer,FIGC)目前尚缺乏足够的研究,其遗传易感基因仍不清楚。Carneiro[4]通过遗传性胃癌患者家族谱系分析,发现在16个肿瘤风险综合征(tumor risk syndromes,TRS)相关基因中含有28个导致HDGC或FIGC的致病性或可能致病性突变,这些突变多数与DNA损伤修复相关,其中PALB2和BRCA2分别是有HDGC和FIGC家族史患者最常突变的基因。Yan等[5]的纳入4项中国人群胃癌发病风险研究的meta分析采用全基因组关联分析(genome-wide association study,GWAS),报道了1q22、5p13.1、10q23.33、3q11.2和4q28.1这5个与中国人群胃癌发病风险显著相关的新位点,并探索了5p13.1和10q23.33位点变异导致胃癌发病风险增高的分子机制。
除上述遗传变异外,某些表观遗传学改变同样与胃癌的发病风险相关[6]。肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)计划从基因突变特征、DNA甲基化及通路相关性3个维度,将胃癌分为4种分子亚型:EBV阳性型、微卫星不稳定(microsatellite instability,MSI)型、基因组稳定(genome stability,GS)型和染色体不稳定(chromosomal instability,CIN)型。多项研究[7-9]发现,MSI型胃癌(占全部胃癌22%)主要源自错配修复基因MLH1启动子的过度甲基化,仅有不到10%的MSI型胃癌源自错配修复基因缺失的遗传变异。在GS型胃癌患者中,表观遗传学变异被认为是造成癌基因和抑癌基因功能失衡的主要原因。
作为重要的消化器官,胃癌的发病风险与人们的饮食偏好及烟酒摄入间的关系一直备受关注。Zhang等[10]对215例中国城市胃癌人群和645例匹配的健康对照人群进行分析,发现吸烟、饮酒、胃病病史和一级亲属胃癌病史等因素,与胃癌发病风险增加显著相关。Deng等[11]的meta分析通过汇总多项研究结果(68项病例对照研究、13项队列研究)发现,饮酒可显著增加胃癌发病风险(OR=1.20,95% CI:1.12~1.27),饮酒量越大,胃癌发病风险 越高。
在HP感染导致胃癌风险的机制探索中, Raza等[12]报道,携带CagA基因的HP感染会严重影响胃黏膜上皮细胞DNA损伤修复相关蛋白ERCC1和PMS2表达,为揭示HP感染诱导胃癌的发生机制提供了重要线索。HP还可通过磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K) /蛋白激酶B(protein kinase,AKT)、Janus激酶/信号转导和转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)、Ras、Raf和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和细胞毒素相关基因A、空泡细胞毒素A等毒力因子激活细胞信号转导通路,调控胃癌细胞增殖[13]。
2、基础研究
2.1 多组学研究
基因组、转录组、蛋白质组、代谢组、单细胞测序及空间转录组学技术的整合发展,使实现不同组学数据互通,整合多维度、多组学数据以深入探究胃癌发生、发展和转移等恶性表型成为可能。Yuan等[14]收集了112例胃癌患者血液标本进行代谢组学分析,整合了TCGA中胃癌转录组学数据、癌症蛋白质组图谱(The Cancer Proteome Atlas,TCPA)中胃癌蛋白质组学数据并进行分析,将胃癌分为4种亚型:静止亚型(quiescent),糖酵解/糖原异生亚型(glycolysis/gluconeogenes,GG),丙氨酸、天冬氨酸及谷氨酸亚型(lanine, aspartate and glutamate,AAG)和混合亚型(mixed),其中GG亚型患者中ERBB2基因表达量较低且预后最差,GG亚型和混合亚型患者对化疗相对敏感,而静止亚型和AAG亚型患者更可能从免疫治疗中获益。Guo等[15]根据不同肿瘤免疫微环境特征,基于免疫评分(immune score)为1~3,将TCGA和高通量基因表达数据库(Gene Expression Omnibus,GEO)中的胃癌患者分为三类,进一步分析发现免疫评分最高的IS3组患者预后最优,且该组患者具有更高的T细胞免疫细胞活性评分、干扰素(interferon,IFN)γ评分及较高的免疫相关基因表达。北京大学肿瘤医院[16]利用多组学技术分析接受新辅助治疗的胃癌患者血液外泌体中RNA及非编码RNA表达,发现治疗有效组与无效组中RNA及非编码RNA存在明显差异,通过Lasso回归分析方法筛选出6个因子(let-7i-5p、miR-1307-3p、LZIC、SRSF6、lncFTH1-211和lncPTMA-209)构建了新辅助治疗效果预测模型。但该模型是否可在临床中推广应用还有待更多的证据来支撑。
2.2 腹膜转移
腹膜是胃癌最常见的转移部位,腹膜转移也是胃癌患者预后不良的重要危险因素[17]。Li 等[18]报道,血清胱抑素1(cystatin1,CST1)能通过调控GPX4蛋白稳定性抑制铁死亡,促进胃癌腹膜转移。Al-Marzouki等[19]发现来自胃癌患者癌性腹水中的巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)能促进胃癌细胞与人腹膜间皮细胞发生黏附,进而导致胃癌细胞发生腹膜转移。使用靶向MIF或VEGF的抑制剂能有效地阻断两者之间的黏附作用。MIF或VEGF有望成为治疗胃癌腹膜转移的新靶点。有研究[20]报道了发生和未发生腹膜转移患者胃癌细胞差异基因中代谢相关基因表达情况,通过COX回归分析筛选出与胃癌患者无病生存期(disease-free survival,DFS)相关的代谢相关基因,选取8个代谢相关基因(CNPY3、TF、ANGPT2、GSR、VKORC1、LRP12、FGF19和SLC30A7)构建腹膜转移复发预测模型。Takahashi等[21]收集分析122例胃癌患者腹水,发现发生腹膜转移的胃癌腹水中淋巴细胞和巨噬细胞发生明显变化,表现为CD8+ T细胞、CD3+ CD56+ 自然杀伤(natural killer,NK)T细胞样细胞和 CD3-CD56+ NK细胞与CD45+ 粒细胞比例明显降低,CD14+ 巨噬细胞显著增多。
2.3 肿瘤微环境
胃癌肿瘤微环境由肿瘤细胞及其周边的成纤维细胞、间皮细胞、T细胞、中性粒细胞、NK细胞等免疫细胞,以及细胞外基质成分共同构成,前者可改造微环境中的细胞,促进其形成适宜肿瘤细胞定植生存的环境,而后者又可进一步增强肿瘤细胞的恶性表型,彼此形成正反馈环路[22]。肿瘤相关成纤维细胞(cancer associated fibroblasts,CAF)在胃癌肿瘤微环境中的作用受到广泛关注,有研究[23-24]报道CAF通过分泌各种基质金属蛋白酶(matrix metalloproteinase,MMP)、转化生长因子-β(transforming growth factor-β,TGF-β)、肝细胞生长因子(hepatocyte growth factor,HGF)及VEGF等,促进胃癌细胞增殖、血管新生、侵袭、迁移及化疗耐药。维生素D3类似物可逆转CAF释放白细胞介素(interleukin,IL)-8(CXCL8)激活胃癌细胞中PI3K/AKT信号转导通路而导致的奥沙利铂耐药[24]。CAF中TEM1、VCAM1、MUC1、 KLF5、POSTN、LOXL2、BRP2、RHBDF2及SAA1等高表达,均与胃癌患者不良预后密切相关[25-26]。此外,CAF还可通过释放FGF9、CXCL12及重塑细胞外微环境,调节免疫细胞功能或是直接与免疫细胞成分相互作用,促进胃癌发生、发展[26-27]。肿瘤相关中性粒细胞(tumor-associated neutrophil,TAN)广泛存在于实体瘤中,N2型TAN可促进胃癌增殖、转移和血管形成[28]。中性粒细胞胞外陷阱(neutrophils extracellular trap,NET)会导致胃癌患者高凝状态,增加深静脉血栓形成风险[29-30],且NET可促进血管内皮细胞的血管新生以及诱导血管内皮细胞和胃癌细胞中ANGPT2蛋白表达升高,后者表达量升高可能与胃癌患者免疫治疗效果较好密切相关[30]。
3、临床研究
3.1 早诊早筛
胃镜检查和取活组织行病理学检查是目前确诊胃癌的金标准,但操作成本高、有创、高龄老人及体力衰弱者耐受性差,因此在临床实践中寻找一种有效的检查方法显得尤为重要。HP感染是胃癌发生、发展的独立危险因素。Hao等[31]通过分析HP感染与胃癌患者血清胃蛋白酶原(pepsinogen,PG)Ⅰ、PGⅡ、胃蛋白酶原Ⅰ 与Ⅱ比值(pepsinogen ratio,PGO)、IL-6、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)之间的相关性,发现IL-6、IL-18和TNF-α参与从HP阳性胃黏膜炎症发病到发展的全过程,对胃癌的诊断有重要价值,也有助于监测胃癌进程和预后。
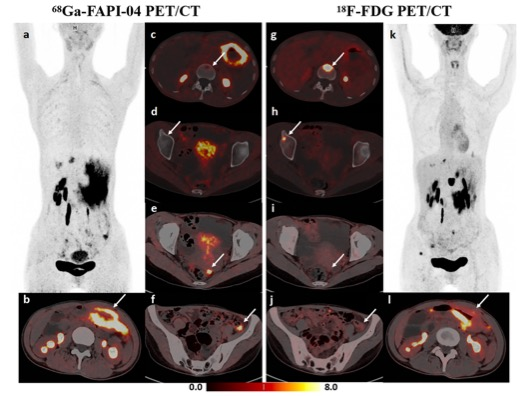
在功能影像学技术方面,68镓标记的成纤维细胞活化蛋白抑制剂(68Ga labeled fibroblast activating protein inhibitor,68Ga-FAPI)是一种新兴的有前途的肿瘤示踪剂。Qin等[32]在121例胃肠道肿瘤患者中对比了68Ga-FAPI、增强CT及18F-FDG 正电子发射断层显像(positron emission tomography,PET)的有效性,结果显示,68Ga-FAPI PET的诊断准确率远高于CT和18F-FDG PET(95.0%、65.1%和69.0%,P<0.001)。
内镜下黏膜剥离术(endoscopic submucosal disp,ESD)是目前部分早期胃癌患者的标准治疗手段,但在临床实践中,超声内镜(endoscopic ultrasound,EUS)有时很难区分T1a和T1b,而两者的治疗手段截然不同。黏膜下生理盐水注射(submucosal saline injection,SSI)是超声传输的有效介质和回声增强剂,可很好地区分黏膜层和黏膜下层[33-35]。Park等[36]对比EUS-SSI与EUS在区分T1a和T1b方面的准确率,结果显示,EUS-SSI诊断T1a和T1b的有效率分别为92%和60%,均较EUS提高了1倍。
3.2 手术
根治性手术切除是目前胃癌实现根治的唯一有效方式。胃癌的手术方式包括开腹和微创(腹腔镜、机器人等)。近期,JAMA Surgery发表了中国学者开展的CLASS-01的5年随访数据[37],两组的5年总生存(overall survival,OS)率分别为72.6%和76.3%,不同肿瘤分期的组间总体OS率差异也无统计学意义。但该研究是在高手术量中心、远端进展期胃癌患者中开展的,因此这一结果还不能代表全国的真实情况,同时也不能简单地推广到全胃切除手术中。日本的一项单中心回顾性队列研究[38]比较了机器人全胃切除(robot total gastrectomy,RTG)和腹腔镜全胃切除(laparoscopic total gastrectomy,LTG)的临床差异,发现RTG组在手术后住院时间、淋巴结清扫数目、术后总体并发症及腹腔感染等方面,均明显优于LTG组。
网膜囊切除能否预防胃癌腹膜转移,在胃癌根治术中长期存在争议。JCOG1001研究[39]是一项Ⅲ期临床试验,入组患者为组织学确诊为胃腺癌,临床评估侵及浆膜下层(cT3)或浆膜层(cT4a)者。在患者入组完成后启动第二次中期分析,发现保留网膜囊和切除网膜囊患者的3年OS率分别为86.0%和83.3%(HR=1.075)。最终分析支持网膜囊切除的预测概率只有12.7%。基于数据和安全监测委员会的建议,上述结果直接导致研究提前终止。近期公布的5年随访数据[40]显示,网膜囊切除组的腹腔脓肿发生率明显高于单纯网膜切除术组(5.5% vs 2.5%,P=0.008)。两组5年OS率分别为74.9%和76.5%,而网膜囊切除并未降低腹膜复发的比例(12.3% vs 12.3%)。
在保留脏器功能、维持胃切除术后患者生活质量方面,近期公布的一项韩国Ⅲ期随机对照研究[41],比较了腹腔镜前哨淋巴结导航手术(laparoscopic sentinel lymph node navigation surgery ,LSNNS)和腹腔镜标准胃切除术(laparoscopic standard gastrectomy,LSG)在术后并发症、长期生存和生活质量(quality of life,QOL)等方面的差异,结果显示,两组在3年DFS率和术后并发症等方面差异无统计学意义,但LSNNS在生理功能改善、临床症状及营养状态等方面明显优于LSG。
随着生活质量的提高和生活方式的改变,目前很多胃癌患者属超重人群,较高的BMI增加了腹腔镜手术的难度。韩国开展了一项双盲、平行对照、随机、Ⅲ期临床研究[42],入组体重指数(body mass index,BMI)≥25 kg/m2的Ⅰ和Ⅱ期胃癌患者,随机接受深度或中度的深层神经肌肉阻滞(deep neuromuscular block,NMB)。结果显示,两组淋巴结清扫数目差异无统计学意义,但在BMI≥28 kg/m2患者中,深度NMB组与中度NMB组相比,清扫淋巴结数目明显增多(49.2±18.6 vs 39.2±13.3,P=0.026),且深度NMB组术中意外事件发生率较低(21.6% vs 36.6%,P=0.034)。
3.3 化疗
近年来,随着靶向治疗及免疫治疗等新型治疗手段的出现,传统化疗药物的研发和应用在胃癌领域已进入瓶颈,但目前化疗仍是治疗胃癌的基石。中国学者对12家研究中心的583例局部晚期胃癌患者随机给予SOX或FOLFOX方案的新辅助治疗,两组的3年OS率差异无统计学意义[43],这也提示胃癌新辅助治疗2周和3周方案对患者预后并无显著影响。一项日本的随机、Ⅲ 期对照临床研究(JACCRO GC-07)[44]纳入接受D2根治术后病理学分期为Ⅲ期的胃癌患者,S-1联合多西他赛对比单纯S-1作为辅助治疗,前者的3年RFS率和3年OS率均显著优于后者。分析患者获益的原因,考虑可能与Ⅲ期胃癌患者容易合并腹膜转移而多西他赛对于合并腹膜转移效果较好有关。复旦大学肿瘤医院开展了一项国内多中心Ⅲ期研究(EXELOX研究)[45],对448例晚期胃癌患者一线随机给予XELOX或EOX方案治疗。结果显示,两组在中位无进展生存期(progression-free survival,PFS)和OS方面差异无统计学意义。亚组分析表明,在低分化腺癌和肝转移患者中,EOX治疗的中位OS明显长于XELOX组(P=0.012),中位PFS有延长趋势(P=0.073),不过三药组的3/4级不良反应发生率显著高于两药组。以上数据表明,晚期胃癌一线治疗中,三联方案并不优于双联方案,但却会明显增加不良反应的发生率。
在胃癌腹膜转移的临床研究方面,日本的PHOENIX-GC研究[46]和中国的Dragon系列研究[47]均已证实,腹腔内注射紫杉醇联合静脉滴注紫杉醇和口服S-1,可使中量腹水亚组患者获益。但这一有效的治疗策略仅在亚洲人群中进行过研究。近期,澳大利亚的一项IPGP研究[48]采用腹腔内注射紫杉醇联合静脉滴注顺铂和口服卡培他滨的方案治疗胃癌腹膜转移。结果显示,12个月OS率为46.7%,中位OS为11.5个月。与既往研究相比,这一结果略显差强人意,考虑可能与腹腔紫杉醇用药剂量偏低(20 mg/m2)有关。新加坡的一项Ⅱ期研究[49]对伴有腹膜转移的胃癌患者一线给予腹腔紫杉醇(40 mg/m2)联合全身XELOX方案治疗,与单纯XELOX组相比,中位PFS(9.5个月 vs 4.4个月)和中位OS(14.6个月 vs 10.6个月)显著延长;36.1%的转化手术的患者中位OS为24.2个月,1年OS率为84.6%。
3.4 分子靶向治疗
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是为数不多的胃癌有效治疗靶点,继ToGA研究后,胃癌抗HER2治疗领域的研究也不断深入。受乳腺癌CLEOPATRA试验[50]药物组合的启发,近期,一项随机Ⅱ期临床试验[51]将胃癌患者随机分成FLOT组(A组)和FLOT+曲妥珠单抗+帕妥珠单抗组(B组),两组均在术前和术后接受4个周期的治疗,随后B组给予曲妥珠单抗联合帕妥珠单抗9个周期的维持治疗,主要终点为病理学完全缓解(pathological complete response,pCR)率。结果显示,B组的pCR率显著提高(A组为12%,B组为35%,P=0.02),且病理学淋巴结阴性(ypN0)率更高(A组为39%,B组为68%)。目前两组的中位OS尚未达到,但从24个月DFS和OS率来看,B组生存获益趋势更明显。但B组有更多3级以上不良反应,特别是腹泻(A组为5%,B组为41%)和白细胞减少(A组为13%,B组为23%)。
抗血管生成是治疗肿瘤的重要策略之一;抗血管生成类药物在胃癌药物治疗中占有重要位置。基于RAINBOW和RAINBOW-Asia研究结果,雷莫芦单抗(ramucirumab)联合紫杉醇是晚期胃癌标准二线治疗方案。在真实世界中,近一半患者会在一线使用紫杉类药物,那该如何选择合适的二线治疗方案?RAMIRIS研究[52]是一项探索FOLFIRI联合ramucirumab对比紫杉醇联合ramucirumab治疗既往接受或未接受含多西他赛方案的晚期或转移性胃食管结合部(gastroesophageal junction,GEJ)腺癌疗效的Ⅱ期研究。结果显示,两组在晚期胃癌中的疗效相似,但在既往接受过多西他赛治疗的患者中,FOLFIRI+ramucirumab优于紫杉醇+ramucirumab。一项在日本老年胃癌患者中一线给予ramucirumab联合S-1的Ⅱ期研究(KSCC1701)结果显示,1年OS率为65.2%,中位PFS和OS分别为5.8和16.4个月[53]。因此,在临床实践中,抗血管生成治疗有望从后线逐渐前移,并使不耐受强力化疗的患者在一线治疗甚至新辅助治疗中获益。
约30%的胃癌患者高表达成纤维细胞生长因子受体2b(fibroblast growth factor receptor 2b,FGFR2b)蛋白[54],该蛋白或可作为胃癌的生物标志物和研究靶点。FIGHT[55]是一项Ⅱ期、随机、双盲研究,评估靶向FGFR2b的单克隆抗体bemarituzumab(BEMA)+改良FOLFOX6(mFOLFOX6)化疗对比安慰剂(PBO)+FOLFOX6(mFOLFOX6),治疗初治的FGFR2b高表达、HER2阴性的晚期胃癌或GEJ癌患者。结果表明,BEMA组的中位PFS为9.5个月,1年PFS率为52.5%,PBO组的中位PFS为7.4个月,1年PFS率为88.8%。
FAST研究[56]为我们带来了极具潜力的胃癌治疗新靶点——CLDN18.2。基于嵌合抗原受体T (chimeric antigen receptor T,CAR-T)细胞治疗在恶性血液系统肿瘤中的不俗表现,在实体肿瘤治疗方面的探索也在逐渐开展中。近期一项正在进行、开放标签、单臂、针对CLDN18.2 CAR-T细胞(CT041)在既往治疗过的CLDN18.2阳性消化系统恶性肿瘤患者的临床试验的中期分析结果显示,总的客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)分别为48.6%和73.0%,6个月持续缓解率为44.8%。而在28例胃癌患者中,总的ORR和DCR分别为57.1%和75.0%,6个月OS率为81.2%,且不良反应可控。2022年11月16日,安斯泰来宣布其 First-in-Class CLDN18.2单抗zolbetuximab已在Ⅲ期临床试验SPOTLIGHT中取得了积极结果,达到了PFS主要终点和OS次要终点,表现出差异有统计学意义的改善,这也是针对CLDN18.2靶点的首个成功的Ⅲ期临床试验。这些结果表明,针对CLDN18.2靶点的治疗在消化系统癌症中具有良好的疗效和可接受的安全性,特别是在胃癌患者中[57]。
3.5 免疫治疗
在免疫治疗领域,高微卫星不稳定性(microsatellite instability-high,MSI-H)/错配修复缺陷(deficient mismatch repair,dMMR)实体瘤患者对免疫治疗的高应答率已得到诸多临床研究结果验证。GERCOR NEONIPIGA研究[58]评价了纳武利尤单抗联合伊匹木单抗新辅助序贯纳武利尤单抗辅助治疗MSI-H/dMMR的GEJ肿瘤及胃癌患者的有效性。主要研究终点是pCR率。共入组32例患者,R0切除率为100%(29/29),TRG 1级(肿瘤完全退缩,未见肿瘤细胞)为58.6%。中位随访12个月后,31例患者均存活,其中30例未复发。另一项Ⅱ期随机对照研究[59]评价了卡瑞利珠单抗联合FLOT方案(A组)对比FLOT方案(B组)新辅助治疗后可切除的胃癌和GEJ腺癌患者的疗效和安全性。主要终点为pCR率和R0切除率。结果显示,与A组相比,B组具有更高的R0切除率(100% vs 91%)和pCR率(13% vs 4%)。一项Ⅱ期研究评价了信迪利单抗联合CAPOX方案新辅助治疗可切除的GEJ肿瘤及胃癌的疗效[60],主要研究终点为pCR率。在入组的36例患者中,R0切除率为97.2%,pCR率和主要病理学缓解率分别为19.4%和47.2%,1年DFS率和OS率分别为90.3%和94.1%。以上数据虽然都是Ⅱ期临床试验的研究结果,但也给我们提供了一个重要信号,即免疫治疗在围手术期的应用为胃癌患者带来了新的治疗选择,有望成为新的治疗标准。
HER2阳性晚期胃癌患者的一线治疗中,以KEYNOTE-811研究为代表的化疗联合抗HER2靶向治疗及免疫检查点抑制剂(immune checkpoint inhibitor,ICI)模式显示了令人鼓舞的疗效[61],可获得显著的疾病缓解[ORR为74.4%,中位缓解持续时间(median duration of response,mDoR)为10.6个月],其长期随访数据更值得期待。KN026是一种可同时与HER2的ECD4及ECD2结合的全人源化双特异性抗体;KN046是重组人源化程序性死亡[蛋白]配体-1 (programmed death ligand-1,PD-L1)/细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4) 双特异性抗体。一项Ⅱ期临床研究[62]评价了KN026联合KN046一线治疗在HER2阳性局部晚期不可切除或转移性GEJ肿瘤及胃癌患者中的初步疗效及安全性。在27例可评估疗效的患者中,总体ORR为77.8%,DCR为92.6%。仅5例发生≥3级治疗相关不良反应(treatment-related adverse event,TRAE),无治疗相关死亡报道。该研究结果显示,两种双特异性抗体通过更有效地阻断HER2及免疫检查点通路,即使未联合化疗亦显示了良好的缩瘤率,为未来确立HER2阳性胃癌一线治疗的去化疗化策略提供了重要信息。
既往报道中,CheckMate-649研究公布了中国人群亚组数据及全人群2年随访数据[63],中国亚组共纳入208例,免疫联合化疗组相比安慰剂联合化疗组,全人群中位OS得到改善(14.3个月 vs 10.2个月,HR=0.61,95% CI:0.44~0.85),中位PFS为8.3和5.6个月(HR=0.57,95% CI:0.40~0.80),ORR为66%和45%,DoR为12.2和5.6个月。其中,在CPS≥5及CPS≥1人群中均显示了与全人群类似的临床获益。另外,CheckMate-649研究全人群2年随访结果[64]显示,所有随机患者的中位OS及PFS仍较对照组获益,纳武利尤单抗联合化疗组2年OS率为28%、2年PFS率为16%,均高于对照组(19%和10%)。一线后治疗的PFS(即PFS2)亦显示纳武利尤单抗组优于对照组(12.2个月 vs 10.4个月,HR=0.73,95% CI:0.67~0.84)。PFS2的数据是最值得我们关注的一点,究其原因考虑免疫治疗改善了肿瘤的微环境,出现了长拖尾效应。
RATIONALE 305研究是一项替雷利珠单抗联合化疗用于局部晚期不可切除或转移性胃癌或GEJ癌一线治疗的全球多中心、随机、安慰剂对照、Ⅲ期注册临床试验。该研究中期结果显示,相较于安慰剂联合化疗,替雷利珠单抗联合化疗可给表达PD-L1的患者带来显著生存获益,中位OS达到17.2个月,使患者的死亡风险显著降低26%(HR=0.74;95% CI:0.59~0.94),这一结果也刷新了程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂用于晚期胃癌治疗的生存记录。因此,替雷利珠单抗联合化疗有望成为全球晚期胃癌患者的标准治疗方案。
CTLA-4单抗联合PD-1单抗的双免疫联合治疗在部分实体瘤中亦显示出疗效,但不良反应值得关注[65]。AIO-STO-0417/Moonlight是一项四臂、研究者发起的Ⅱ期研究,旨在评价FOLFOX方案联合纳武利尤单抗及伊匹木单抗平行或序贯治疗用于晚期或转移性GEJ肿瘤及胃癌的有效性及安全性[66]。研究者首先探索了FOLFOX联合PD-1单抗和CTLA-4单抗的疗效,但结果显示,FOLFOX联合双免疫治疗的效果并未能优于FOLFOX化疗(ORR为45% vs 48%,PFS为5.7个月 vs 6.6个月)。此外,该研究还进一步探索了不同给药顺序能否在不影响疗效的同时降低整体治疗相关不良反应。患者随机接受平行治疗(A1组:mFOLFOX q2w+纳武利尤单抗 q2w+伊匹木单抗 q6w)或序贯治疗(A2组:mFOLFOX q2w×3→纳武利尤单抗 q2w×4+伊匹木单抗 q6w×2→纳武利尤单抗 q2w+伊匹木单抗q6w)。主要终点为6个月PFS率。结果显示,平行治疗组的6个月PFS率显著优于序贯治疗组(60% vs 30%)。平行治疗组的中位PFS (7.29个月 vs 3.98个月)、中位OS(10.12个月 vs 7.85个月)及ORR(46.7% vs 30.0%)亦优于序贯治疗组。常见(≥25%)的TRAE为腹泻、疲乏、恶心、中性粒细胞减少及外周感觉神经病变。尽管序贯治疗组的TRAE较低,但该研究的有效性数据显示,平行治疗组较序贯治疗组具有更好的临床获益。
以REGONIVO模式为代表的靶向治疗与免疫治疗联合策略在包括胃、肠、胆道等晚期消化系统肿瘤后线治疗中进行了广泛探索 67]。LEAP-015(NCT04662710)研究是一项全球、随机、开放标签、两部分的Ⅲ期临床试验[68],旨在评估仑伐替尼加帕博利珠单抗联合化疗(CAPOX或FOLFOX)作为晚期/转移性GEJ肿瘤及胃癌一线治疗的安全性及有效性。2022年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会上报告了第1部分(Run-in期安全性)的结果。结果显示,3~5级不良反应发生率为67%,其中严重不良反应共5例,无治疗相关死亡,未观察到3~5级免疫相关不良反应。有效性数据显示,ORR为73%,DCR为93%。上述结果提示,在HER2阴性晚期胃癌一线治疗中,化疗联合帕博利珠单抗加伦伐替尼的联合治疗策略安全性可控,且有较高的治疗有效率,该研究的随机对照研究阶段结果令人期待。一项Ⅱ期、单臂研究评价了FOLFOX方案联合纳武利尤单抗加瑞戈非尼用于HER2阴性局部晚期不可切除或转移性GEJ肿瘤及胃癌的一线治疗的有效性[69],主要终点为6个月PFS率。结果显示,6个月PFS率为71%,中位PFS为13.0个月,12个月OS率为83%,共有18例患者(51%)发生3/4级不良反应。尽管该研究达到预设的主要终点,并显示了较为良好的临床获益,但该方案仍有待大样本、对照研究验证。同时,较高的3/4度不良反应率发生率也值得关注。近期国内学者报道了一项评估POF(紫杉醇、奥沙利铂及5-氟尿嘧啶)方案联合卡瑞利珠单抗加阿帕替尼一线治疗HER2阴性转移性或不可切除的GEJ肿瘤及胃癌的疗效的单中心、Ⅱ期临床研究[70],主要终点为ORR,入组20例患者,ORR为75.0%,中位PFS为 11.0个月,中位OS为14.0个月,常见不良反应包括中性粒细胞减少(75.0%)、高血压(30.0%)和疲乏(20.0%),90.0%的患者发生3/4级的TRAE。尽管初步结果显示了较高的疾病控制率,但该研究样本量有限,且在一线治疗中使用了几乎所有潜在有效药物,治疗毒性较大,且限制了后线治疗选择,生存数据并未显示对于患者预后的显著改善。因此,该治疗策略仍有待探讨及优化。
随着ICI在胃癌一线治疗中的成功,一线化疗联合PD-1抑制剂已成为标准治疗。而在一线方案进展后,胃癌标准二线治疗选择包括紫杉醇、伊利替康、紫杉醇联合雷莫卢单抗等,但总体有效率及生存获益有限。对于部分未接受过ICI治疗的患者,可在二线治疗中尝试标准治疗方案基础上的联合用药。PRODIGE 59-DURIGAST[71]是一项评估FOLFIRI联合度伐利尤单抗±曲美木单抗二线治疗晚期GEJ肿瘤及胃癌安全性及疗效的随机Ⅱ期研究。入组一线含铂类药物方案治疗失败、未接受过ICI治疗的患者,随机接受FOLFIRI联合度伐利尤单抗(A组)或FOLFIRI联合度伐利尤单抗加曲美木单抗(B组),主要研究终点为4个月PFS率。该研究未能达到主要终点,B组和A组的4个月PFS率为55.6%和44.7% ,ORR为37.7%和32.6%,OS为9.5和13.3个月。两组患者3~5级的TRAE不良反应均为47.8%。尽管双免疫联合治疗未显著增加治疗毒性,但该研究未能显示FOLFIRI方案化疗联合双免疫治疗在胃癌二线治疗中的获益。另一项单臂Ⅱ期研究评价了白蛋白结合型紫杉醇联合信迪利单抗二线治疗晚期或转移性GEJ肿瘤及胃癌的效果[72]。在39例可行疗效分析的患者中有2例完全缓解(complete response,CR),19例部分缓解(partial response,PR),ORR为53.8%(21/39),DCR为89.7%(35/39)。研究并未观察到新的不良反应信号。该研究结果显示了较既往二线单纯化疗更高的有效率,但仅为小样本研究,其结果仍有待验证。
3.6 放疗
多学科诊疗是胃癌治疗的基础,既往的研究已证实放疗是其中不可替代的组成部分。术前同步放化疗是可切除GEJ腺癌的标准治疗模式,但同步化疗的方案选择一直没有达成共识。随着免疫治疗的开展,已初步观察到放疗联合免疫治疗可改变免疫微环境,提高远隔效应的发生概率,术前不同化疗方案的优化等均有涉及。因此,在同步放化疗的基础上加入PD-L1抑制剂,不仅安全且有提高pCR率的趋势。但在过去的一年里,有关胃癌放疗的研究甚少,热点主要集中在免疫治疗方面,未见可改变临床实践的大型Ⅲ期研究报道。近期,中国的一项Ⅱ期Neo-PLANET研究[73]结果显示,在GEJ腺癌患者新辅助放化疗的基础上联合卡瑞丽珠单抗可达到33.3%的pCR率,R0切除率为91.7%。美国的一项Ⅰb/Ⅱ期研究对cT1- 3NxM0的GEJ腺癌患者采用CROSS方案(免疫治疗药物为帕博丽珠单抗)进行治疗,主要终点为前16例患者的pCR,结果显示pCR为22.6%,未达到预设的终点指标,但探索性研究提示PD-L1高表达者获益明显[74]。
4、结语
近年来,随着免疫治疗药物、靶向治疗药物和其他新型药物的涌现,已然改写了胃癌治疗的格局。但由于肿瘤较高的异质性,整体的治疗效果仍不理想,胃癌的精准治疗依然任重道远。精准筛选合适获益人群及克服耐药成为优化临床治疗结局的关键。未来胃癌治疗需要更精准的诊断、分型和决策,并进一步开展基于基础研究的临床转化试验,发现更多的靶点并开发更多的药物使胃癌患者获益。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] SHAH D, BENTREM D. Environmental and genetic risk factors for gastric cancer[J]. J Surg Oncol, 2022, 125(7): 1096-1103.
[3] GARCIA-PELAEZ J, BARBOSA-MATOS R, SÃO JOSÉ C, et al. Gastric cancer genetic predisposition and clinical presentations: established heritable causes and potential candidate genes[J]. Eur J Med Genet, 2022, 65(1): 104401.
[4] CARNEIRO F. Familial and hereditary gastric cancer, an overview[J]. Best Pract Res Clin Gastroenterol, 2022, 58/59: 101800.
[5] YAN C W, ZHU M, DING Y B, et al. Meta-analysis of genomewide association studies and functional assays decipher susceptibility genes for gastric cancer in Chinese populations[J]. Gut, 2020, 69(4): 641-651.
[6] GRADY W M. Epigenetic alterations in the gastrointestinal tract: current and emerging use for biomarkers of cancer[J]. Adv Cancer Res, 2021, 151: 425-468.
[7] HARON N H, MOHAMAD HANIF E A, ABDUL MANAF M R, et al. Microsatellite instability and altered expressions of MLH1 and MSH2 in gastric cancer[J]. Asian Pac J Cancer Prev, 2019, 20(2): 509-517.
[8] USUI G, MATSUSAKA K, MANO Y, et al. DNA methylation and genetic aberrations in gastric cancer[J]. Digestion, 2021, 102(1): 25-32.
[9] OUE N, SENTANI K, SAKAMOTO N, et al. Molecular carcinogenesis of gastric cancer: Lauren classification, mucin phenotype expression, and cancer stem cells[J]. Int J Clin Oncol, 2019, 24(7): 771-778.
[10] ZHANG R, LI H, LI N, et al. Risk factors for gastric cancer: a large-scale, population-based case-control study[J]. Chin Med J (Engl), 2021, 134(16): 1952-1958.
[11] DENG W, JIN L, ZHUO H, et al. Alcohol consumption and risk of stomach cancer: a meta-analysis[J]. Chem Biol Interact, 2021, 336: 109365.
[12] RAZA Y, AHMED A, KHAN A, et al. Helicobacter pylori severely reduces expression of DNA repair proteins PMS2 and ERCC1 in gastritis and gastric cancer[J]. DNA repair (Amst), 2020, 89: 102836.
[13] ALIPOUR M. Molecular mechanism of Helicobacter pyloriinduced gastric cancer[J]. J Gastrointest Canc, 2021, 52(1): 23-30.
[14] YUAN Q, DENG D, PAN C, et al. Integration of transcriptomics, proteomics, and metabolomics data to reveal HER2-associated metabolic heterogeneity in gastric cancer with response to immunotherapy and neoadjuvant chemotherapy[J]. Front Immunol, 2022, 13: 951137.
[15] GUO T, TANG X H, GAO X Y, et al. A liquid biopsy signature of circulating exosome-derived mRNAs, miRNAs and lncRNAs predict therapeutic efficacy to neoadjuvant chemotherapy in patients with advanced gastric cancer[J]. Mol Cancer, 2022, 21(1): 216.
[16] ZHU Y, ZHAO Y, CAO Z, et al. Identification of three immune subtypes characterized by distinct tumor immune microenvironment and therapeutic response in stomach adenocarcinoma[J]. Gene, 2022, 818: 146177.
[17] CORTÉS-GUIRAL D, HÜBNER M, ALYAMI M, et al. Primary and metastatic peritoneal surface malignancies[J]. Nat Rev Dis Primers, 2021, 7(1): 91.
[18] LI D, WANG Y, DONG C, et al. CST1 inhibits ferroptosis and promotes gastric cancer metastasis by regulating GPX4 protein stability via OTUB1[J]. Oncogene, 2023, 42(2): 83-98.
[19] AL-MARZOUKI L, STAVRAKOS V S, PAL S, et al. Soluble factors in malignant ascites promote the metastatic adhesion of gastric adenocarcinoma cells[J]. Gastric Cancer, 2023, 26(1): 55-68.
[20] TIAN C, ZHAO J, LIU D, et al. Identification of metabolismrelated genes for predicting peritoneal metastasis in patients with gastric cancer[J]. BMC Genom Data, 2022, 23(1): 84.
[21] TAKAHASHI K, KURASHINA K, YAMAGUCHI H, et al. Altered intraperitoneal immune microenvironment in patients with peritoneal metastases from gastric cancer[J]. Front Immunol, 2022, 13: 969468.
[22] VALASTYAN S, WEINBERG R A. Tumor metastasis: molecular insights and evolving paradigms[J]. Cell, 2011, 147(2): 275-292.
[23] KWA M Q, HERUM K M, BRAKEBUSCH C. Cancerassociated fibroblasts: how do they contribute to metastasis?[J]. Clin Exp Metastasis, 2019, 36(2): 71-86.
[24] ZHAO Z X, ZHANG Y Q, SUN H, et al. Calcipotriol abrogates cancer-associated fibroblast-derived IL-8-mediated oxaliplatin resistance in gastric cancer cells via blocking PI3K/AKT signaling[J]. Acta Pharmacol Sin, 2023, 44(1): 178-188.
[25] LI X, SUN Z, PENG G, et al. Single-cell RNA sequencing reveals a pro-invasive cancer-associated fibroblast subgroup associated with poor clinical outcomes in patients with gastric cancer[J]. Theranostics, 2022, 12(2): 620-638.
[26] MAK T K, LI X, HUANG H, et al. The cancer-associated fibroblast-related signature predicts prognosis and indicates immune microenvironment infiltration in gastric cancer[J]. Front Immunol, 2022, 13: 951214.
[27] YAMAMOTO Y, KASASHIMA H, FUKUI Y, et al. The heterogeneity of cancer-associated fibroblast subpopulations: their origins, biomarkers, and roles in the tumor microenvironment[J]. Cancer Sci, 2023, 114(1): 16-24.
[28] 王佳艳, 刘 政. 肿瘤相关中性粒细胞调控胃癌发展的研究进展[J]. 医学研究生学报, 2020, 33(2): 210-214.
WANG J Y, LIU Z. Recent advances in tumor-associated neutrophils regulate the progression of gastric cancer[J]. J Med Postgrad, 2020, 33(2): 210-214.
[29] LI J C, ZOU X M, YANG S F, et al. Neutrophil extracellular traps participate in the development of cancer-associated thrombosis in patients with gastric cancer[J]. World J Gastroenterol, 2022, 28(26): 3132-3149.
[30] YANG S, ZOU X, LI J, et al. Immunoregulation and clinical significance of neutrophils/NETs-ANGPT2 in tumor microenvironment of gastric cancer[J]. Front Immunol, 2022, 13: 1010434.
[31] HAO S X, SHOU M Y, MA J, et al. Correlation analysis of serum pepsinogen, interleukin, and TNF-α with hp infection in patients with gastric cancer: a randomized parallel controlled clinical study[J]. Comput Math Methods Med, 2022, 2022: 9277847.
[32] QIN C, SONG Y, GAI Y, et al. Gallium-68-labeled fibroblast activation protein inhibitor PET in gastrointestinal cancer: insights into diagnosis and management[J]. Eur J Nucl Med Mol Imaging, 2022, 49(12): 4228-4240.
[33] LI J J, SHAN H B, GU M F, et al. Endoscopic ultrasound combined with submucosal saline injection for differentiation of T1a and T1b esophageal squamous cell carcinoma: a novel technique[J]. Endoscopy, 2013, 45(8): 667-670.
[34] HE L J, XIE C, WANG Z X, et al. Submucosal saline injection followed by endoscopic ultrasound versus endoscopic ultrasound only for distinguishing between T1a and T1b esophageal cancer[J]. Clin Cancer Res, 2020, 26(2): 384-390.
[35] WATANABE H, MIWA H, TERAI T, et al. Endoscopic ultrasonography for colorectal cancer using submucosal saline solution injection[J]. Gastrointest Endosc, 1997, 45(6): 508-511.
[36] PARK J Y, JEON T J. Diagnostic evaluation of endoscopic ultrasonography with submucosal saline injection for differentiating between T1a and T1b early gastric cancer[J]. World J Gastroenterol, 2022, 28(46): 6564-6572.
[37] HUANG C M, LIU H, HU Y F, et al. Laparoscopic vs open distal gastrectomy for locally advanced gastric cancer: five-year outcomes from the CLASS-01 randomized clinical trial[J]. JAMA Surg, 2022, 157(1): 9-17.
[38] SHIBASAKI S, NAKAUCHI M, SERIZAWA A, et al. Clinical advantage of standardized robotic total gastrectomy for gastric cancer: a single-center retrospective cohort study using propensity-score matching analysis[J]. Gastric Cancer, 2022, 25(4): 804-816.
[39] KUROKAWA Y, DOKI Y, MIZUSAWA J, et al. Bursectomy versus omentectomy alone for resectable gastric cancer (JCOG1001): a phase 3, open-label, randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2018, 3(7): 460-468.
[40] KUROKAWA Y, DOKI Y, MIZUSAWA J, et al. Fiveyear follow-up of a randomized clinical trial comparing bursectomy and omentectomy alone for resectable gastric cancer (JCOG1001)[J]. Br J Surg, 2022, 110(1): 50-56.
[41] KIM Y W, MIN J S, YOON H M, et al. Laparoscopic sentinel node navigation surgery for stomach preservation in patients with early gastric cancer: a randomized clinical trial[J]. J Clin Oncol, 2022, 40(21): 2342-2351.
[42] PARK S H, HUH H, CHOI S I, et al. Impact of the deep neuromuscular block on oncologic quality of laparoscopic surgery in obese gastric cancer patients: a randomized clinical trial[J]. J Am Coll Surg, 2022, 234(3): 326-339.
[43] YU J R, GAO Y, CHEN L, et al. Effect of S-1 plus oxaliplatin compared with fluorouracil, leucovorin plus oxaliplatin as perioperative chemotherapy for locally advanced, resectable gastric cancer: a randomized clinical trial[J]. JAMA Netw Open, 2022, 5(2): e220426.
[44] KAKEJI Y, YOSHIDA K, KODERA Y, et al. Three-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 plus docetaxel versus S-1 alone in stage Ⅲ gastric cancer: JACCRO GC-07[J]. Gastric Cancer, 2022, 25(1): 188-196.
[45] ZHU X D, HUANG M Z, WANG Y S, et al. XELOX doublet regimen versus EOX triplet regimen as first-line treatment for advanced gastric cancer: an open-labeled, multicenter, randomized, prospective phase Ⅲ trial (EXELOX)[J]. Cancer Commun (Lond), 2022, 42(4): 314-326.
[46] ISHIGAMI H, FUJIWARA Y, FUKUSHIMA R, et al. Phase Ⅲ trial comparing intraperitoneal and intravenous paclitaxel plus S-1 versus cisplatin plus S-1 in patients with gastric cancer with peritoneal metastasis: PHOENIX-GC trial[J]. J Clin Oncol, 2018, 36(19): 1922-1929.
[47] SHI M, YANG Z, LU S, et al. Oxaliplatin plus S-1 with intraperitoneal paclitaxel for the treatment of Chinese advanced gastric cancer with peritoneal metastases[J]. BMC Cancer, 2021, 21(1): 1344.
[48] VATANDOUST S, BRIGHT T, ROY A C, et al. Phase 1 trial of intraperitoneal paclitaxel in combination with intravenous cisplatin and oral capecitabine in patients with advanced gastric cancer and peritoneal metastases (IPGP study)[J]. Asia Pac J Clin Oncol, 2022, 18(4):404-409.
[49] CHIA FRCS D K A, MRCP R S, FRCS G K, et al. Outcomes of a phase Ⅱ study of intraperitoneal paclitaxel plus systemic capecitabine and oxaliplatin (XELOX) for gastric cancer with peritoneal metastases[J]. Ann Surg Oncol, 2023, 30(3): 1889-1890.
[50] SWAIN S M, MILES D, KIM S B, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a doubleblind, randomised, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2020, 21(4): 519-530.
[51] HOFHEINZ R D, MERX K, HAAG G M, et al. FLOT versus FLOT/trastuzumab/pertuzumab perioperative therapy of human epidermal growth factor receptor 2-positive resectable esophagogastric adenocarcinoma: a randomized phase Ⅱ trial of the AIO EGA study group[J]. J Clin Oncol, 2022, 40(32): 3750-3761.
[52] LORENZEN S, THUSS-PATIENCE P, PAULIGK C, et al. FOLFIRI plus ramucirumab versus paclitaxel plus ramucirumab as second-line therapy for patients with advanced or metastatic gastroesophageal adenocarcinoma with or without prior docetaxel-results from the phase Ⅱ RAMIRIS study of the German gastric cancer study group at AIO[J]. Eur J Cancer, 2022, 165: 48-57.
[53] KOBAYSHI K, SUYAMA K, KATSUYA H, et al. A phase Ⅱ multicenter trial assessing the efficacy and safety of first-line S-1 + ramucirumab in elderly patients with advanced/recurrent gastric cancer: KSCC1701[J]. Eur J Cancer, 2022, 166: 279-286.
[54] AHN S, LEE J, HONG M, et al. FGFR2 in gastric cancer: protein overexpression predicts gene amplification and high H-index predicts poor survival[J]. Mod Pathol, 2016, 29(9): 1095-1103.
[55] WAINBERG Z A, ENZINGER P C, KANG Y K, et al. Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study[J]. Lancet Oncol, 2022, 23(11): 1430-1440.
[56] SAHIN U, TURECI O, MANIKHAS G, et al. FAST: a randomised phase Ⅱ study of zolbetuximab (IMAB362) plus EOX versus EOX alone for first-line treatment of advanced CLDN18.2-positive gastric and gastro-oesophageal adenocarcinoma[J]. Ann Oncol, 2021, 32(5): 609-619.
[57] QI C S, GONG J F, LI J, et al. Claudin18.2-specific CART cells in gastrointestinal cancers: phase 1 trial interim results[J]. Nat Med, 2022, 28(6): 1189-1198.
[58] ANDRÉ T, TOUGERON D, PIESSEN G, et al. Neoadjuvant nivolumab plus ipilimumab and adjuvant nivolumab in patients (pts) with localized microsatellite instability-high (MSI)/ mismatch repair deficient (dMMR) oeso-gastric adenocarcinoma (OGA): the GERCOR NEONIPIGA phase Ⅱ study[J]. J Clin Oncol, 2023, 41(2): 255-265.
[59] MIN L Z, LIU N, ZHOU Y, et al. Efficacy and safety of camrelizumab combined with FLOT versus FLOT alone as neoadjuvant therapy in patients with resectable locally advanced gastric and gastroesophageal junction adenocarcinoma who received D2 radical gastrectomy[J]. Ann Oncol, 2022, 33: S555-S580.
[60] JIANG H P, YU X F, LI N, et al. Efficacy and safety of neoadjuvant sintilimab, oxaliplatin and capecitabine in patients with locally advanced, resectable gastric or gastroesophageal junction adenocarcinoma: early results of a phase 2 study[J]. J Immunother Cancer, 2022, 10(3): e003635.
[61] JANJIGIAN Y Y, KAWAZOE A, YAÑEZ P, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer[J]. Nature, 2021, 600(7890): 727-730.
[62] SHEN L, GONG J, NIU Z, et al. The preliminary efficacy and safety of KN026 combined with KN046 treatment in HER2- positive locally advanced unresectable or metastatic gastric/ gastroesophageal junction cancer without prior systemic treatment in a phase Ⅱ study[J]. Ann Oncol, 2022, 33(S7): S1102.
[63] LIU T, BAI Y, LIN X, et al. First-line nivolumab plus chemotherapy vs chemotherapy in patients with advanced gastric, gastroesophageal junction and esophageal adenocarcinoma: CheckMate 649 Chinese subgroup analysis[J]. Int J Cancer, 2023, 152(4): 749-760.
[64] SHITARA K, JANJIGIAN Y Y, MOEHLER M H, et al. Nivolumab (NIVO) plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced gastric cancer/ gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): expanded efficacy, safety, and subgroup analyses from CheckMate 649[J]. J Clin Oncol, 2022, 40: Abstract 240.
[65] HELLMANN M D, PAZ-ARES L, BERNABE CARO R, et al. Nivolumab plus ipilimumab in advanced non-small cell lung cancer[J]. N Engl J Med, 2019, 381(21): 2020-2031.
[66] LORENZEN S, THUSS-PATIENCE P C, FOLPRECHT G, et al. FOLFOX plus nivolumab and ipilimumab versus FOLFOX induction followed by nivolumab and ipilimumab in patients with previously untreated advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction: results from the randomized phase Ⅱ Moonlight trial of the AIO[C]. ESMO 2022: Abstract 1203O.
[67] FUKUOKA S, HARA H, TAKAHASHI N, et al. Regorafenib plus nivolumab in patients with advanced gastric or colorectal cancer: an open-label, dose-escalation, and dose-expansion phase Ⅰb trial (REGONIVO, EPOC1603)[J]. J Clin Oncol, 2020, 38(18): 2053-2061.
[68] SHITARA K, BEN-AHARON I, ROJAS C, et al. First-line lenvatinib (Len) + pembrolizumab (Pembro) + chemotherapy (Chemo) vs chemo in advanced/metastatic gastroesophageal adenocarcinoma: LEAP-015 safety run-in[J]. Ann Oncol, 2022, 33: S555-S580.
[69] CYTRYN S, JOSHI S, KU G Y, et al. Regorafenib (REGO) with nivolumab (NIVO) and FOLFOX in HER2 negative esophagogastric cancer (EGC)[J]. Ann Oncol, 2022, 33: S555-S580.
[70] SU L, ZHAO S, LIN P, et al. Camrelizumab plus apatinib combined with POF in patients with untreated advanced gastric cancer (UAGC): a single-center, open-label, single-arm, phase Ⅱ trial (SYLT-017)[J]. Ann Oncol, 2022, 33: S1119-S1120.
[71] TOUGERON D, DAHAN L, EL HAJBI F, et al. PRODIGE 59-DURIGAST trial: a randomised phase Ⅱ study evaluating FOLFIRI plus durvalumab and FOLFIRI plus durvalumab plus tremelimumab in second-line treatment of patients with advanced gastric or gastro-oesophageal junction adenocarcinoma[J]. Ann Oncol, 2022, 33: S555-S580.
[72] JIANG Z C, ZHANG W, YANG L, et al. Nab-paclitaxel plus sintilimab as second-line therapy for advanced or metastatic gastric or gastroesophageal junction adenocarcinoma (G/GEJA): preliminary results from an open-label, single-arm, phase 2 study[J]. J Clin Oncol, 2022, 40: 293-293.
[73] TANG Z Q, WANG Y, LIU D, et al. The Neo-PLANET phase Ⅱ trial of neoadjuvant camrelizumab plus concurrent chemoradiotherapy in locally advanced adenocarcinoma of stomach or gastroesophageal junction[J]. Nat Commun, 2022, 13(1): 6807.
[74] ZHU M, CHEN C, FOSTER N R, et al. Pembrolizumab in combination with neoadjuvant chemoradiotherapy for patients with resectable adenocarcinoma of the gastroesophageal junction[J]. Clin Cancer Res, 2022, 28(14): 3021-3031.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言