Nature背靠背:终于搞清楚了!破解METTL1-WDR4复合物如何催化tRNA m7G修饰
2023-01-06 iNature iNature 发表于陕西省
RNA的化学修饰在许多生物过程中起着关键作用。tRNA富含各种化学修饰,这些修饰影响其稳定性和功能,其中N7-甲基鸟苷(N7-methylguanosine, m7G)是tRNA的完整性和稳定性所必需
RNA的化学修饰在许多生物过程中起着关键作用。tRNA富含各种化学修饰,这些修饰影响其稳定性和功能,其中N7-甲基鸟苷(N7-methylguanosine, m7G)是tRNA的完整性和稳定性所必需的。
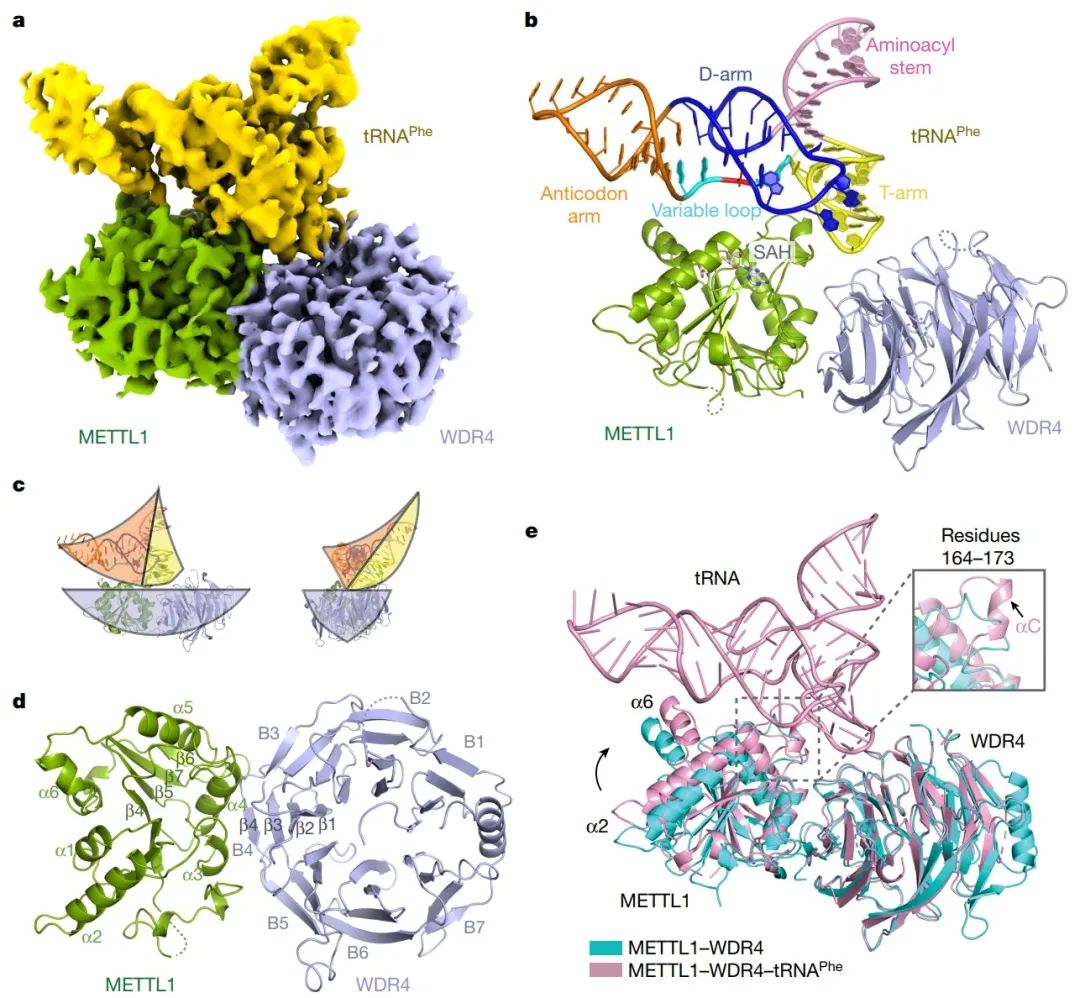
tRNA m7G甲基化复合物主要有甲基化酶METTL1和辅助蛋白WDR4组成。它在某些tRNAs的可变环中修饰G46,其调控异常在许多癌症类型中驱动肿瘤发生。WDR4突变导致包括小头症在内的人类发育表型。然而,METTL1-WDR4是如何修饰tRNA底物并被调节的仍然是难以捉摸的。
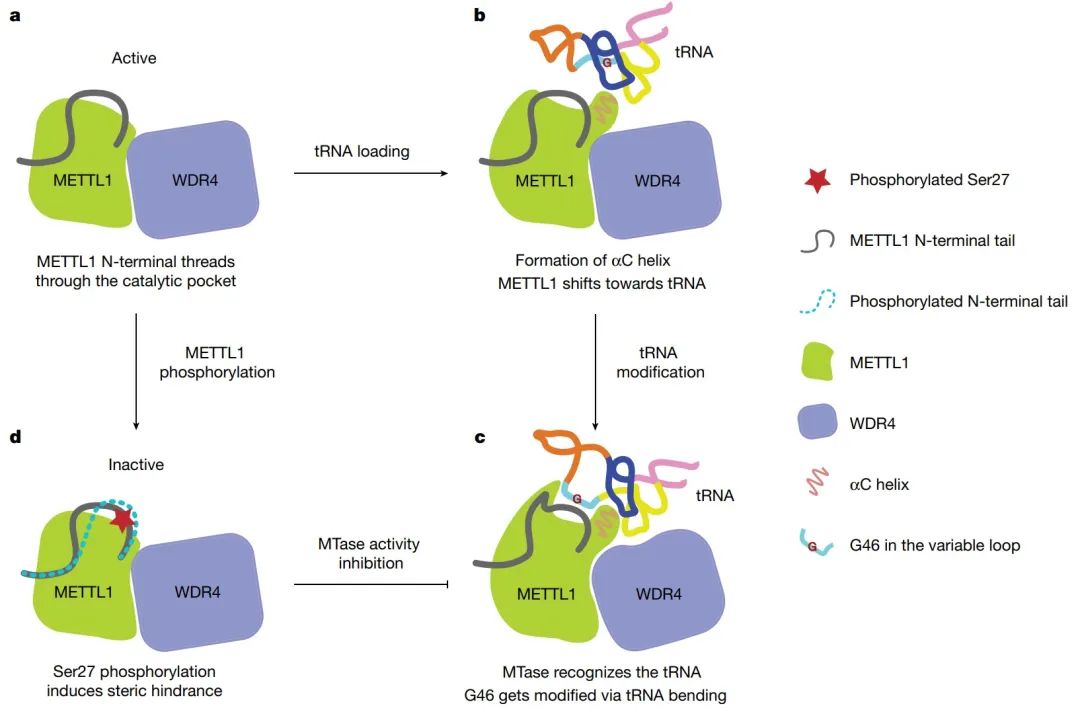
2023年1月4日,美国波士顿儿童医院Richard I. Gregory课题组在Nature杂志在线发表题为“Structural basis of regulated m7G tRNA modification by METTL1-WDR4”的研究论文,该研究通过对人类METTL1-WDR4的结构、生化和细胞研究表明,WDR4可作为METTL1和tRNA T臂的支架。在tRNA结合后,METTL1的αC区转变为一个螺旋,该螺旋与α6螺旋一起固定tRNA变量环的两端。研究发现METTL1预测的无序N端区域是催化口袋的一部分,对甲基转移酶活性至关重要。此外,研究发现S27在METTL1 N端区域的磷酸化通过局部破坏催化中心来抑制甲基转移酶活性。总之,这项研究结果提供了tRNA底物识别和磷酸化介导的METTL1-WDR4调控的分子理解,并揭示了METTL1无序的N端区域作为甲基转移酶活性的连接。


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







