病理干货 | 文献学习:弥漫性共表达TTF1和p40的非小细胞肺癌:14例罕见双表型肿瘤的临床病理和基因组特征
2023-10-24 上海阿克曼病理 上海阿克曼病理 发表于上海
收集了14例弥漫性TTF1和p40共表达的肺癌病例,描述了这些肿瘤的详细形态学、免疫组织化学、基因组和临床特征,阐述例这一不寻常肿瘤的特性和潜在的组织发生。
甲状腺转录因子1(TTF1)和p40分别是肺腺癌(LUAD)和鳞状细胞癌(LUSC)的主要转录调节因子和分化标志物。TTF1在 85%的LUAD表达,在LUSC中很少出现。相反,p40在LUSC中持续表达。它也可以在少数LUAD中表达,但标记通常只发生在少数分散的肿瘤细胞中。基于这种基本上不重叠的表达谱,推荐TTF1和p40分别作为将低分化NSCLC分为LUAD和LUSC的关键标志物。弥漫性共表达TTF1和p40的肺癌非常罕见。22年9月,发表在《Histopathology》的文章:Non-small cell lung carcinomas with diffuse coexpression of TTF1 and p40: clinicopathological and genomic features of 14 rare biphenotypic tumours,收集了14例弥漫性TTF1和p40共表达的肺癌病例,描述了这些肿瘤的详细形态学、免疫组织化学、基因组和临床特征,阐述例这一不寻常肿瘤的特性和潜在的组织发生。
01 材料和方法
1 样本选择和研究设计
该研究的选择标准是具有TTF1和p40弥漫性共表达的肺癌,其中弥漫性表达被定义为在50-100%的肿瘤细胞中标记。这些病例是通过在MSKCC遇到的常规临床病例(n=5)、提交给MSKCC的咨询的病例(n=7)以及University of North Carolina, Chapel Hill, NC(n=1)和Columbia University Medical Center, New York NY(n=1)。收集详细的流行病学和临床信息,并分析病例的组织学和免疫组织化学(IHC)特征。如果有足够的组织可用,则通过下一代测序(NGS)对病例进行分析。
2 病理复核
两名胸部病理学家(O.S.,N.R.)对HE、IHC和特殊染色切片复核,以评估肿瘤形态及IHC标志物的表达。这些病例的病理分期基于美国癌症联合委员会(AJCC)第8版。
3 免疫组织化学化分析
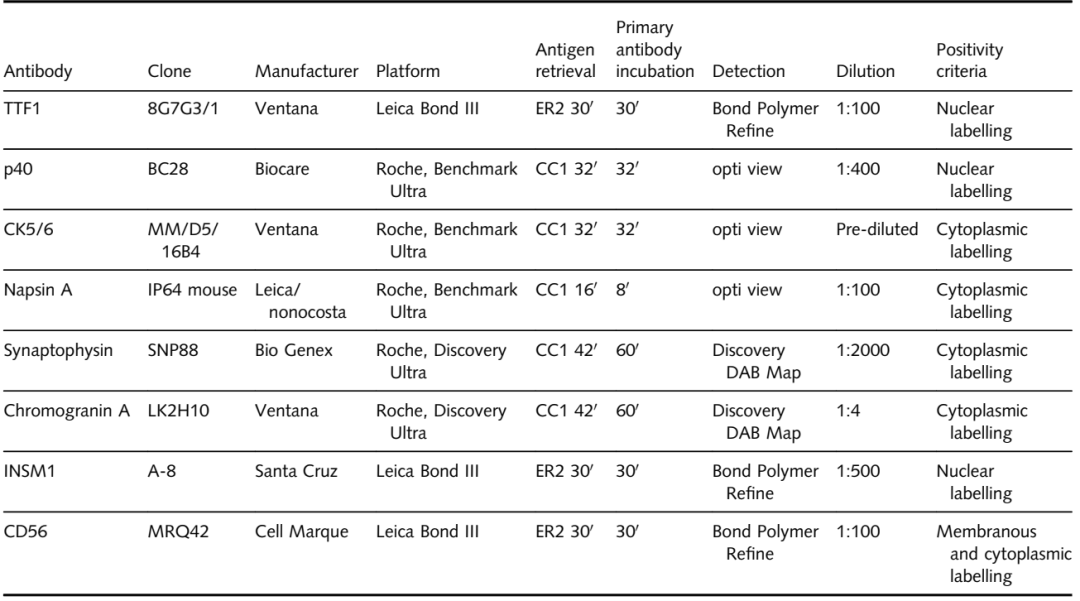
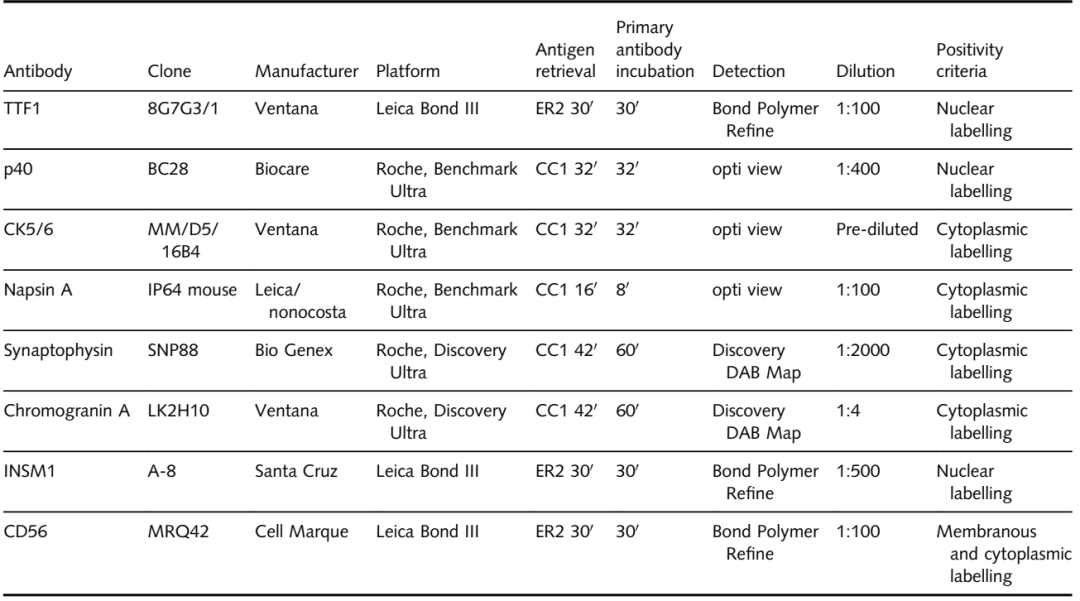
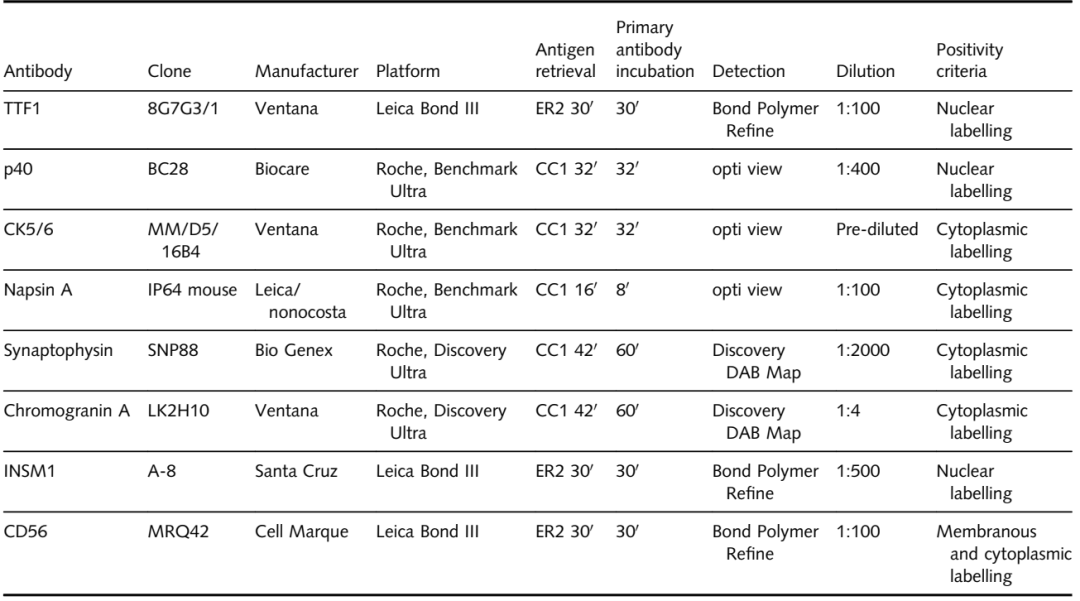
除了TTF1(克隆8G7G3/1)和p40(克隆BC28)外,只要有足够的组织可用,还对病例进行CK5/6、NapsinA和粘液卡红染色。此外,对一部分病例进行了SyN、CgA、INSM1和CD56的IHC。IHC抗体克隆和方案的详细总结见表1中。
表1 免疫组织化学方法
4 NGS
共对8例患者进行了靶向NGS。如前所述,其中7个由Memorial Sloan Kettering Integrated Mutation Profiling of Actionable Cancer Targets(MSK-IMPACT)平台分析。MSK-IMAPCT是一个基于杂交捕获的DNA测序平台,它对410(v4)或468(v5)癌症基因的整个外显子和选定内含子进行测序。根据先前的验证,拷贝数增加超过2.0倍的变化被报告为扩增。根据患者外周血中匹配的种系DNA,对种系突变进行生物信息学过滤。将结果与作为MSKCC MSK-IMPACT前瞻性临床测序队列的一部分。使用cBioPortal.14分析的9181 LUAD和1066 LUSC中的结果进行比较。其中一个病例(哥伦比亚大学医学中心提供,病例14),采用Pillar Biosciences的SLIMamp技术对9个癌症基因(包括BRAF、EGFR、KRAS、ERBB2、MET、PIK3CA、POLD1、POLE和STK11中的热点)进行NGS。
5 统计学分析
使用Fisher精确检验和Mann-Whitney U检验对临床病理参数进行比较。使用R版本3.3.2进行统计分析(https://www.R-project.org/)。
02 结 果
1 流行病学,影像学特征及临床特征
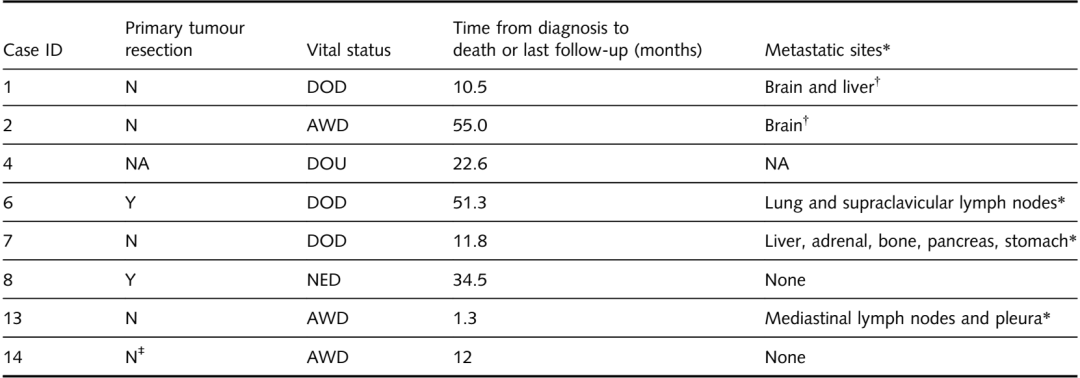
表2中总结了TTF1/p40共表达肺癌的患者特征。患者年龄平均78岁(范围=65-94);7名患者为男性,7名为女性,除1名患者外,其余患者均为吸烟者,平均吸烟史为35包年(范围=25-56)。肿瘤主要位于外周(80%),根据切除的肿瘤大小或未切除肿瘤的影像学大小,范围为0.6至6.4厘米(平均值=2.9厘米)。PET上的标准摄取值(SUV)范围为2至21.6(平均值=9.8)。在有可用分期信息的10例病例中,5例为III/IV期。9名患者的样本类型为活检或FNA,4名患者为原发性肿瘤切除,1名患者为转移性脑瘤切除。
表2 患者临床特征和放射学特征
2 组织学和免疫组化特点
形态学上
① 所有肿瘤均为低分化非小细胞肺癌(NSCLC)。6例(43%)具有基底细胞样特征(图1),而其余由嗜酸性细胞质的细胞组成,类似于非角化鳞状细胞癌(图2)。在两例(14%)中发现局灶性角化(微小区域,<1%的肿瘤)。
② 半数病例为局灶性至广泛性坏死。在所有病例中均未发现明确的腺癌结构模式(腺泡、乳头状、微乳头状)。
IHC
① p40和TTF1标记平均86%和82%的肿瘤细胞(表3)。在大多数病例下,标记物为强阳性。在所有情况下,TTF1和p40在连续切片中标记相同的细胞群。
② 除1例外,其他均为CK5/6阳性,在大多数病例中具有强而弥漫的标记。
③ 5/13例中NapsinA显示1-40%肿瘤细胞(平均=15.2%)局灶阳性。在3/12例(25%)中发现了粘液卡红的局灶性细胞质标记,其中2例也有NapsinA标记。总的来说,在13例病例中有6例(46%)检测到了NapsinA或粘液卡红标记。一个病例显示局灶性角化,并标记了NapsinA和粘液卡红(图3)。
④ CK5/6和NapsinA的标记在TTF1/p40双阳性肿瘤区域同时发生。
⑤ 此外,对一部分病例的神经内分泌标志物突触素(n=8)、嗜铬粒蛋白A(n=8)和INSM1(n=3)进行了分析,结果均为阴性。相反,CD56在4/6例(67%)呈阳性(局灶性至弥漫性)。
⑥ 为了确保TTF-1/p40的双重表达不是任意的多表型标记谱的反映,作者对选定的病例进行了其他转录因子的标志物检测,包括PAX8(6例)和CDX2(7例),均为阴性。
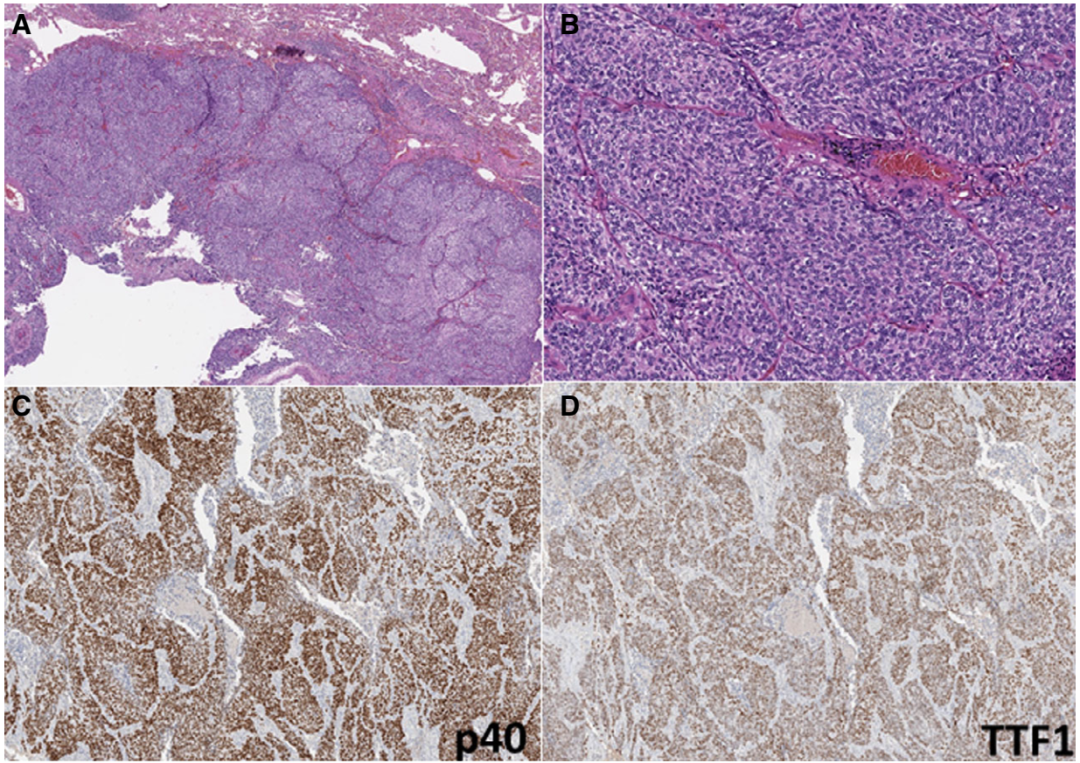
图1 TTF1/p40共表达的肺癌的代表性病例,表现出基底细胞样特征。低倍(A)显示具有基底样特征的片状和大的肿瘤巢。高倍(B)显示分化差的肿瘤缺乏鳞状或腺样结构,排列成实性的巢状。p40(C)和TTF1(D)的免疫组织化学(IHC)显示强烈和弥漫的核标记。
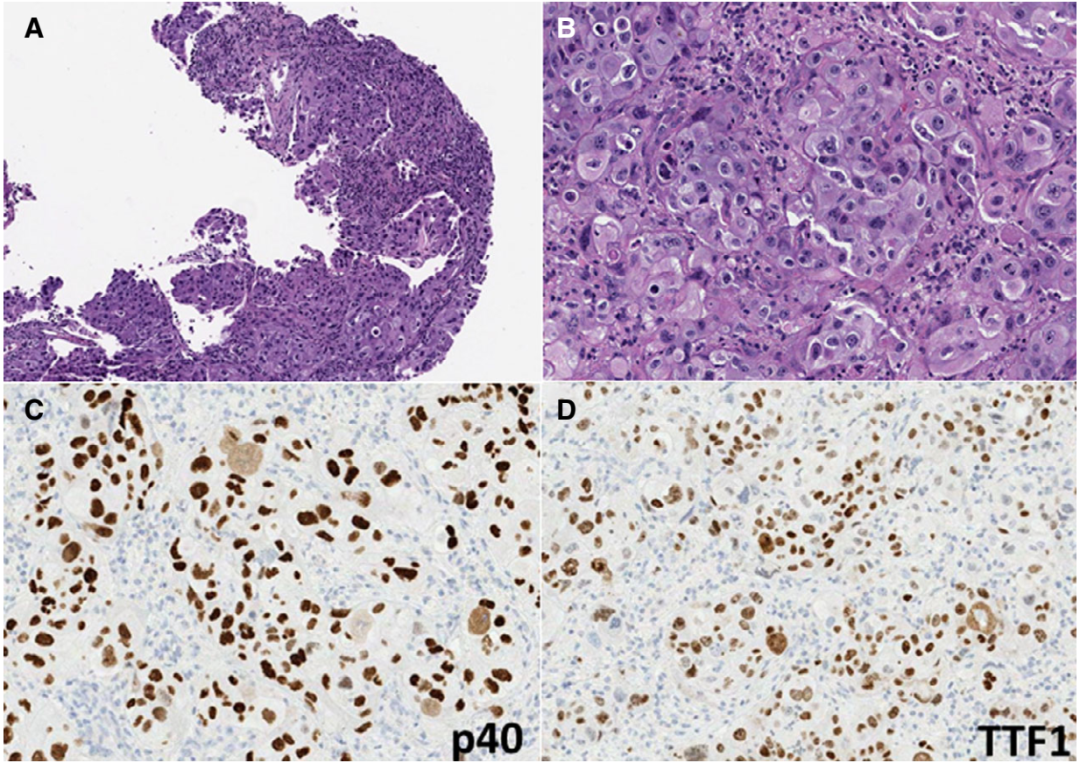
图2 TTF1/p40共表达且无基底细胞特征的肺癌代表性病例。排列成片状、巢状和单细胞的低分化嗜酸性细胞癌的 低倍(A)和高倍(B)。p40(C)和TTF1(D)均为弥漫性阳性。
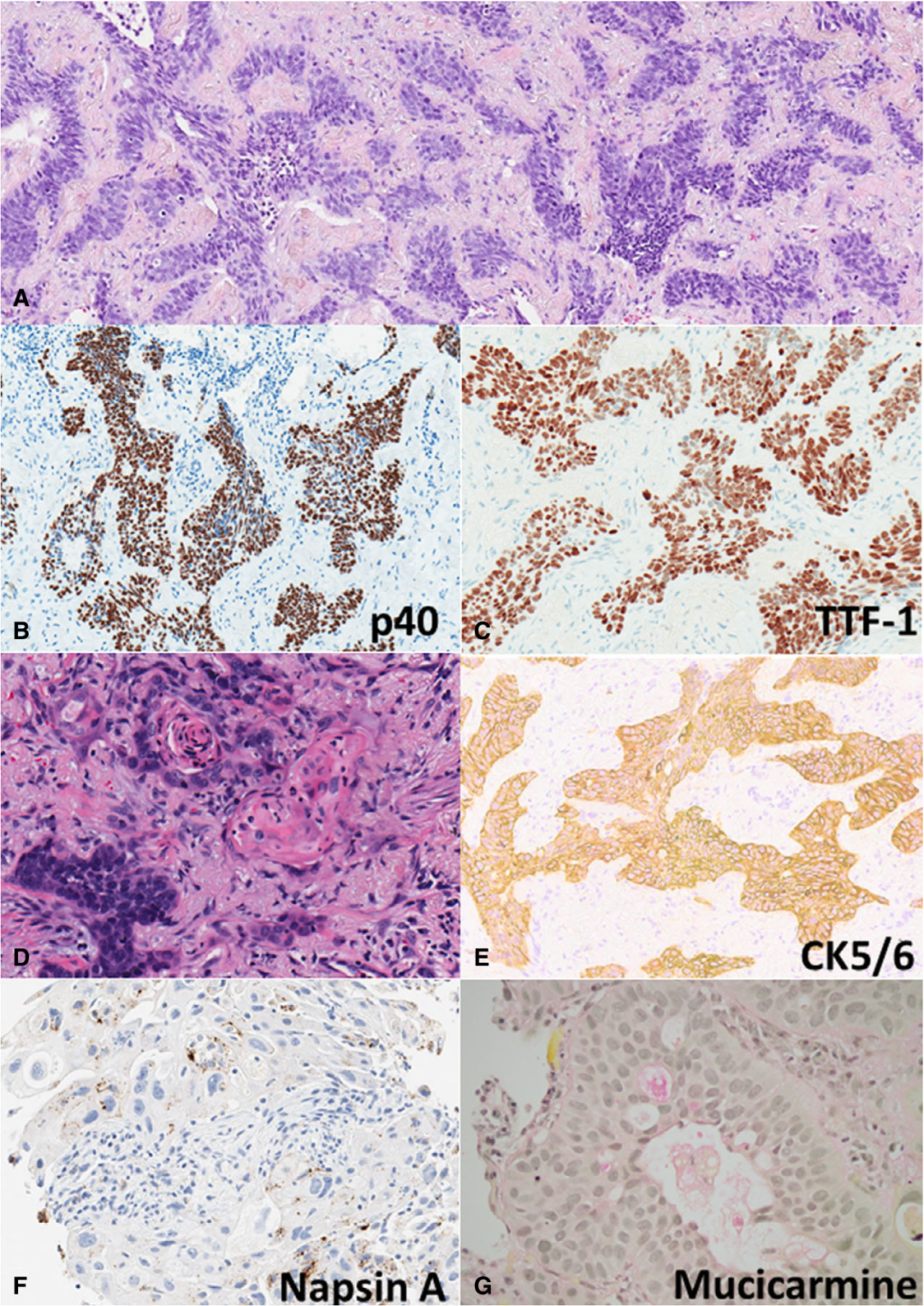
图3 显示鳞状和腺双重分化的病例。低倍(H&E)(A)显示基底细胞分化癌,其对p40(B)和甲状腺转录因子1(TTF1)呈弥漫性阳性(C)。肿瘤在高倍镜下显示出微小的角化灶(D),CK5/6的弥漫性标记(E),NapsinA的局灶性标记(D)和粘液卡红的局灶胞浆内标记(E)。
表3 组织病理学和免疫组织化学特征
3 NGS
如图4,对8例患者进行了NGS,其中7例使用MSK-IMPACT进行了综合NGS分析(最多测试468个癌症基因),1例使用SLIMampTM平台进行了分析(测试了9个癌症基因)。在MSK-IMPACT分析的病例中,非同义体细胞突变的数量平均为每个病例14.5个(范围=9-34)。平均肿瘤突变负荷(TMB)为11.6 mut/Mb(范围=8.9–18.1),高于LUAD(平均=4.9;P<0.01),但与LUSC相当(7.9 mt/Mb;P=0.09)。使用微卫星不稳定性评分(范围=0.97–4.55)。复发突变基因包括TP53(7/7,100%)、CDKN2A(1/7,43%)和KRAS(2/7;25%)。两个KRAS突变均为G12C。染色质修饰基因也有突变(KMT2D n=2,KMT2A n=1,ARID2 n=1和DNMT3A n=1);这些变化的速率与LUSC和LUAD中的变化速率相似。复发性拷贝数改变包括FGFR1扩增(5/7,71%)、MYC扩增(3/7,43%)和AKT1扩增(2/7,29%)。在两个病例中扩增了编码TTF1的NKX2.1基因。FGFR1扩增与KRAS突变共发生1例,与NKX2-1扩增共发生2例。最后,通过SLIMampTM分析的单个病例携带EGFR外显子20插入(N771-H773dup)(见讨论)。该突变发生在该队列中唯一从不吸烟的患者身上。
将TTF1/p40共表达癌的突变分布与作为MSK-IMPACT临床测序队列的一部分分析的传统LUAD(n>9k)和LUSC(n>1K)中的突变分布进行比较(图4,右图)。这表明,该队列中FGFR1的扩增率(71%)显著高于LUAD(0.7%,P<0.0001)或LUSC(11%,P<0.001)。MYC和AKT1的扩增率也明显高于LUAD或LUSC。TP53和CDKN2A突变显著高于LUAD,而KRAS突变和NKX2-1扩增显著高于LUSC。在LUAD或LUSC中,FGFR1扩增与KRAS突变或FGFR1放大与NKX2-1扩增的共发生极为罕见(综合比率分别为0.15和0.11%)。
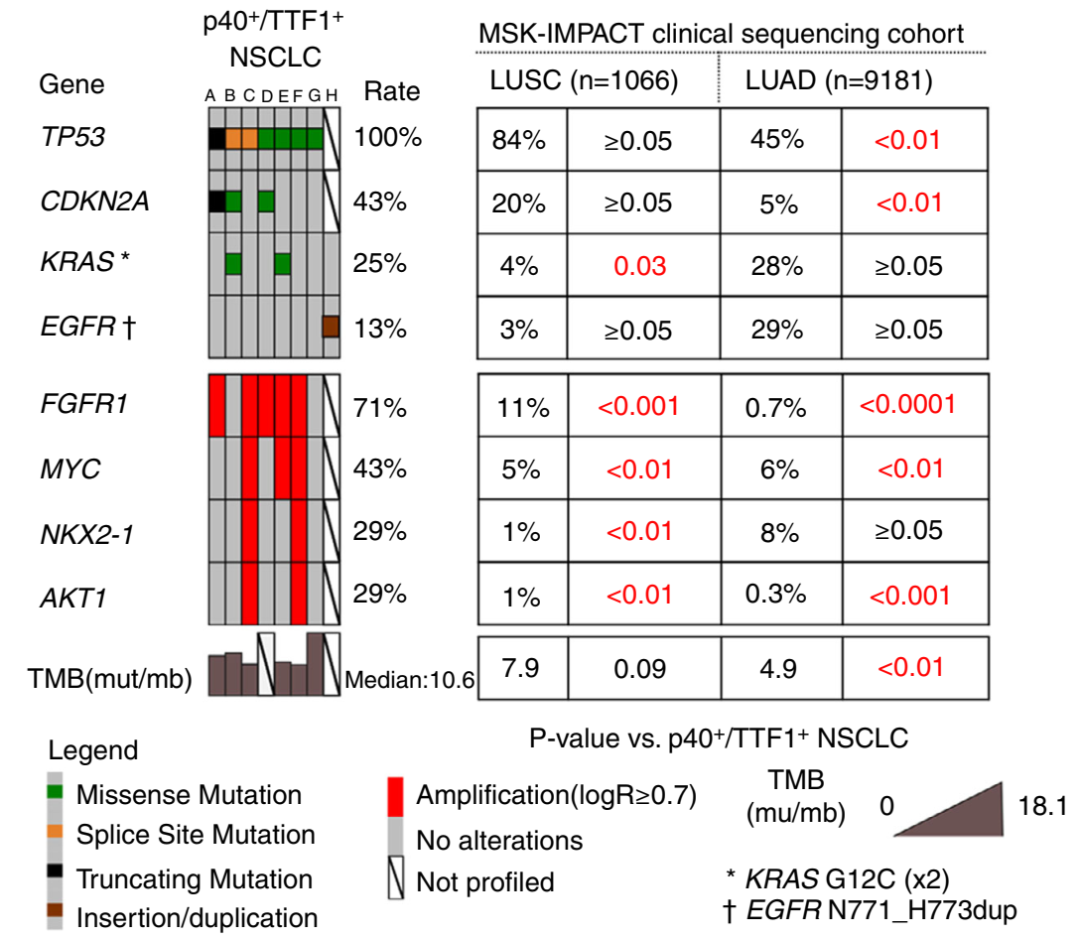
图4 OncoPrint通过MSK-IMPACT(A-G)和SLIMamp(H)描述了TTF1/p40共表达的肺癌的突变(上图)和拷贝数变化(下图)。在MSK-IMPACT临床测序队列中,将变化率与肺鳞状细胞癌(LUSC)和肺腺癌(LUSC)中检测到的变化率进行比较(见方法)。OncoPrint中的病例指定与病例ID的对应关系如下:A、病例13;B、病例8;C、病例3;D、病例1;E、病例2;F、病例6;G、病例12;H、病例14。TMB:肿瘤突变负担。
4 临床随访
如表4所示,8名患者的临床随访期为1.3至55个月;其余病例的临床随访信息不可用。总的来说,在8名患者,5例有转移(3例远处转移,2例涉及胸或锁骨上淋巴结或胸膜)。远处转移累及脑、肝、肾上腺、骨等部位。在8名接受随访的患者中,4人死亡(3人死于疾病,1人死因不明)。在最后一次随访时,另外三名患者还存活,一名患者在原发肿瘤切除后没有疾病迹象。
表4 临床随访
03 讨 论
TTF1和p40的弥漫性共表达在肺癌中是一种极为罕见的现象。在先前的文献中,仅报道了5例TTF1和p40弥漫性双重表达的病例。表5总结了这些病例的主要发现。在这项研究中,作者介绍了这些不寻常肿瘤的最大队列(n=14)的结果,描述了它们的临床病理和基因组特征,并讨论了它们潜在的组织发生学和分类方法。在目前的研究中,作者证实了先前病例报告中的一些观察结果,但也大大扩展了这些不寻常肿瘤的组织病理学、免疫组织化学、分子和临床特征。
首先,在病理水平上,作者证实TTF1/p40共表达肿瘤是低分化的非小细胞肺癌,总体外观类似于非角化鳞状细胞癌。作者注意到,这些肿瘤中有很大一部分(43%)表现出基底样特征,少数病例(14%)表现出微小的角化灶。事实上,在大多数情况下,鳞状细胞分化是由CK5/6的共表达支持的。在任何肿瘤中都没有发现腺样结构,但许多例(46%)表现出napsinA、粘液卡红或两者的局灶性标记,其中一例伴有角化区域。因此,在组织学和标志物表达水平上,许多病例表现出鳞状、腺或双重分化的证据。NapsinA标记在先前报道的TTF1/p40双阳性肺癌病例中未进行检测,并且只有一例报道的病例通过阿辛蓝检测粘蛋白的存在(见表5);在作者的研究中频繁标记NapsinA和粘液卡红为TTF1/p40双阳性肿瘤的真正外分泌分化提供了新的支持。
其次,在这项研究中,作者对8个肿瘤进行了NGS,作者证实在其中一些肿瘤中存在主要的LUAD型驱动突变,在作者的队列中包括KRAS G12C突变(n=2)和EGFR外显子20插入(p.N771_H773dup;n=1),这是一种已知的活化和靶向EGFR突变。总体而言,8个肿瘤中有3个(38%)存在主要的LUAD型驱动因素改变。这与先前报道的TTF1/p40共表达肺癌中EGFR/KRAS突变的比率相似(2/5;40%)(表5)。这一发现的主要含义是,鉴于靶向治疗对携带这种致癌驱动因素的肿瘤的重要作用,具有双重TTF1/p40表达的NSCLC应接受LUAD型驱动因素改变的分子测试。另一个主要的新分子发现是FGFR1在这些肿瘤中的独特高扩增率(71%)。FGFR1扩增在LUSC中最常见(11%),在LUAD中仅罕见(0.7%);与LUAD和LUSC两者相比,TTF1/p40双阳性肿瘤中的比率显著增大。FGFR1的高扩增率可能为这些肿瘤的靶向治疗提供了一种独特的方法,因为酪氨酸激酶抑制剂(如埃达非替尼)对FGF/FGFR信号轴的抑制被证明是治疗不同肿瘤类型(包括NSCLC)的有效方法。
总体而言,TTF1/p40共表达癌存在高比率的FGFR1扩增、TP53突变、CDKN2A突变和TMB具有与LUSC相似的基因组特征,但与LUAD型改变(KRAS、NKX2-1)相结合。FGFR1扩增与LUAD型改变(如KRAS或NKX2-1)的结合可能是双表型肿瘤的重要的发病机制。同样令人感兴趣的是双重阳性癌中AKT1和MYC扩增率的升高。AKT和MYC先前被认为是谱系可塑性的驱动因素,并且这些因子被特异性地鉴定为LUAD的鳞状细胞分化的介质。因此,这些基因的扩增可能有助于诱导该肿瘤的双重表型。
临床上,尽管可供随访的病例数量有限,但作者证实了TTF1/p40双表达肺癌的侵袭性,因为大多数患者表现为III/IV期疾病,并表现出转移性疾病。尽管存在侵袭性表现,但考虑到这些肿瘤中TMB升高,可能对免疫治疗表现出更高的敏感性。本研究的局限性包括缺乏对一些患者的临床随访和缺乏治疗反应数据;因此,需要进一步的研究来阐明这些患者的预后和治疗敏感性。
LUAD中散在的肿瘤细胞p40局灶性标记并不罕见。3-16%的LUAD中发现p40标记(1-5%的肿瘤细胞)。作者遇到了具有更高比例的p40标记的肿瘤细胞的LUAD(N.R.,个人观察)。然而,p40与TTF1一起弥漫表达的现象是一个特殊的发现,在本研究中,所有病例均使用更特异的TTF1抗体(克隆8G7G3/1)进行分析,因SPT24和SP141抗体特异性较低,因此双阳性癌的标准应仅限于更特异的8G7G3/1 TTF1克隆。在所有病例中,TTF1/p40双阳性肿瘤的神经内分泌标志物(突触素、嗜铬粒蛋白A、INSM1)始终呈阴性,并且它们缺乏神经内分泌形态学特点。然而,大多数肿瘤(67%)表现出从局灶到弥漫的CD56标记。CD56非特异标记是一种众所周知的现象,在具有基底细胞特征的LUSC中特别常见。
关于潜在的组织发生,作者假设TTF1/p40的双重表达可能与细支气管基底细胞的表型有关,如Chang等人先前所示,细支气管基底细胞可能共表达TTF1和p40,如图5所示。这可能表明TTF1/p40双阳性肿瘤要么源于双阳性基底细胞,要么向该表型分化,可能是激活的FGFR1信号传导与LUAD型驱动因素相结合的结果。
TTF1/p40双阳性NSCLC的最佳分类是什么?目前,世界卫生组织(WHO)的胸部肿瘤分类建议,无形态分化但表达TTF1或p40的非小细胞肺癌分别归类为LUAD和LUSC。
缺乏TTF1和p40表达的NSCLC被指定为NSCLC,非特指(NOS;在活检中)或大细胞癌(在切除标本中)。腺鳞癌被定义为具有不同LUAD和LUSC细胞群的肿瘤,每种细胞群都具有LUAD(TTF1,NapsinA)或LUSC(p40,CK5/6)的常规免疫特征。本文所述的癌与传统腺鳞癌不同,因为它们在相同的细胞水平上表现出双谱系分化。由于其独特的表型和潜在的独特组织发生,作者建议将TTF1/p40双阳性癌在NSCLC分类中指定为一个单独的类别,称为“具有双重表型分化的NSCLC”。
最后,作者注意到TTF1/p40共表达可能发生在常规NSCLC以外的不寻常肺部肿瘤中。作者最近描述了一例基底细胞样单形性肿瘤,其支气管内乳头状成分和侵袭性成分由宽带和巢组成,广泛共表达p40和TTF1,并发现含有DEK:AFF2融合。此外,细支气管腺瘤(也称为纤毛粘液结节状乳头状瘤)可能具有显著的TTF1/p40双阳性基底层。因此,假定源自共表达TTF1/p40的基底细胞或向其分化的肿瘤超出了传统的NSCLC的病理特征和基因组表达谱。
表5 先前报道的弥漫性TTF1/p40共表达病例综述
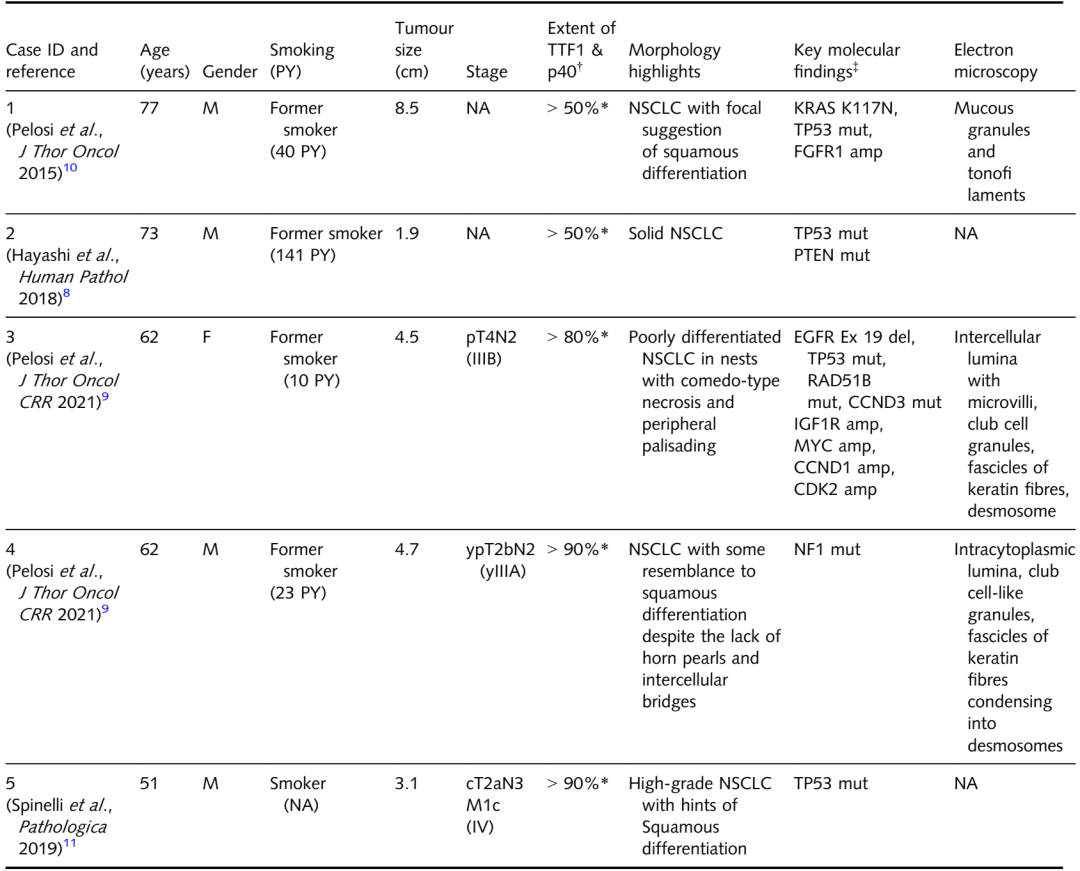
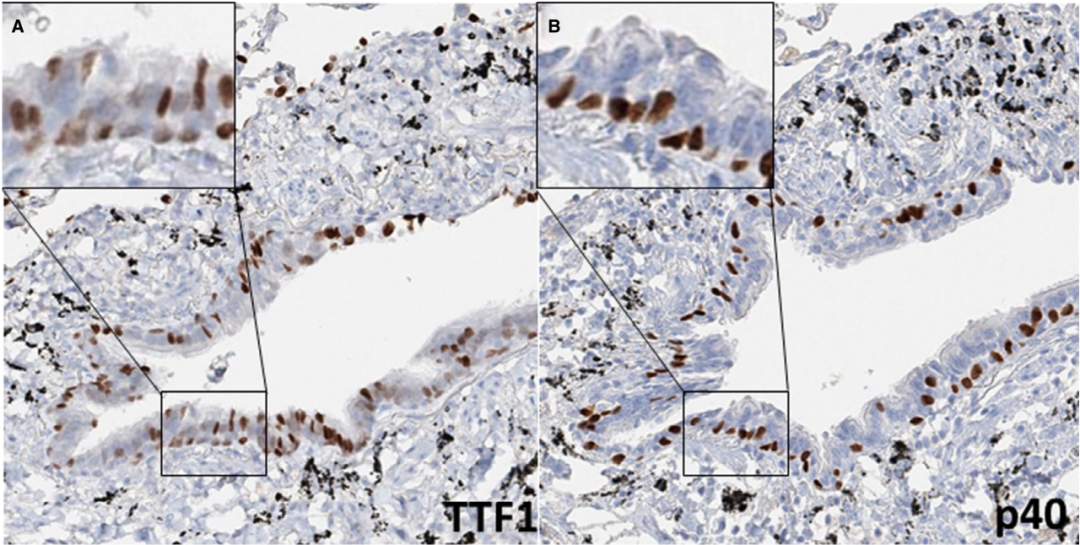
图5 p40和TTF1在正常细支气管基底层的共表达。TTF1免疫组织化学(IHC)在一些基底细胞和管腔细胞中显示局灶性标记(A)。p40在所有基底细胞中显示出一致的标记(B)。
本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
(2023) Histopathology 82, 242–253. https://doi.org/10.1111/his.14801
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言