【重磅】75%客观缓解率!BRAF抑制剂康奈非尼联合MEK抑制剂比美替尼治疗BRAF V600E突变非小细胞肺癌获美FDA批准!
2023-10-23 全球好药资讯 全球好药资讯 发表于上海
此次的获批为这类非小细胞肺癌患者带来了一种新的治疗选择。
2023年10月11日,美国食品药品管理局(FDA)批准BRAF抑制剂康奈非尼联合MEK抑制剂比美替尼用于治疗经FDA批准的测试检测为BRAF V600E突变的转移性非小细胞肺癌(NSCLC)的成人患者。
在非小细胞肺癌中,BRAF基因突变率为1.5%~3.5%;BRAF V600约占所有BRAF突变的50%,其中最常见类型为V600E突变。研究表明,BRAF V600E突变的非小细胞肺癌患者对BRAF抑制剂和MEK抑制剂较为敏感,或能从BRAF抑制剂联合MEK抑制剂中获益。
2022年3月25日,BRAF抑制剂达拉非尼联合MEK抑制剂曲美替尼获国家药品监督管理局(NMPA)批准,用于治疗BRAF V600突变阳性转移性非小细胞肺癌患者。这是我国首个批准针对BRAF V600突变阳性转移性非小细胞肺癌的双靶向联合治疗药物。
康奈非尼和比美替尼靶向RAS/RAF/MEK/ERK通路中的两种不同激酶。与单独使用这两种药物相比,康奈非尼和比美替尼联合用药在体外抗BRAF突变阳性细胞系的增殖活性更强。
商品名:Braftovi
通用名:encorafenib(康奈非尼)
靶点:BRAF
厂家:Array BioPharma
美国首次获批:2018年6月
中国首次获批:尚未获批
获批适应症:黑色素瘤、结直肠癌、非小细胞肺癌
规格:75mg*180粒/盒(每盒含2瓶)
推荐剂量:每次450mg,每日一次,联合比美替尼每次45mg,每日两次,直到疾病恶化或出现不可接受的毒性。
储存条件:保存在20°C~25°C
商品名:Mektovi
通用名:binimetinib(比美替尼)
靶点:MEK
厂家:Array BioPharma
美国首次获批:2018年6月
中国首次获批:尚未获批
获批适应症:黑色素瘤、非小细胞肺癌
规格:15mg×180片/瓶
推荐剂量:每次45mg,每日两次,间隔约12小时,联合康奈非尼每次450mg,每日一次,随餐或不随餐服用;对于中度或重度肝功能损害患者,建议每次30mg,每日两次。
储存条件:保存在20°C~25°C
临床数据
此次监管机构的决定是基于II期PHAROS试验(NCT03915951)的研究结果。该试验的疗效人群包括59例初治患者和39例既往治疗患者。入组患者的中位年龄为70岁,53%为女性;73%的患者ECOG评分为1;97%的患者为腺癌。全部患者患有转移性疾病,8%在基线时有脑转移。
试验的关键疗效结果指标包括RECIST v1.1标准的客观缓解率(ORR)和独立审查委员会评估的缓解持续时间(DOR)。
根据RECIST v1.1标准,在初治患者(n=59)中,康奈非尼联合比美替尼方案的客观缓解率(ORR)为75%(95%,置信区间:62%~85%),其中完全缓解率(CR)为15%,部分缓解率(PR)为59%。此外,中位缓解持续时间(DOR)无法评估(NE);75%的患者有至少6个月的DOR率,59%的患者有至少12个月的DOR。
在既往接受过治疗的患者(n=39)中,康奈非尼联合比美替尼方案的ORR为46%(95%,置信区间:30%~63%),其中CR率为10%,PR率为36%。此外,中位DOR为16.7个月,分别有67%和33%的患者经历了持续至少6个月或12个月的DOR。
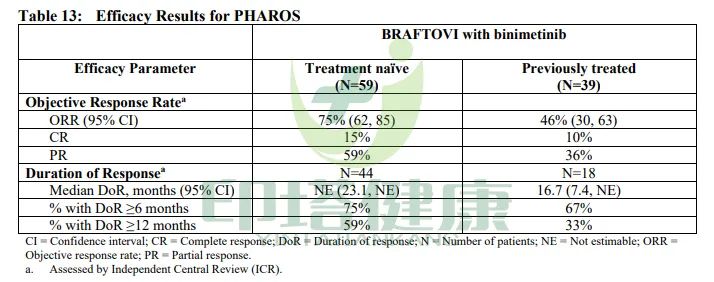
图注:康奈非尼联合比美替尼治疗BRAF V600E突变肺癌的临床数据
不良反应
在该试验中,最常见的任何级别不良反应包括:疲劳(61%)、恶心(58%)、腹泻(52%)、肌肉骨骼疼痛(48%)、呕吐(37%)、腹痛(32%)、视力障碍(29%)、便秘(27%)、呼吸困难(27%)、皮疹(27%)、咳嗽(26%)。
最常见的3/4级不良反应包括:疲劳(8%)、呼吸困难(8%)、腹泻(7%)、肌肉骨骼疼痛(4.1%)、恶心(3.1%)、皮疹(3.1%)、呕吐(1%)、腹痛(1%)、视力障碍(2%)。
在接受康奈非尼联合比美替尼治疗的38%的患者中观察到严重的不良反应,包括出血(6%)、腹泻(4.1%)、贫血(3.1%)、呼吸困难(3.1%)、肺炎(3.1%)、心律失常(2%)、装置相关感染(2%)、水肿(2%)、心肌梗死(2%)、胸腔积液(2%)。
小结
该试验结果表明,康奈非尼联合比美替尼的组合疗法在初治和既往接受过治疗的BRAF V600E突变转移性非小细胞肺癌患者中均显示出抗肿瘤活性。而此次的获批为这类非小细胞肺癌患者带来了一种新的治疗选择。
参考来源:
https://www.braftovimektovi.com
https://www.fda.gov
https://www.accessdata.fda.gov
https://www.onclive.com

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言