ATVB 柯越海/毛威/程洪强合作揭示蛋白酪氨酸磷酸酶SHP2抑制动脉粥样硬化进展的机制
2023-11-16 论道心血管 论道心血管 发表于上海
研究揭示了SHP2调控动脉粥样硬化的作用机制。
动脉粥样硬化性心血管病(ASCVD)是我国第一大疾病负担。目前,有很多冠心病患者接受最佳指南推荐治疗后仍存在残余心血管事件风险,其机制多归因于炎症。在动脉粥样硬化(AS)的病理过程中,内皮细胞功能失调后可促进脂质内化发生氧化等修饰,刺激驻留巨噬细胞活化和增殖,引发免疫反应,分泌炎症因子招募循环单核细胞进入血管壁,形成长期慢性炎症。巨噬细胞是AS发生发展的必要条件,进一步探讨巨噬细胞在AS中的作用机制可为ASCVD治疗提供新的理论基础。
蛋白磷酸化是一种动态、可逆的蛋白翻译后修饰,其主要由蛋白激酶和蛋白磷酸酶协同调控。SHP2是由PTPN11编码的非受体型酪氨酸磷酸酶,由N端及C端的2个SH2结构域和PTP催化结构域构成。SH2结构域与PTP区域结合,在空间上形成自抑制,处于失活状态。在细胞生长因子等的刺激下,SHP2解除自抑制促进MAPK-ERK等多种信号通路和细胞功能。SHP2在肿瘤中发挥关键作用,因此其抑制剂及其抗肿瘤活性的研究取得很大进展。既往研究表明,SHP2抑制具有显著抑炎作用,但是否能抑制动脉粥样硬化尚不清楚。
2023年11月9日,浙江大学基础医学院柯越海/程洪强课题组和浙江中医药大学毛威课题组合作在Arteriosclerosis Thrombosis and Vascular Biology杂志在线发表题为“Protein tyrosine phosphatase SHP2 in macrophages acts as an anti-atherosclerotic regulator in mice”的研究论文,揭示了SHP2调控动脉粥样硬化的作用机制。

首先,研究人员利用SHP2别构抑制剂SHP099对动脉粥样硬化小鼠进行干预,结果显示SHP2抑制后斑块增多,斑块内坏死核增大,胶原减少。将斑块消化后进行免疫细胞数量分析发现,SHP2抑制剂并不会增加免疫细胞总量在斑块细胞中的占比,但会增加巨噬细胞在免疫细胞中的占比。进一步研究发现,巨噬细胞特异敲除SHP2基因,同样加重小鼠动脉粥样硬化。反之,巨噬细胞过表达SHP2则缓解动脉粥样硬化表型。因此提出观点认为蛋白酪氨酸磷酸酶SHP2是一个抗动脉粥样硬化分子。
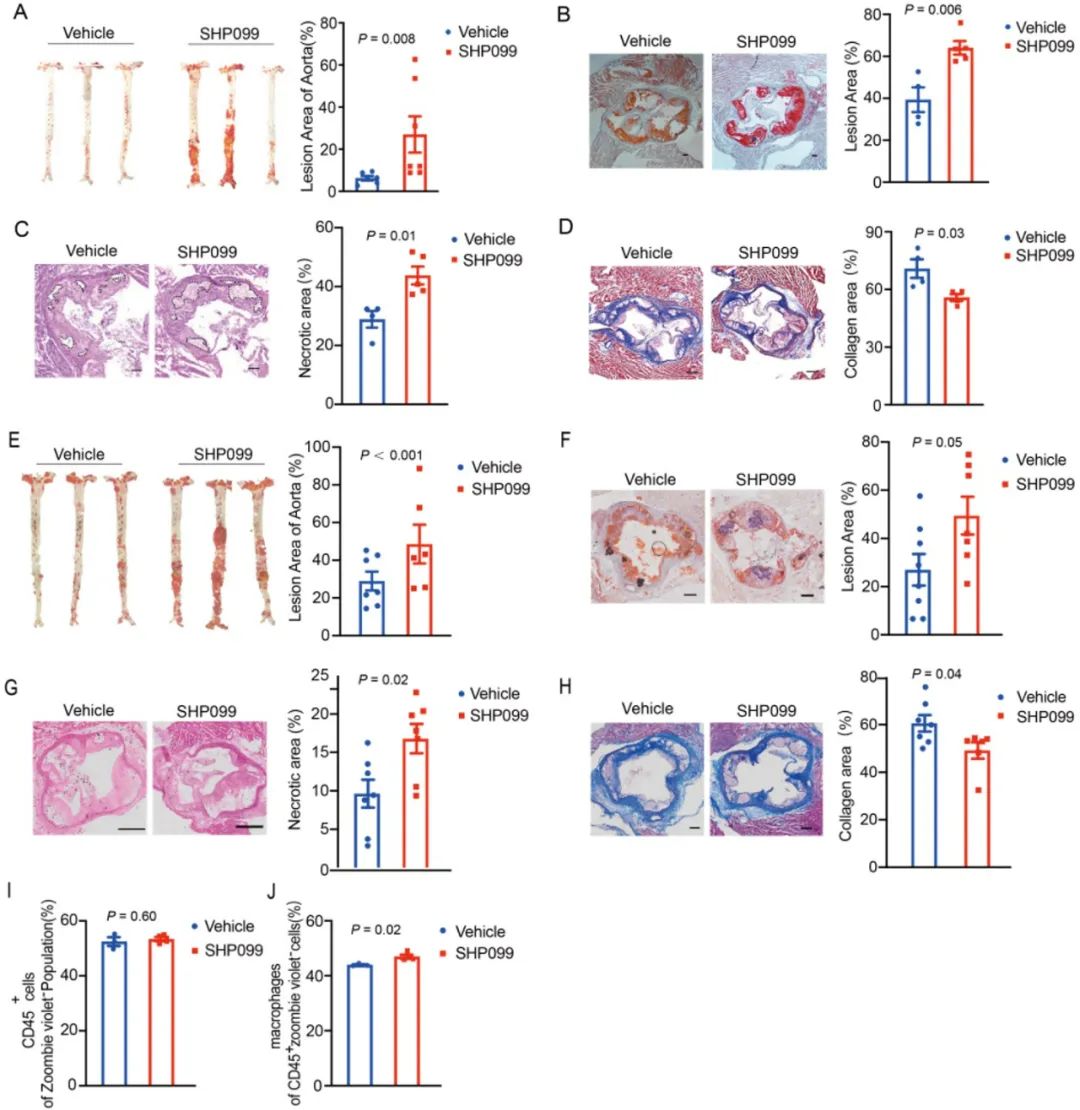
图1. SHP2抑制剂促进AS发生发展
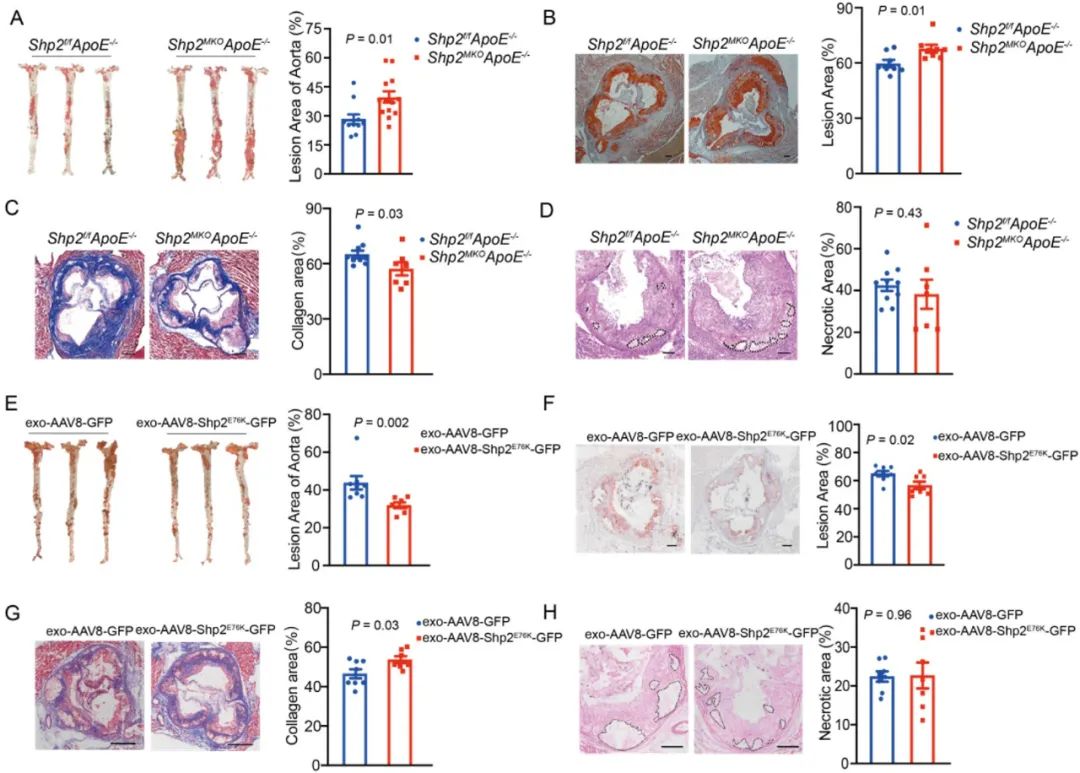
图2. SHP2发挥抗AS作用
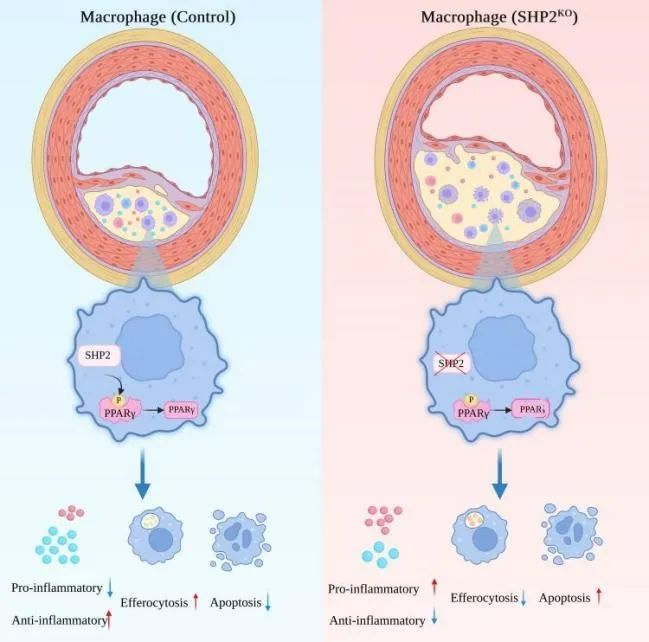
巨噬细胞在斑块主要通过分泌炎症因子、吞噬脂质或凋亡小体参与动脉粥样硬化的发生发展。研究人员进一步分离小鼠腹腔巨噬细胞进行研究,结果显示SHP2缺失或抑制可导致巨噬细胞炎症因子表达分泌增加,胞葬功能受损以及凋亡增加。与以前研究不同,在ApoE缺失等条件下,SHP2表现出抑炎作用。
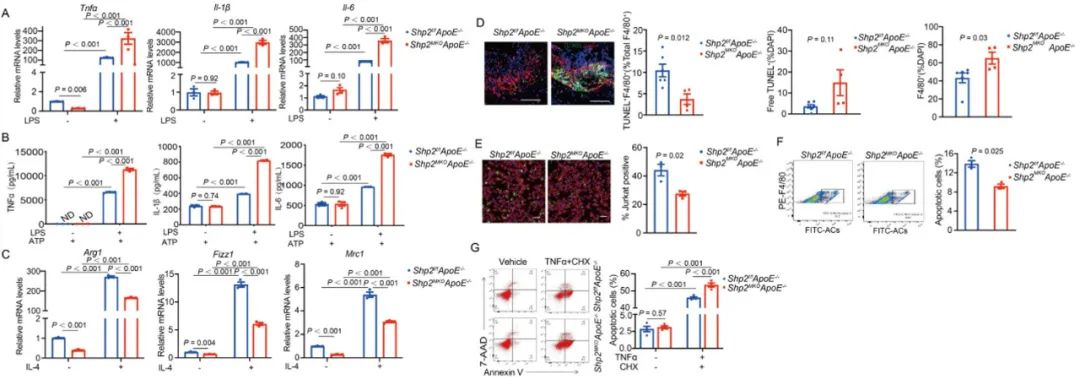
图3. SHP2缺失促进巨噬细胞向M1型极化,减少胞葬功能,增加凋亡
为了探索机制,研究人员分离斑块巨噬细胞进行RNA测序,发现差异基因主要富集于炎症因子响应以及凋亡小体清除相关功能,而KEGG富集于PPAR信号通路。通过上调下调最显著的80个差异基因在3个转录因子数据库中进行预测,得到13个可能调控的转录因子。后续验证发现,SHP2缺失导致PPARγ酪氨酸磷酸化增加,PPARγ蛋白减少。
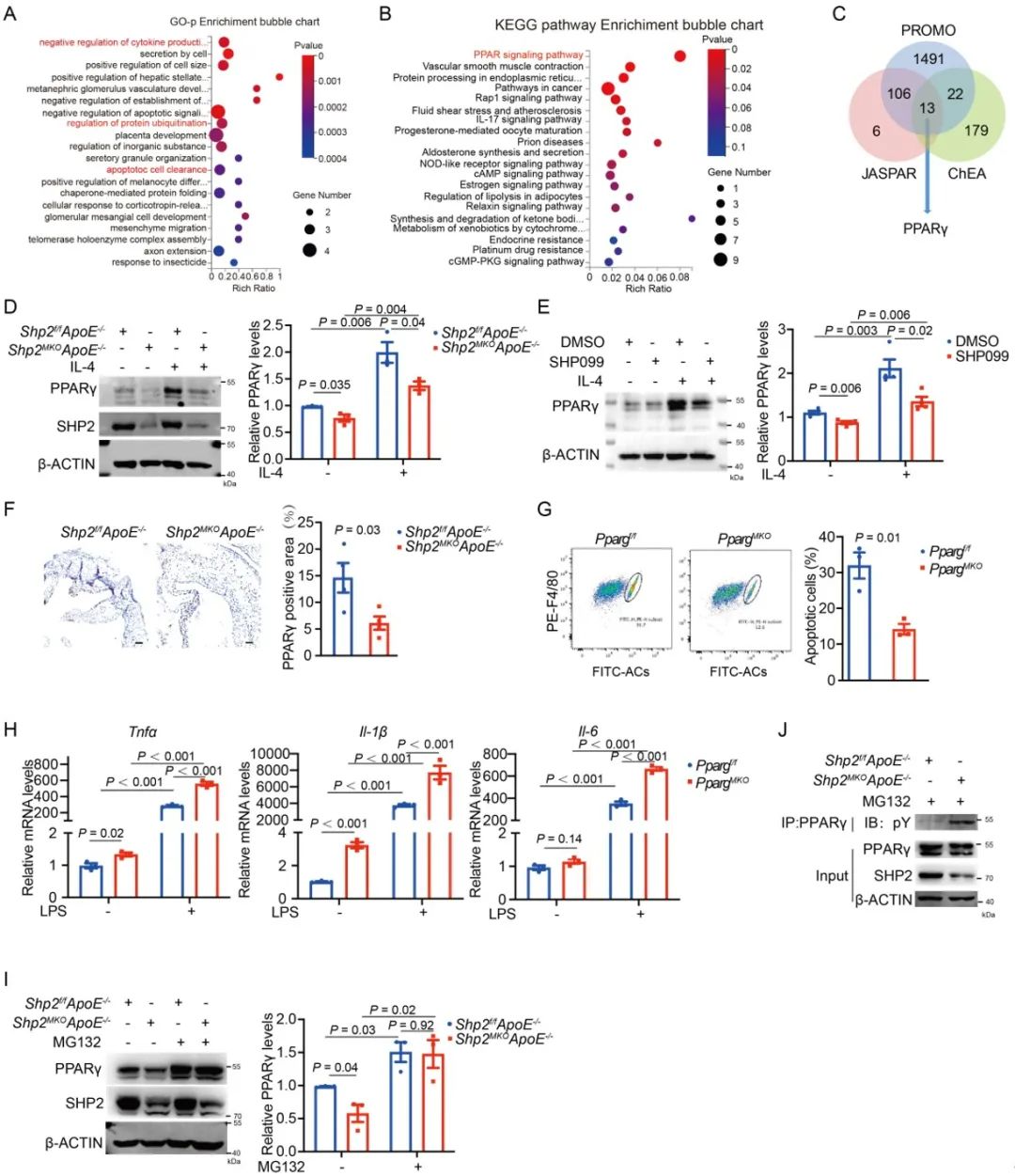
图4. SHP2增加PPARγ蛋白稳定性
PPARγ可抑制巨噬细胞向M1促炎型极化,在AS发生发展过程中发挥保护作用。鉴于SHP2缺失可下调PPARγ表达,研究人员通过PPARγ激动剂吡格列酮干预SHP2缺失小鼠。结果显示,吡格列酮可以部分缓解SHP2敲除小鼠的动脉粥样硬化表型。
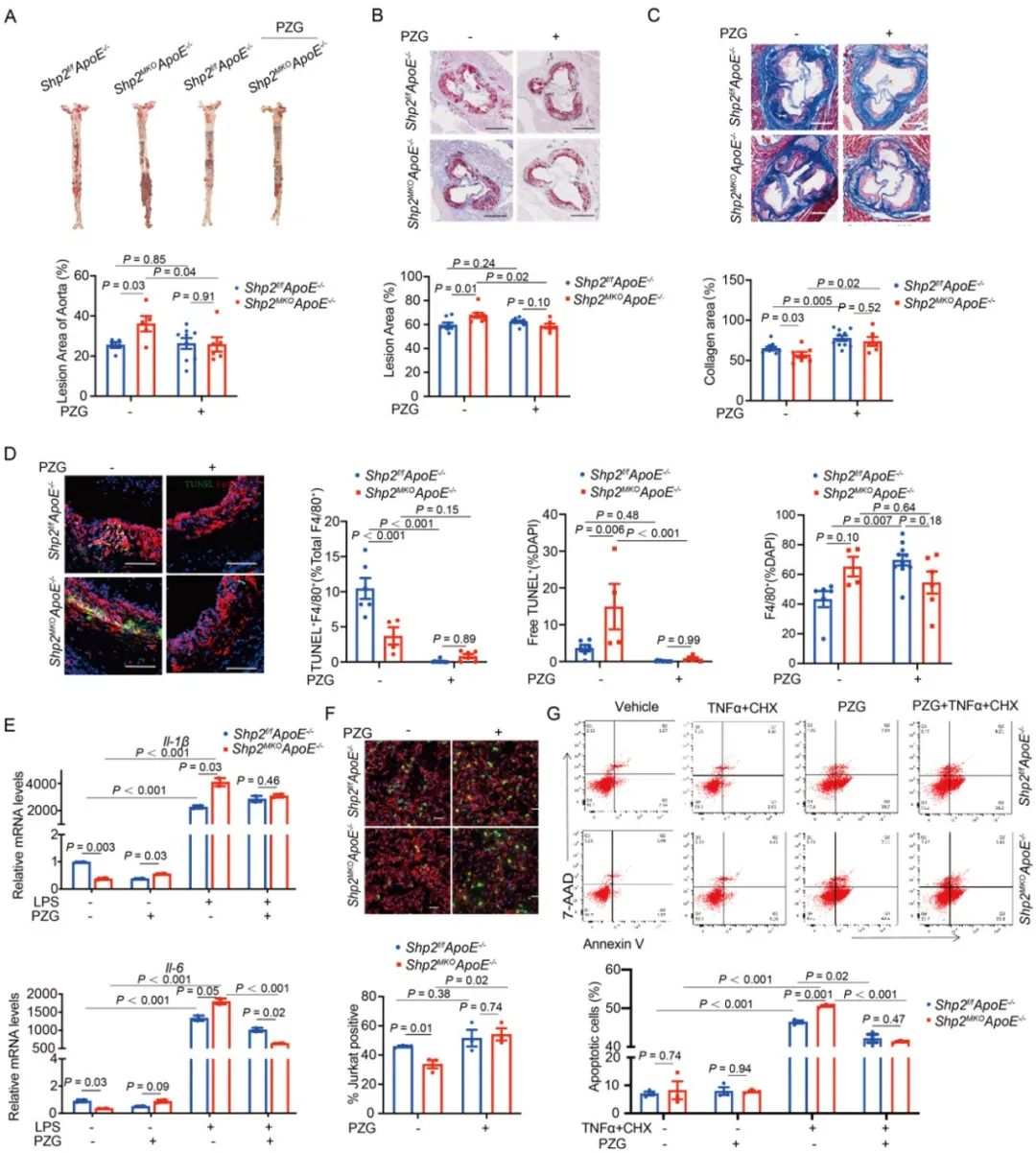
图5. 吡格列酮干预SHP2缺失小鼠后表型得到挽救
最后,研究人员收集人正常动脉和斑块组织进行蛋白印迹检测发现,与正常动脉组织相比,SHP2在斑块组织内表达下调。该结果进一步在公共数据库中得到验证。通过对小鼠主动脉瓣斑块的表征发现,SHP2表达主要集中于巨噬细胞。结合前面的结果,下调的SHP2加重了动脉粥样硬化进展。
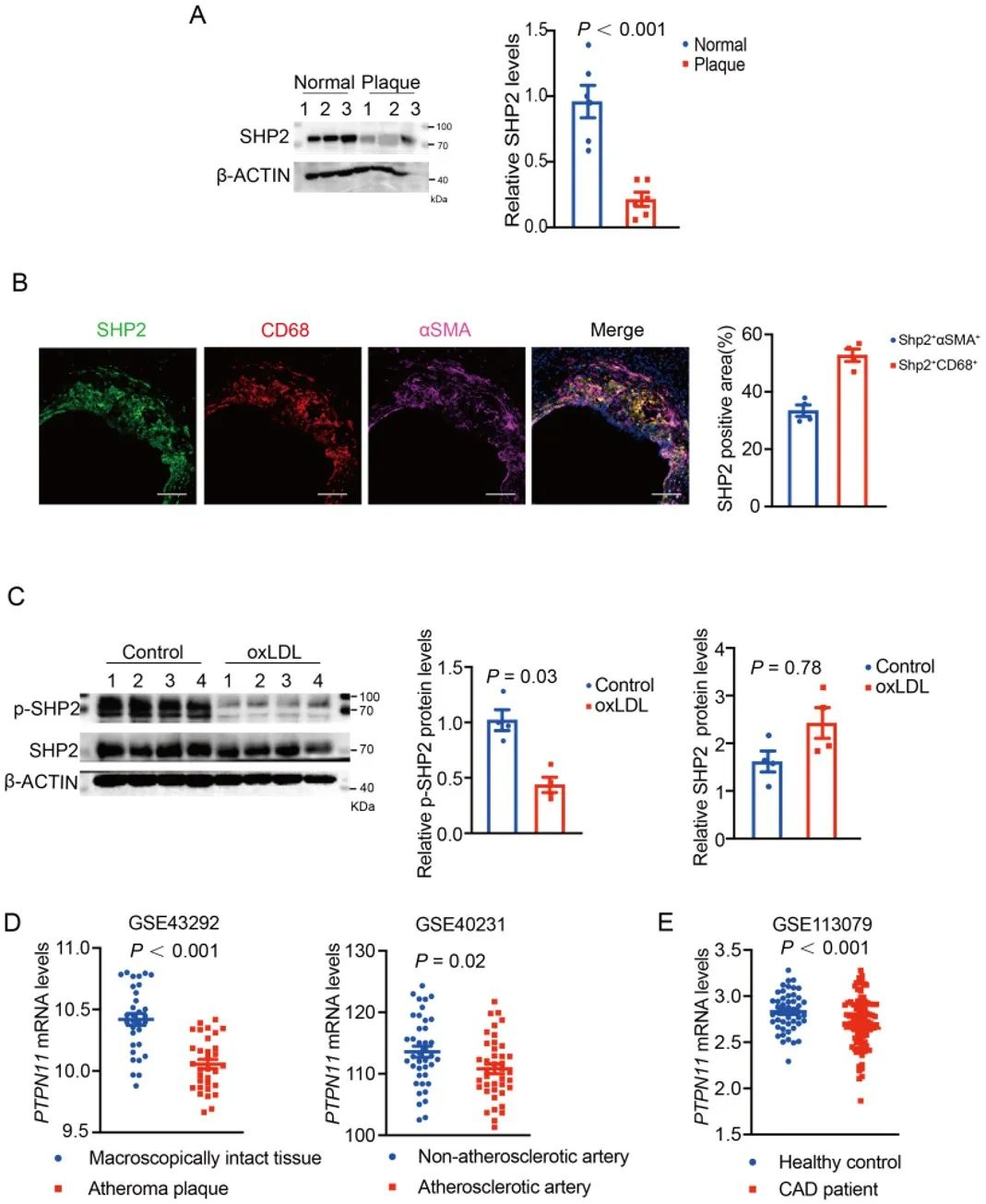
图6. SHP2表达在斑块中下调
综上,本文通过多种方法改变SHP2,结合多种动脉粥样硬化小鼠模型,明确了SHP2是一个抗动脉粥样硬化分子。机制上,SHP2影响PPARγ的磷酸化和稳定性,进而调控巨噬细胞的炎性活化和胞葬功能。需要强调的是,本文提出的SHP2的作用仅表现在ApoE或Ldlr敲除的巨噬细胞。SHP2对巨噬细胞活化的调控为什么出现翻转目前尚不清楚。
浙江中医药大学第一临床医学院博士生吴晨霞和浙江大学基础医学院博士生郑佩瑶为论文的共同第一作者。浙江大学基础医学院柯越海教授、程洪强副教授和浙江大学附属浙江医院毛威教授为共同通讯作者。研究获得了国家自然科学基金的资助。该研究的开展还得到了暨南大学衰老研究所鞠振宇教授、浙江大学附属第一医院血管外科吴子衡主任、浙江中医药大学汪仪教授等老师的指导与帮助。同时感谢浙江大学医学院公共技术平台黄琼、刘双双以及中医药科学院医学科研中心公共平台孙云霞的实验技术指导。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/ATVBAHA.123.319663
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













才知道,实用
32