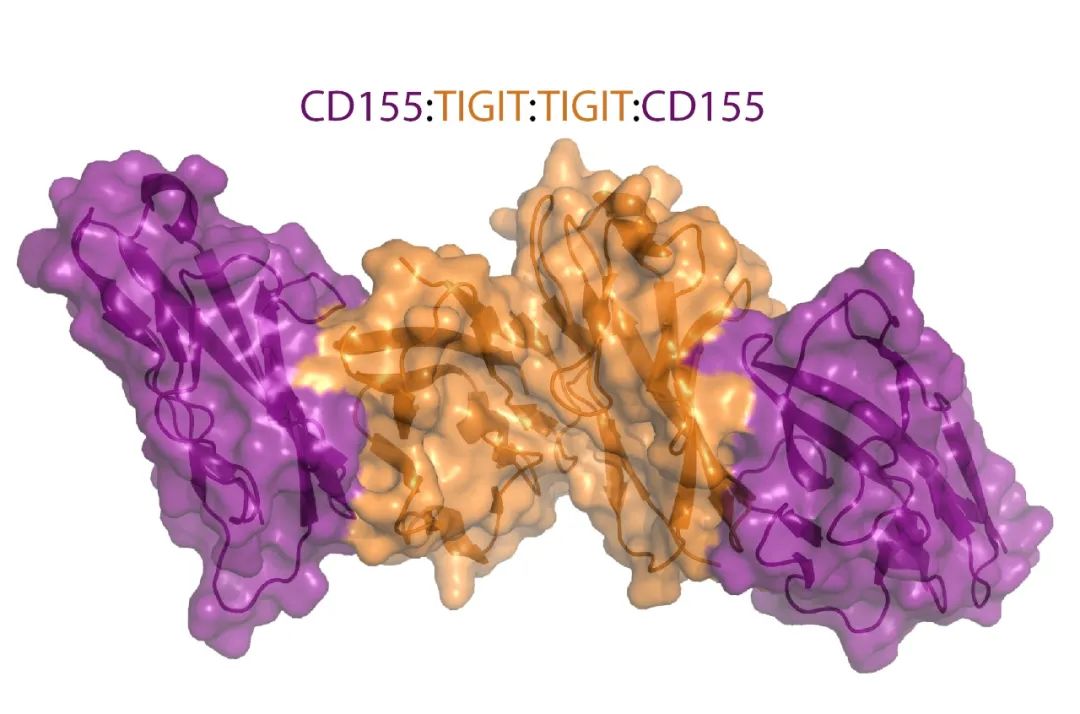
免疫检查点是指免疫细胞表面的一类蛋白质,能调节免疫细胞的活性,以保持免疫系统的平衡。在正常情况下,它能够阻止免疫细胞攻击正常细胞,从而避免自身免疫疾病的发生。然而,某些癌细胞能够利用这些免疫检查点来逃避免疫系统的攻击,从而导致肿瘤的生长和扩散。
-01-
T细胞的共刺激与共抑制
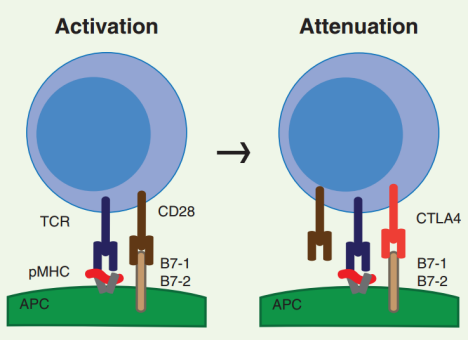
T细胞需要两个信号才能“激活”它们的效应器功能,“信号1”在T细胞受体(TCR)与抗原呈递细胞(APC)表面的主要组织相容性复合物(MHC)结合的抗原相互作用时被激活,这赋予了免疫反应特异性。“信号2”是一种共刺激信号,通过APC表面的B7-1(CD80)或B7-2(CD86)与T细胞表面的CD28结合而介导,如果没有第二次刺激,T细胞将无法被激活增殖和分化。可以说共刺激分子在细胞的免疫应答中扮演了“油门”的角色,它为免疫细胞行使功能提供了动力。
而某些免疫检查点则扮演了相反的角色,它们被俗称为免疫应答的“刹车”,以避免T细胞在杀敌之时因过度兴奋殃及池鱼,使正常细胞遭受无妄之灾。其中PD-1和CTLA-4则是两个相当重要的角色,它们刹车的方法各有不同,但殊途同归。
-02-
双雄:PD1和CTLA4
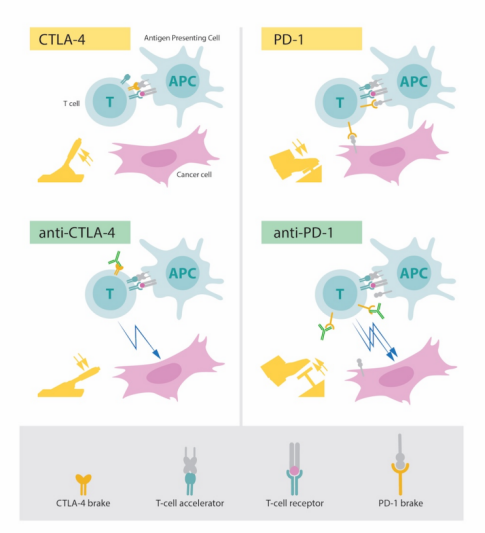
CTLA-4的作用机制:T细胞表面的细胞毒性T淋巴细胞相关抗原4 (CTLA-4)和APCs上的B7-1和/或B7-2之间相互作用。CTLA-4在原始T细胞表面的表达在强抗原刺激下(信号1)上调,由于其与CD28分子同属CD28家族,具有高同源性,可与CD28竞争结合B7-1/B7-2,从而导致抑制性信号传递、T细胞能量不足和凋亡。
PD-1的作用机制:程序性死亡受体-1(PD-1)与程序性死亡配体-1(PD-L1)或程序性死亡配体-2(PD-L2)结合后,PD-1受体将蛋白酪氨酸磷酸酶SHP2募集到免疫受体复合物,导致TCR相关信号分子的去磷酸化和TCR信号减弱;最终结果是T细胞衰竭和保护靶组织免受免疫介导的损伤。
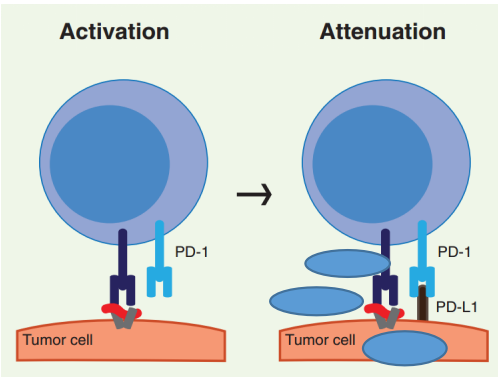
月盈则亏,晦则明。免疫系统也一直以这样一种哲学的姿态遵循着某种平衡规律,直到肿瘤免疫逃逸现象的出现。某些肿瘤细胞能够通过增加自身CTLA-4的表达或PD1/PDL1来抑制T细胞的活性,从而逃避免疫系统的攻击。
基于对PD-1和CTLA-4的研究,科学家们开发出了一类被称为免疫检查点抑制剂的药物,即CTLA-4抗体或PD1/PDL1抗体。通过抗原抗体结合的原理,封闭肿瘤表面高表达的这类蛋白,能够有效阻断PD-1或CTLA-4与其结合,减轻因肿瘤异常表达引起的“刹车”,从而激活免疫细胞对癌细胞的攻击。
-03-
未来之星:LAG-3
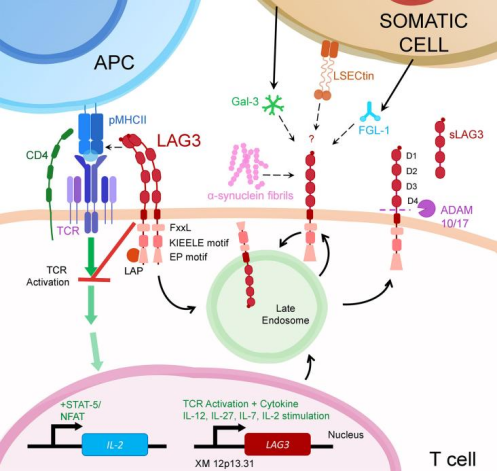
同样作为一种免疫检查点,LAG-3具有抑制其宿主细胞的激活,并通常促进更具抑制性免疫反应的特性。例如在T细胞上,LAG-3减少细胞因子和颗粒酶的产生,同时促进调节性T细胞的分化。
LAG-3 在临床试验研究中仅次于PD-1和CTLA-4。尽管LAG-3早在1990年就被发现,且在免疫治疗中具有相当重要的潜力,但其作用机制方面仍有很多盲点。
MHCII是LAG-3的主要配体。作为 CD4 祖先同源物,LAG-3具有相似的结构,但氨基酸相似性仅为20%。最初人们认为LAG-3抑制机制是由于其与CD4竞争性结合MHCII,因具有共同的进化起源,且LAG-3对MHCII具有更大的亲和力。然而,没有证据表明LAG-3在T细胞激活过程中抑制CD4与配体相互作用。相反,越来越多证据表明CD4的竞争性抑制并不是LAG-3介导抑制的主要且唯一的机制。
- 证据1:LAG3与MHCII结合不依赖竞争机制。有研究小组发现只有TCR不参与的前提下,才能观察到LAG3抑制CD4与MHCII的相互作用。就是说TCR的参与可能会增强CD4对MHCII的亲和力,或改变结合特性,使LAG-3不阻断CD4与MHCII结合。
- 证据2:其他配体的发现。除MHCII外,LAG-3还与FGL-1、α-突触核蛋白原纤维 (α-syn) 、凝集素 galectin-3 (Gal-3) 以及淋巴结窦内皮细胞 C 型凝集素 (LSECtin)结合,同样发挥了抑制作用。这些配体并不结合CD4。
- 证据3:有研究表明LAG-3在抑制CD8+T细胞的激活时,其表达水平高于CD4+T细胞,这一事实表明LAG-3即使在不存在CD4的情况下也能发挥作用。
这些证据指向LAG-3的抑制机制更有可能依赖于其细胞内结构域,即胞内信号传导的作用,而非单一的竞争机制。科学家通过对LAG-3胞质结构域的RRFSALE基序、KIEELE基序和C末端的EX/EP重复基序进行基因敲除、突变等操作,得出虽然LAG-3缺乏典型的抑制基序,但仍然需要其细胞内结构域来抑制T细胞活化的结论。
尽管人们尚未摸清LAG-3,但未知的作用机制仿佛充满了无限可能性,其可结合配体的多样性也预示了LAG-3终究会成为研究免疫检查点药物方面的“未来之星”。
未来可期
免疫检查点抑制药物从2011年首个CTLA4相关的Y药(yervoy,Ipilimumab)获FDA批准上市,到PD1/PDL1相关的O药(Opdivo,nivolumab)、K(Keytruda,pembrolizumab)、T药(Tecentriq,Atezolizumab)等,再到PD-1抑制剂纳武利尤单抗+ CTLA-4抑制剂伊匹木单抗(“O药+Y药”)联合疗法的获批,科学家对其认知也越来越深入、客观、理智。
2022年LAG-3抑制剂Relatlimab联合纳武利尤单抗固定剂量组合Opdualag的上市,可以判断联合用药治疗策略将成为未来新趋势。
参考资料:
[1]Spencer C. Wei, Colm R. Duffy, and James P. Allison,Fundamental Mechanisms of Immune Checkpoint Blockade Therapy.Cancer Discovery. 2018 August. doi:10.1158/2159-8290.CD-18-0367.
[2]Colin G. Graydon,Shifa Mohideen,Keith R. Fowke. LAG3’s Enigmatic Mechanism of Action. Frontiers in Immunology. 2021 January. doi: 10.3389/fimmu.2020.615317.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言