中危AML患者MRD驱动的巩固治疗策略可减少异基因移植且不影响生存
2023-04-24 聊聊血液 网络 发表于上海
中危AML患者MRD驱动的巩固治疗策略可减少异基因移植且不影响生存。
对于中危 AML 患者,最佳缓解后的治疗仍存在争议。MRD评估(通过多参数流式细胞术[MFC]和/或NPM1基因突变的逆转录酶聚合酶链反应[RT-PCR])可以指导治疗决策,因为诱导治疗C2后CR或CRi时的MRD评估具有很强的预后价值和预测复发的能力。因此在该时间点MRD阳性可能需要进行 allo-SCT 作为额外的强化治疗;而移植前MRD阴性的 CR/CRi患者复发风险相对较低,因此可省略allo-SCT。
根据 HOVON-SAKK132 研究(HO132) 方案,中危患者缓解后治疗的选择以MFC(> 0.1%) 和NPM1突变(>10-4) 定义的 MRD 状态作为驱动:MRD阳性患者建议接受allo-SCT,而MRD阴性患者建议进行强度较低的非 allo 治疗(auto-SCT或第三周期化疗)。2021年报告的 HO132 研究分析显示,ELN-2017中危患者的无复发生存期无差异,或可表明MRD驱动治疗策略的积极作用。
为了更好地理解 MRD 驱动的影响,学者详细分析了 HO132 研究中,MRD驱动的中危 AML 或高危 MDS 患者缓解后治疗与治疗结局的关系,包括符合方案分析。作者还使用倾向评分匹配 (PSM) 分析,比较了该 MRD 驱动队列与非MRD驱动队列的结局,后者来自既往的 HOVON-SAKK 研究且没有进行 MRD 驱动的缓解后治疗。分析结果近日发表于《Haematologica》。

研究结果
HO132研究中共有153例 ELN 中危患者达到CR/CRi且 C2 后有 MRD 结果(MFC白血病相关免疫表型检测和/或NPM1突变的RT-PCR),其中110例 (72%) 为 MRD 阴性(通过两种技术),其中44/110例 (40%) 根据方案建议接受了非 allo-SCT 巩固治疗,但也有48/110例 (44%) 患者接受了allo-SCT;另外18例患者 (16%) 未接受巩固治疗,主要是由于早期复发。作者未系统收集偏离建议方案的原因,但与 MRD 阴性非异基因移植巩固治疗患者相比,接受异基因SCT 的 MRD 阴性患者具有显著更复杂的核型 (45.8% vs 4.5%),且 C2 后(而非 C1 后)首次 CR 的频率更高 (33.3% vs 4.5%)。与之相比MRD 阳性患者的方案依从性更好,36/43例 (84%) 接受了符合方案推荐的allo-SCT。
采用无事件生存期 (EFS) 和总生存期 (OS) 的 Kaplan-Meier 曲线分析生存差异,并用Cox回归解释聚类。EFS 定义为 CR/CRi患者的 MRD 评估时间和复发或死亡之间的间隔,结果MRD阳性和阴性患者之间无显著差异(风险比 (HR)=1.24;95%CI,0.75-2.00;p=0.42;图1A),36个月 EFS 分别为47%和54%。对于OS(定义为 CR/CRi患者的 MRD 评估时间和死亡或删失之间的间隔),MRD阳性患者似乎略差(5年 OS 为54%,而 MRD 阴性患者为65%),但无统计学显著性(HR=1.50;95%CI,0.85-2.64;p=0.16;图1B)。
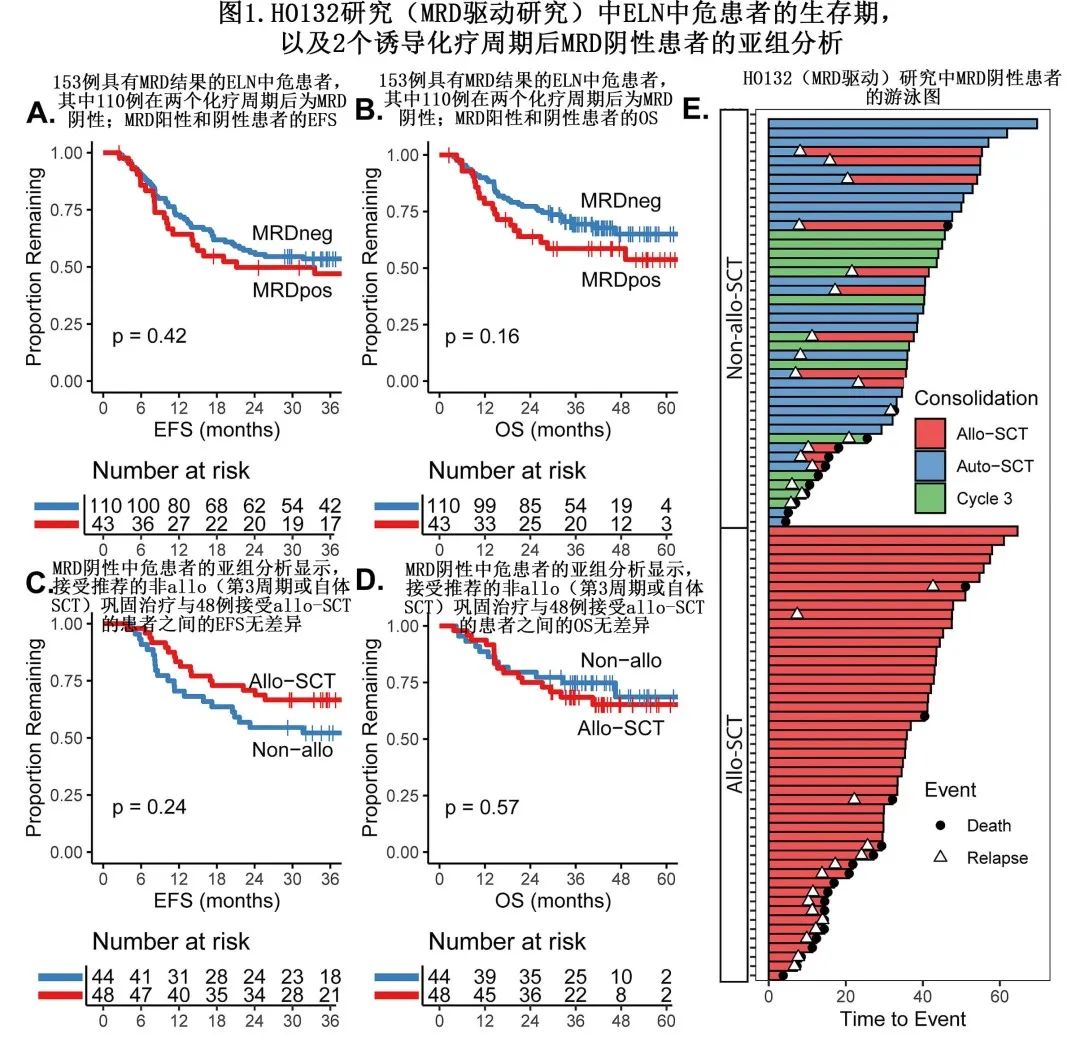
对于 MRD 阴性患者,作者还比较了违背方案接受 allo-SCT 的患者与接受符合方案的非 allo-SCT治疗的患者,结果EFS(HR=0.69;95%CI,0.37-1.29;p=0.24;图1C)和OS(HR=1.24;95%CI,0.59-2.63;p=0.57;图1D)均无明显差异。但接受 allo-SCT 与非 allo-SCT 治疗的 MRD 阴性患者的事件顺序似乎不同:共有15/48例 (31%) allo-SCT 治疗患者在 CR 后3年内复发,其中大多数 (93%,14/15) 在复发后10个月内死亡;尽管非allo-SCT 组中18/44例 (41%) 复发,但12例患者可通过(延迟)allo-SCT成功挽救,随后对10/18例 (55%) 患者进行了长期无白血病随访(图1E)。
由上述数据可见,对于 MRD 阴性患者,32例可以避免allo-SCT,12例可以推迟至复发后,且与接受 allo-SCT 治疗的患者相比并不会对 EFS 和 OS 产生负面影响。因此基于 HO132 研究结果,对于中危 MRD 阴性AML患者,非 allo-SCT 治疗似乎是合理的。
作者比较了HO132研究(2014-2017年开展)中 MRD 驱动的中危患者与HOVON-SAKK 2/3 期研究(2006-2013年开展)中非MRD驱动队列的生存期,两个研究分别纳入110例患者进行匹配,除 MRD 驱动队列核型异常较多外,MRD驱动和匹配对照组之间的所有临床特征相当。对比发现,MRD 驱动组 (54%) 和历史对照队列 (47%) 之间36个月后的 EFS 相当(HR=0.87;95%CI,0.60-1.26;p=0.47;图2A),OS结果也相似,60个月后 MRD 驱动队列的生存率为61%,而非MRD驱动队列为56%(HR=0.80;95%CI,0.52-1.24;p=0.32;图2B)。

在两个队列之间,仅 MRD 阴性患者的首选巩固治疗发生了变化,而MRD阳性患者仍为allo-SCT。HOVON-SAKK 研究中建议所有中危患者接受allo-SCT,而HO132研究中改为建议仅 MRD 阳性患者接受allo-SCT,因此作者分别对 MRD 阴性患者进行了亚组分析,结果显示,MRD驱动和非MRD驱动的MRD 阴性患者之间3年EFS (HR=0.86;95%CI,0.56-1.33;p=0.50) 和5年OS (HR=0.84;95%CI,0.50-1.40;p=0.50) 均无显著差异(图2C-D)。该结果再次表明,中危AML患者进行MRD驱动的巩固治疗选择,可安全的规避 allo-SCT 治疗而不会对 EFS 或 OS 产生负面影响,这与 GIMEMA AML1310 研究既往数据一致。
参考文献
Jesse M Tettero,et al. Measurable residual disease-guided therapy in intermediate-risk acute myeloid leukemia patients is a valuable strategy in reducing allogeneic transplantation without negatively affecting survival.Haematologica . 2023 Apr 6. doi: 10.3324/haematol.2022.282639.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言