Nature子刊:综述:原发性中枢神经系统淋巴瘤
2023-06-21 聊聊血液 聊聊血液 发表于上海
文章总结了免疫功能正常患者 PCNSL 的分子发病机制、诊断、临床行为、预后和治疗,综述了现代神经影像学的作用、诊断生物标志物、眼内和软脑膜疾病的管理以及治疗对认知功能和生活质量的影响。
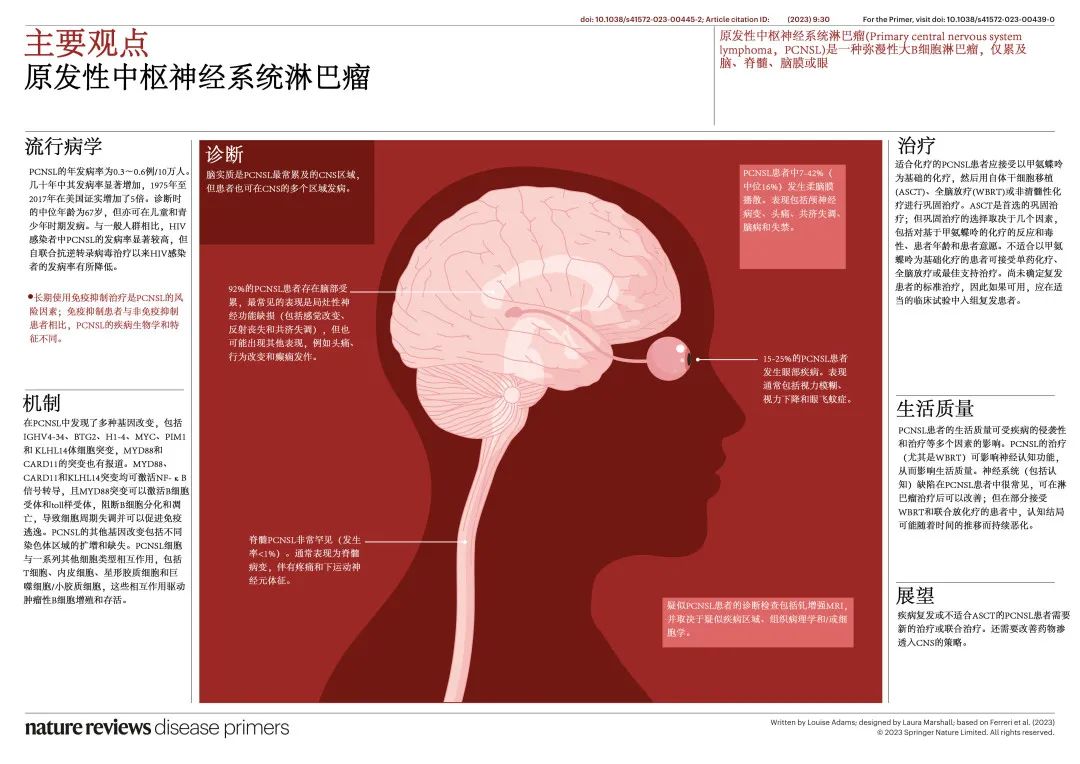
原发性中枢神经系统淋巴瘤(PCNSL)是一种罕见的弥漫性大 B 细胞淋巴瘤 (DLBCL),仅发生于脑、脊髓、颅神经、软脑膜和/或眼睛,脑实质是最常见的部位。PCNSL 发生在于具有结构、生物学和免疫学特征的不同器官中,可强烈影响肿瘤行为以及治疗选择和疗效。PCNSL可导致神经功能和体能状态(PS)的快速损害,对及时诊断造成阻碍。即使诊疗取得了显著进展,PCNSL仍是所有非霍奇金淋巴瘤中预后最差的一种。
Nature Reviews Disease Primers (Q1,IF:65.038)是国际权威杂志Nature系列子刊,主要发表国际权威专家撰写的综述、评论、观点等,近日发表一篇关于PCNSL的综述。文章总结了免疫功能正常患者 PCNSL 的分子发病机制、诊断、临床行为、预后和治疗,综述了现代神经影像学的作用、诊断生物标志物、眼内和软脑膜疾病的管理以及治疗对认知功能和生活质量的影响,还讨论了正在进行的重要临床和生物学研究以及未来试验的终点。整理如下供各位老师参考,内容较长,如有错误请谅解。

流行病学
PCNSL 约占所有原发性 CNS 肿瘤的4%,占所有结外淋巴瘤的4-6%。基于挪威全国人群的研究的年发病率为0.3-0.6例/10万人。从1975年至2017年,美国的发病率增加了5倍;这些数据与其他国家的几项研究一致,但部分国家或地区(例如芬兰)发病率更高。PCNSL 的年发病率因年龄不同而有显著差异;年龄>60岁的患者近过去四十年发病率增长最高,70-79岁患者的发病率为4.32例/10万人,但这种普遍增加的原因尚不清楚。在最近的大型队列中,PCNSL诊断时的中位年龄约为67岁。一项广泛的国际研究报告了在儿童和青少年中75例主要累及 CNS 的淋巴瘤病例,但其中仅一半患有DLBCL,表明该年龄组的 CNS 中可能出现其他淋巴瘤实体。男性和免疫缺陷综合征患者中的发生率更高。此外男性 PCNSL 的发生率高于女性。
除了人类获得性免疫缺陷病毒,长期接受免疫抑制剂治疗的患者(如接受实体器官移植或自身免疫性疾病患者)也是 PCNSL 的主要风险人群。免疫抑制患者中PCNSL的患者和疾病特征见BOX1。而在无明显免疫抑制的人群中PCNSL的风险因素尚未确定,未经证实的小型研究表明 PCNSL 与扁桃体切除术或口服避孕药之间存在相关性。

机制/病理生理学
基因异常
PCNSL 在编码免疫球蛋白的基因中存在体细胞突变,主要为IGHV4-34。异常体细胞超突变可影响其他基因 (图1) ,包括BTG2(编码一种转录共调节因子)、H1-4(也称为HIST1H1E;编码组蛋白H1.4的一部分)、KLHL14(编码 Cullin 3 泛素连接酶的底物接头)、MYC(编码一种参与细胞周期、细胞生长、凋亡、细胞代谢和生物合成、粘附和线粒体生物合成)、PAX5(编码 B 细胞转录因子)、PIM1(编码参与细胞凋亡、细胞周期进程和转录激活的丝氨酸-苏氨酸激酶)、RHOH(编码负性调节细胞生长和存活的 GTP 酶)或SUSD2(编码细胞周期负调控因子)。
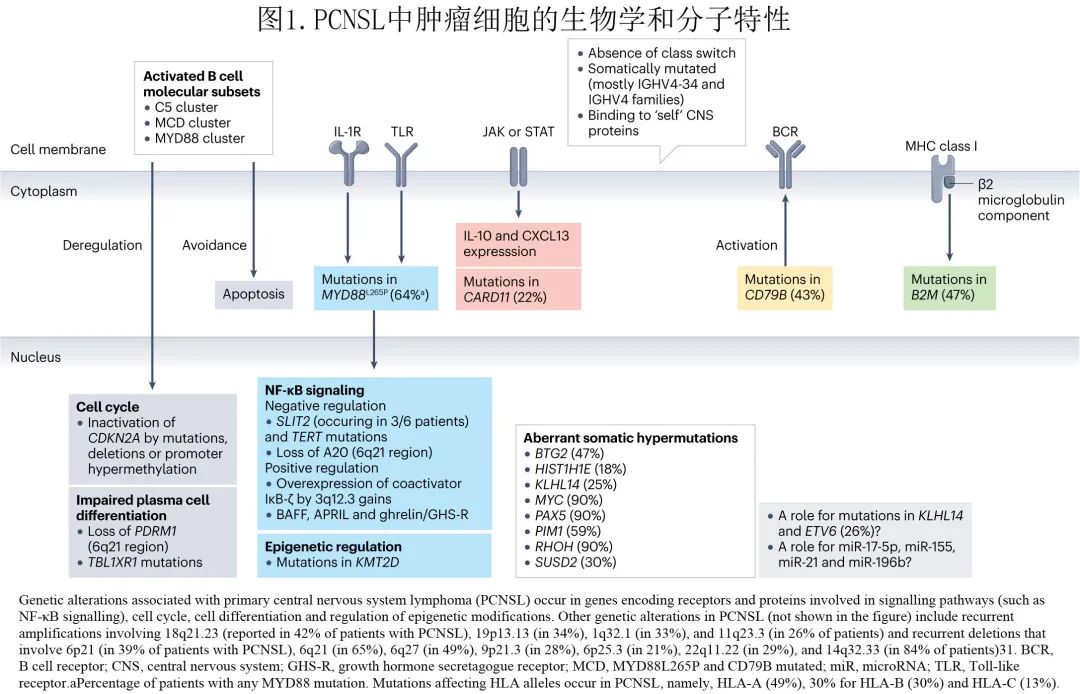
根据起源细胞的表达谱,系统性 DLBCL 在预后上可细分为生发中心 B 细胞样(GCB)和活化 B 细胞样 (ABC) 亚型。也有研究确定了一种系统性 DLBCL ABC 亚型,即C5、MYD88L265P和 CD79B 突变 (MCD) 或 MYD88 簇。大多数 PCNSL 表现为non-GCB表型,但无预后意义。此外,PCNSL的许多基因异常与 ABC 亚型的 MCD 集群共享;例如MYD88中的 L265P 突变可激活 B 细胞受体 (BCR)、Toll样受体 (TLRs) 和NF-κB信号转导,并与 CD79B 协同作用,阻断终末 B 细胞分化,使细胞周期失调,促进免疫逃逸并防止 B 细胞凋亡。同样,KLHL14的突变可促进 MY-T-BCR 超复合物(包括MYD88、TLR9和BCR)的装配,从而激活NF-κB信号转导。此外,CARD11功能获得性突变可刺激组成性NF-κB活性并诱导侵袭性 B 细胞增殖,ETV6(编码转录因子ETV6)突变对淋巴和骨髓血液恶性肿瘤均易感。
PCNSL 中BCR–TLR–NF-κB信号转导的构成激活依赖于几个遗传事件。CD79B(主要是Y196N、Y196D、Y196C、Y196H和Y196S9)和MYD88(主要是L265P)的突变多与PIM1(编码一种参与淋巴瘤发生的蛋白)突变同时发生。3q12.3的复发性gain(发生于45%的 PCNSL 患者中)可诱导NFKBIZ(编码NF-κB共激活因子IκB-ζ)过度表达。SLIT2 突变可使 NFKBIZ 失活,并导致NF-κB信号转导的负调控。TERT(编码端粒酶逆转录酶,是NF-κB的靶点和辅因子)的突变也发生在 PCNSL 中。NF-κB通路的激活可由肿瘤坏死因子 (BAFF) 家族的 B 细胞活化因子 APRIL 和饥饿素-生长激素促分泌素受体 (GHS-R) 轴的过表达引起。6q21 缺失可导致TNFAIP3(编码NF-κB的负调控因子A20)和PDRM1(编码浆细胞主调控因子BLIMP1)缺失;PDRM1 在 PCNSL 中也可发生突变,其突变可使 B 细胞终末分化失调。部分基因的过度表达与结局相关:例如:在结局较差的患者中报告了致密肿瘤细胞簇导致的高磷酸化 STAT6 表达。
PCNSL与C5–MCD–MYD88簇的其他相同特征包括:CDKN2A失活,可因突变(存在于28%的 CDKN2A 失活个体中)或缺失而发生,或由启动子超甲基化介导;编码表观遗传调控因子(EZH2、CREBBP和EP300)的基因突变相对缺失,KMT2D除外;TP53突变率低于系统性DLBCL;MYC和 BCL2 重排率低于系统性DLBCL,而 gains或amplifications与MYC 和 BCL2 蛋白过表达也可能出现。与这些异常不同的是,影响BCL6(位于3q27.3)的易位在 PCNSL 中很常见。此外ETV6在 PCNSL 中失活,但发病作用尚不清楚。
PCNSL 的其他基因异常包括涉及18q21.23、19p13.13、1q32.1和11q23.3的复发性扩增和涉及6p21、6q21、6q27、9p21.3、6p25.3、22q11.22和14q32.33的复发性缺失。
PCNSL 细胞可逃避免疫系统,多是由MHCⅠ类分子的表达缺失引起的,该缺失可能是由于HLA-A、HLA-B和 HLA-C31 的突变,DNA缺失(6p21.32、6q21、8q12-12.2、9p21.3、3p14.2、4q35.2、10q23.21和12p13.2)或单亲二体(uniparental disomy)所引起,也可能是B2M、CD58和 CIITA 的体细胞突变、缺失或重排,其编码参与免疫逃避的蛋白。有研究发现影响CD274(编码PDL1)基因座的染色体易位以及更罕见的 CD274 和PDCD1LG2(编码PDL2)基因组扩增,但部分研究没有发现 PDL1 上调,因此这些分子在 PCNSL 中的作用尚不完全清楚。在 PCNSL 中也发现了microRNA miR-17-5p、miR-155、miR-21和 miR-196b 的上调,但这些 microRNA 的作用仍在研究中。
一项使用多组学方法评估大样本 PCNSL 的研究识别了PCNSL的四个集群 (CS1-4)。CS1 和 CS2 具有高甲基化、“免疫-冷”特征,其临床行为不同:CS1中存在高活性的多梳抑制复合物2和 CDKN2A 缺失,导致增殖活性增强;CS4 表现出“免疫热”特征和突变增强JAK–STAT和NF-κB活性,并与有利结局相关;CS3 具有生发中心和成熟 B 细胞的特征,富集 H1-4 突变,与脑膜浸润相关,并表现出最差的结局。这些疾病簇的鉴定可能具有未来的治疗意义:CS1可从细胞周期蛋白D–CDK4/6和 PI3K 抑制剂中获益,CS2可以使用靶向来那度胺或其他去甲基化药物,CS3可以用 EZH2 抑制剂治疗,CS4可以对免疫检查点和 JAK1 抑制剂有反应,但还需要进一步的研究来证实这些方法的有效性。
微环境
免疫功能正常PCNSL 患者的病理生理机制尚不完全清楚,原因之一在于缺乏可用于研究疾病机制的更有效动物模型。此外PCNSL 细胞的起源也仍不清楚,需要进一步的研究来确定这些肿瘤是由迁移到 CNS 的外周 B 细胞的局部转化引起的,还是来自免疫反应期间(如感染)募集到 CNS 的 B 细胞随后发生肿瘤转化(这个不太可能)。然而考虑到缺乏任何支持性数据,后一种机制仍然是推测性的。
肿瘤性 PCNSL 细胞表达的免疫球蛋白可与 CNS 中表达的自身蛋白结合,从而驱动慢性 BCR 信号,这些自身蛋白为GRINL1A、ADAP2、BAIAP2、N-高糖基化 SAMD14 和 neurabin 1。
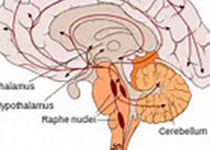
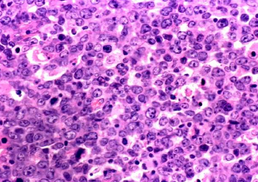
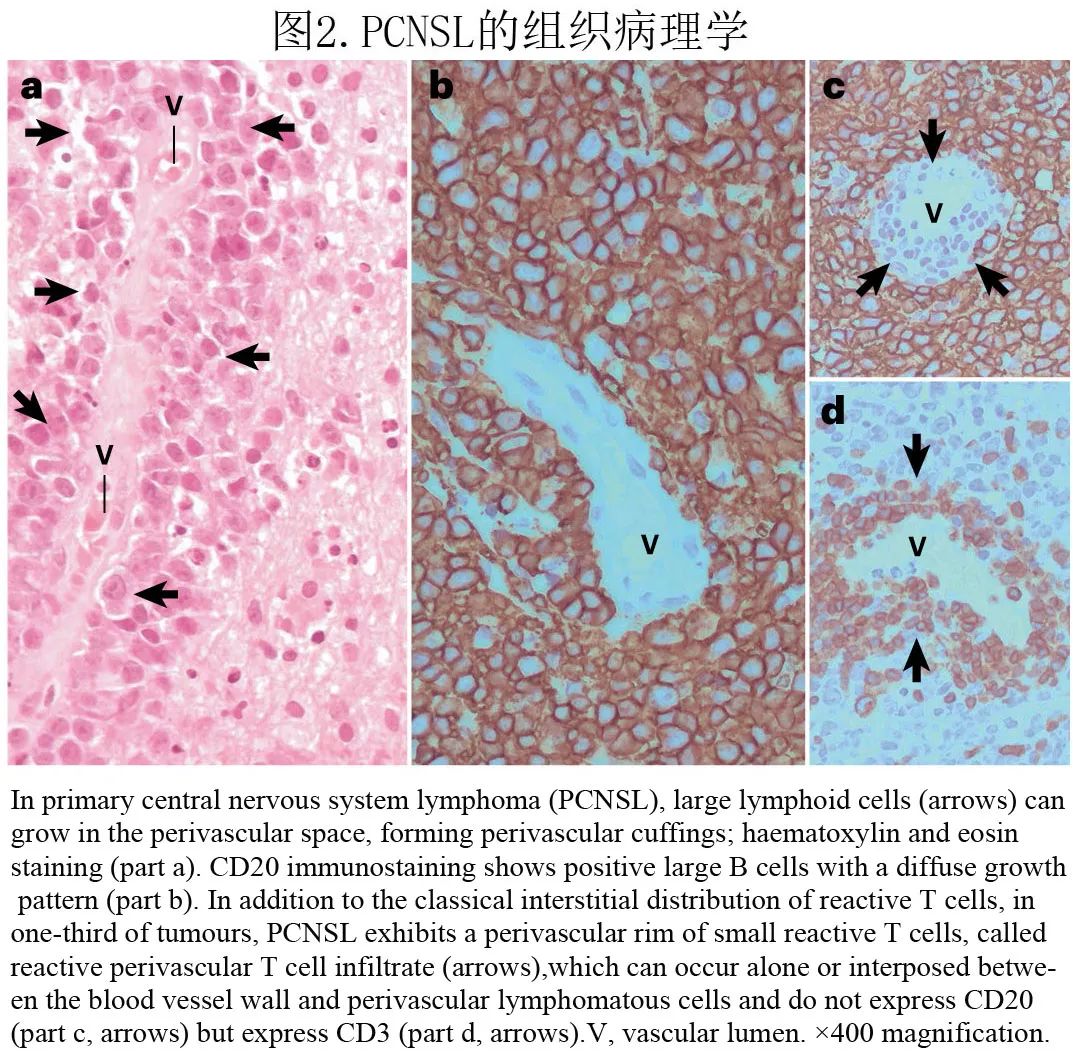
PCNSL非常独特,因其有在血管周围生长的倾向(图2a)。虽然也可发生致密、弥漫性或纯间质生长模式。30%以上的患者存在经典的间质分布和小反应性 T 细胞的血管周围边缘(反应性血管周围 T 细胞浸润;RPVI)(图2b,c)。RPVI 可单独发生,也可插入血管壁和血管周围 PCNSL 细胞之间。T 细胞的这种间质分布不是随机的:CD4+ T细胞主要存在于淋巴瘤区域周围,而CD8+ 细胞在肿瘤内占主导地位。与累及中枢神经系统的系统性 DLBCL 不同,PCNSL中的CD8+ T细胞可选择性表达 T 细胞耗竭标志物TIM3,但未差异性表达相似的分子,如LAG3或活化标志物,包括 OX40 和CD69。CD4+ 滤泡 T 辅助细胞和FOXP3+ 调节性 T 细胞的存在程度远低于CD8+ T细胞,而CD56+ T细胞罕见。
PCNSL中肿瘤性淋巴细胞和 RPVI 定位的潜在机制仅部分已阐明(图1和3)。对于RPVI,由周细胞和血管周围巨噬细胞和小胶质细胞产生的 CXCL9 招募CXCR3+ CD8+ T细胞到血管周围区域。肿瘤血管也具有积极作用,因为内皮细胞来源的 CXCL12 与内皮管腔表面的 CXCL9 形成异源复合物,可募集血管周围的CXCR4+ 肿瘤性 B 细胞,形成 PCNSL 的经典组织病理学血管中心模式。
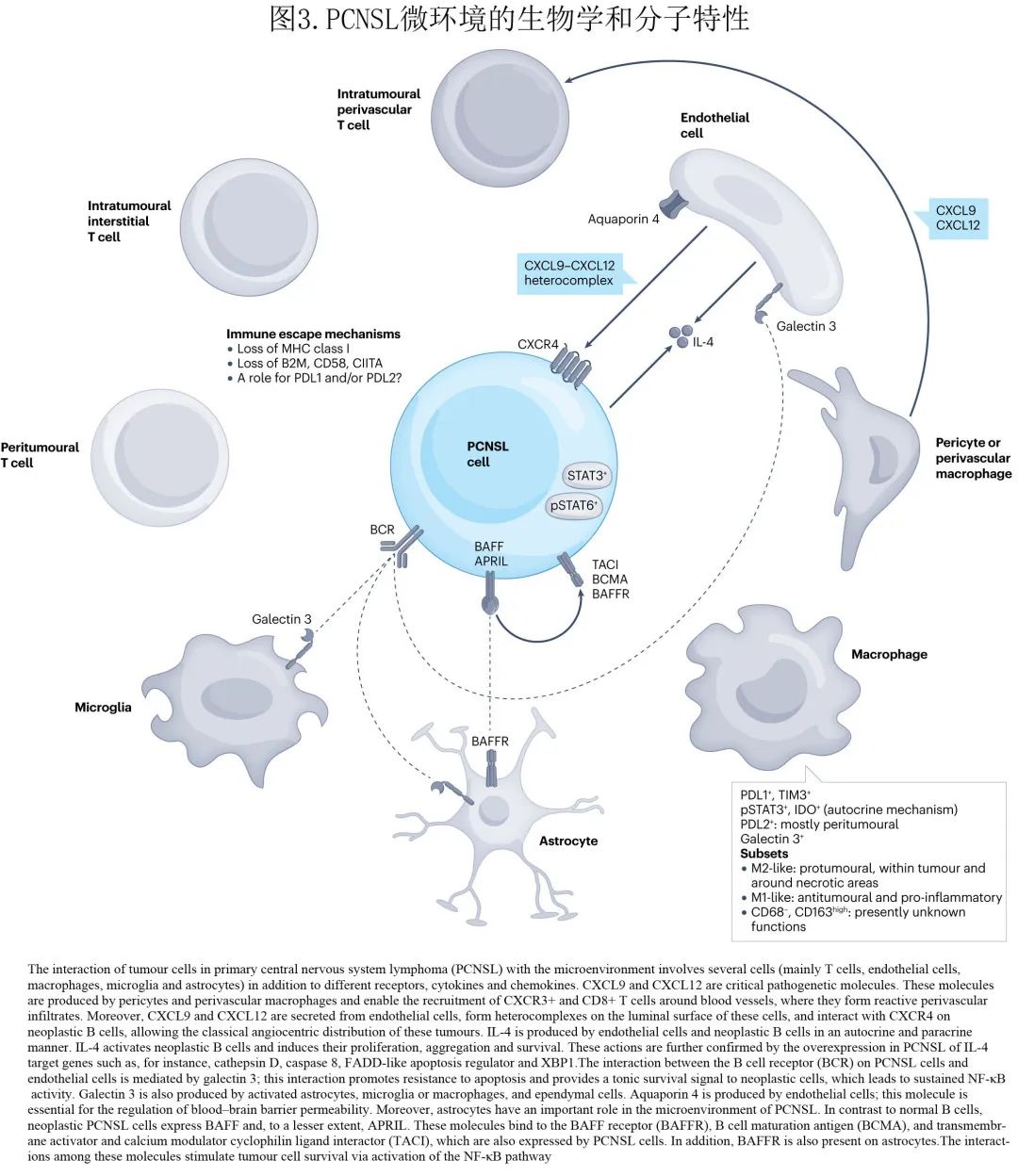
单核细胞和巨噬细胞在 PCNSL 发病机制中也有作用,但许多方面仍不清楚。巨噬细胞在 PCNSL 中大量存在,已发现3个不同的巨噬细胞亚群:M1样,CD68+CD163low细胞群,具有抗肿瘤特性;M2样,CD68+CD163high巨噬细胞,具有促肿瘤作用;CD68-CD163high亚群,其意义尚不清楚。M2 样巨噬细胞在淋巴瘤的中心部分更丰富,聚集在凝固性肿瘤坏死的坏死区域周围;M2 样巨噬细胞表达参与免疫检查点机制的分子(PDL1和TIM3),可能具有重要的免疫治疗意义,但PDL1+ 巨噬细胞的预后作用存在争议。PCNSL 的巨噬细胞和小胶质细胞亚群可能代表不同的功能状态;用伊布替尼和塞利尼索靶向这些细胞可促进其向促炎性 M1 样表型倾斜,并调节 M2 样巨噬细胞上 PD1 和SIRPα的表达。与其他血液恶性肿瘤不同,其中大量肿瘤浸润CD163+ 组织细胞是预后较差的预测因素(如霍奇金淋巴瘤),CD163+ M2肿瘤相关巨噬细胞 (TAMs) 的绝对值无预后价值,而 M1/M2 比值较低与结局较差相关。
巨噬细胞和小胶质细胞表达的其他分子包括 STAT 家族成员,其通过两个关键的相互作用参与 PCNSL 发病。首先,STAT3通过自分泌机制激活 PDL1 和 IDO 的表达,这一特性很重要,可作为一种治疗策略,因为 STAT3 抑制剂可消除 TAMs 中 PDL1 和 PDL2 的表达。PDL2+ TAMs优先聚集在 PCNSL 的瘤周部分,为在 PCNSL 患者中研究 BTK 抑制剂提供了部分原理,BTK抑制剂可直接攻击恶性 B 细胞并增加抗肿瘤免疫应答,因为 BTK 参与恶性 B 细胞存活,并且是巨噬细胞促肿瘤作用所必需的。而且在 PCNSL 小鼠模型中,联合使用 BTK 和 XPO1 抑制剂可利用 TAMs 介导的先天性免疫反应;该策略将先天性免疫应答转向炎症更严重的表型,定义为 M2 巨噬细胞中 PD1 和SIRPα下调、M1巨噬细胞比例增加、及与原肿瘤 M2 特征丧失一致的其他 M1 样和 M2 样特性的调节。此外CD163+ 巨噬细胞和小胶质细胞的密度与肿瘤性 B 细胞中 STAT3 的表达增加相关,表明 TAM 可为 PCNSL 提供促生存和进展信号。
内皮细胞在 PCNSL 发病机制中的作用已在小型研究中探索。淋巴瘤和内皮细胞是 IL-4 的来源,IL-4可在 PCNSL 肿瘤中选择性表达。内皮细胞表达水通道蛋白4(可调节血脑屏障 (BBB) 通透性)和半乳糖凝集素3(小胶质细胞、巨噬细胞和星形胶质细胞也可表达,并由肿瘤性 B 细胞的 BCR 识别)。此外,PCNSL肿瘤中 pSTAT6 的高表达与较差的结局相关。
其他相关微环境成分包括星形胶质细胞(表达 BAFF 受体)、趋化因子和白细胞介素。
诊断、筛查和分层
临床表现
PCNSL 的准确诊断需要高度怀疑和及时检查,PCNSL的症状和表现因神经系统受累区域而异,但系统淋巴瘤的常见症状(即不明原因的发热、盗汗和体重减轻)在PCNSL中罕见。
脑实质PCNSL:PCNSL 最常见的位置是脑实质(92%),其中最常见的临床表现是局灶性神经功能缺损,其次是精神状态改变(BOX 2)。就诊时的局灶性神经系统症状通常提示需脑影像学扫描,可导致快速诊断;而精神病变或非特异性表现通常会导致诊断延迟(从症状发作至诊断平均80天)。

在一项对100例 PCNSL 患者脑部 MRI 表现的研究中,65%的患者为孤立性脑部病变,35%的患者为多发病灶。PCNSL 的大多数脑部病变为幕上(且通常位于额叶)而非幕下,比例为3:1。脑部病变的部位常与特定的临床表现相关;如人格改变和运动缺陷更常与额叶病变相关,失语症与顶叶或颞叶病变相关,视觉缺陷与枕叶病变相关,共济失调与小脑病变相关。脑实质病变更常与脑脊液 (CSF) 中的高蛋白浓度相关,这是由于 BBB 的广泛损伤。
柔脑膜淋巴瘤:0-50%的 PCNSL 患者存在柔脑膜或 CSF 播散,大多数研究报告约15%的患者细胞学或流式细胞术阳性。在一项前瞻性研究中,柔脑膜或 CSF 播散对总生存期无影响。孤立性 CSF 淋巴瘤或原发性柔脑膜淋巴瘤极为罕见,约68%的柔脑膜淋巴瘤患者表现为多灶性症状(BOX 2)。CSF 诊断柔脑膜淋巴瘤(BOX 2)后应及时进行对比增强脑部和脊柱MRI。柔脑膜淋巴瘤患者的 CSF 分析通常显示葡萄糖浓度正常、蛋白水平升高和白细胞计数增加(BOX 3)。

累及眼睛的淋巴瘤:DLBCL 优先累及眼后段,尤其是玻璃体和视网膜,罕见累及眼前段;因此这种表现称为玻璃体视网膜淋巴瘤 (vitreoretinal lymphoma,VRL),发生于约15-25%的 PCNSL 患者中。VRL(BOX 2)多为双侧表现,有时诊断为初始和唯一的疾病部位。在极少数情况下,眼内结构可以是淋巴瘤的唯一部位,即原发性 VRL(PVRL),随后为大脑或CNS受累(图4);PVRL 可为单侧,也可为双侧,女性略多于男性。
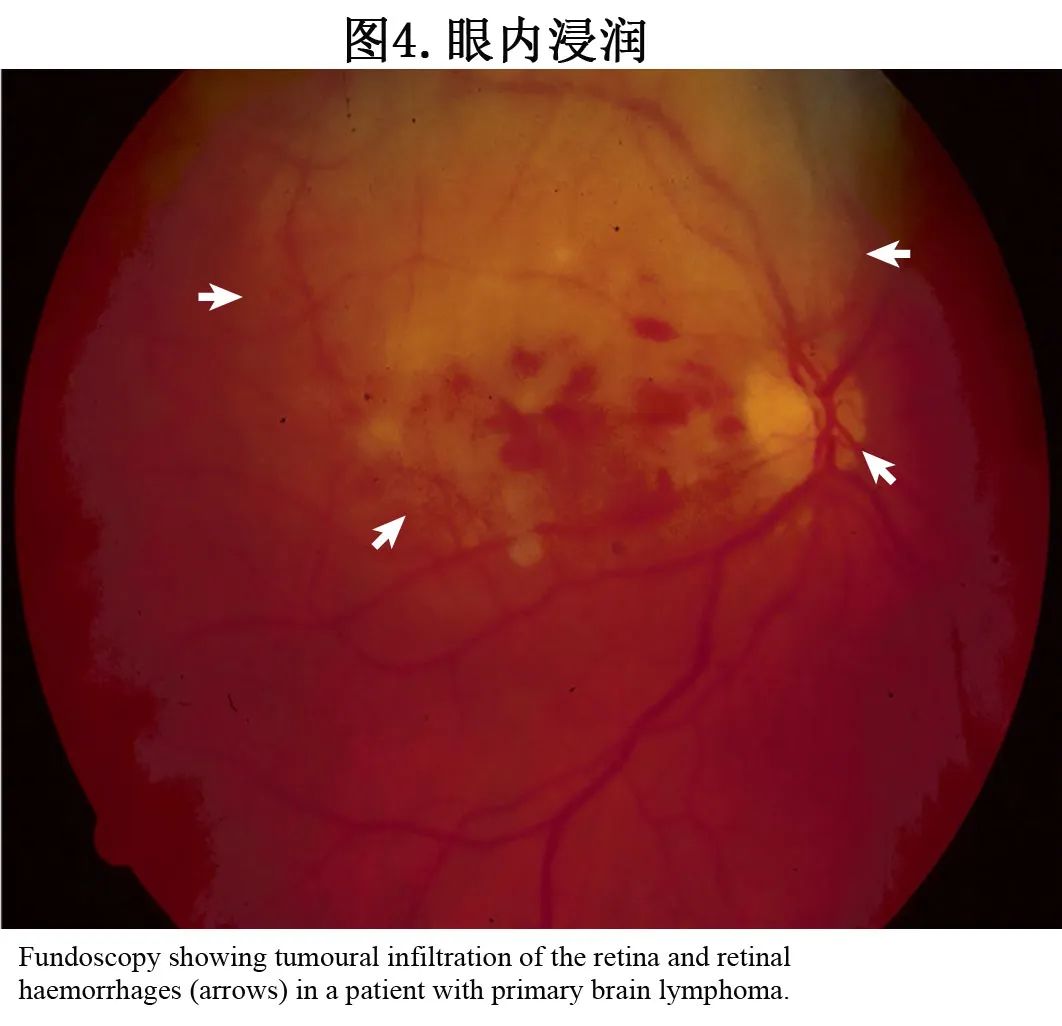
VRL 的症状具有非特异性(BOX 2),患者常被误诊为激素抵抗性葡萄膜炎(葡萄膜炎症)。值得注意的是,伴玻璃体视网膜浸润的 PCNSL 患者中33%无眼部症状。VRL 常与脑实质病变同时发生,应通过对比增强脑 MRI 进行评估。在疑似 VRL 和并发脑部病变的患者中,通过脑活检采集的肿瘤组织应进行组织病理学分析以进行诊断和淋巴瘤表征,不建议进行眼内浸润的组织病理学确认。并发脑损伤和 VRL 的患者中35% CSF 细胞学检查阳性,在无并发脑损伤的患者(即 PVRL 患者)中,玻璃体切除术是采集样本进行诊断的金标准(见下文“诊断、病理学和分子生物学”),而检测到 CSF 样本中的肿瘤细胞有助于确认困难的诊断。此外PVRL 患者的 CSF 参数通常正常。
在一项前瞻性研究中,PCNSL患者并发 VRL 的预后较差。PVRL 患者进展为其他 CNS 部位(尤其是大脑)的风险也较高,15%的 PVRL 患者报告了脑膜播散。此外,31%的 PCNSL 患者在累及 CNS 其他区域之前会出现眼部症状,高达69%的 VRL 患者在病程中会出现 CNS 其他区域的淋巴瘤病变。玻璃体视网膜受累可能是 PCNSL 复发的表现体征。
值得注意的是,眶后淋巴瘤(可表现为眼球突出)位于CNS之外,因此不属于 PCNSL 或PVRL,疑似眶后淋巴瘤患者应及时接受全身性淋巴瘤检查。
脊髓淋巴瘤:原发性脊髓淋巴瘤罕见,占所有 PCNSL 的<1%(BOX 2)。系统性淋巴瘤患者可发生柔脑膜播散或硬膜外病变,导致脊髓或马尾神经受压;脊髓髓内淋巴瘤也可罕见发生。CSF 细胞学检查在大多数患者中无诊断价值。尽管脊髓活检具有较高的重要后遗症风险(如永久性运动和敏感途径损伤),但在罕见的单髓内病变病例中进行确诊仍有必要,因为生物标志物在这种罕见形式PCNSL 中的诊断作用仍不明确。在同时累及脑和脊髓实质的多灶性疾病中,应首选脑部病灶活检而非脊髓活检。
影像学
钆增强 MRI 是支持疑似PCNSL、界定 CNS 肿瘤扩展、定义治疗反应、随访期间监测 PCNSL 和确认肿瘤复发的标准影像学程序。使用 MRI 和 PET 诊断和监测 PCNSL 可参考国际 PCNSL 协作组的共识建议。常规 MRI 的建议与既往胶质瘤和颅内转移瘤的共识建议一致,重点关注影像采集相对时间和含钆造影剂给药剂量的标准化(图5);这些建议还强调了采用梯度回波或(理想情况下)自旋回波技术进行容积采集定量病变尺寸的重要性。

先进的 MRI 技术,如表观扩散系数的弥散加权成像测量(diffusion-weighted imaging measurements of apparent diffusion coefficient)、动态磁敏感对比 MRI (dynamic susceptibility contrast MRI)和相对脑血容量(relative cerebral blood volume),也可用于 PCNSL 的诊断。初步研究还显示表观扩散系数和相对脑血容量的潜在预后价值,但还需要在 PCNSL 患者中进行多中心临床试验来验证这些技术的临床应用。这些积极的结果激发了促进弥散加权成像和动态磁敏感对比 MRI 共识方案的努力。其他先进的成像方法也显示出诊断 PCNSL 的希望,包括脑 PET 和动态对比增强 MRI。
诊断、病理学和分子生物学
脑实质 PCNSL 诊断的金标准是立体定向活检,脑膜原发性 DLBCL 这一罕见病例(通常认为是 PCNSL 的形式)可根据手术切除采集到的样本进行诊断。组织病理学检查通常可见肿块形成的大淋巴细胞排列成实性片状,病灶边缘呈特征性的血管周围、血管中心模式(图2)。肿瘤性淋巴细胞是含有中等量胞质的大细胞,圆形至椭圆形泡状核(含小的充满液体的囊泡),泡状染色质,常位于核膜附近的2个或3个小核仁(中心母细胞样形态),伴有数量不等的具有免疫印迹样特征的成分,即大的圆形细胞,具有中等量的两亲性或嗜吡啶性细胞质和特征性的大的圆形泡状细胞核,含有明显的核仁。这些细胞还伴有数量较少但不等的小反应性 T 细胞,也可排列为RPVI、巨噬细胞、活化的小胶质细胞、反应性星形胶质细胞和反应性、非肿瘤性 B 细胞。PCNSL 对 B 细胞标志物CD20、CD79a和 PAX5 具有免疫反应性,其中至少一种标志物(最常见为CD20)的免疫染色可用于常规诊断检查。60-80%的病例存在“晚期生发中心免疫表型”,包括 BCL6 和IRF4免疫染色阳性(也称为MUM1)。增殖活性通常非常高。CD10 的免疫反应性通常见于不足10%的患者,此外IgM和 IgD 几乎总是完全由 PCNSL 细胞表达,反映了这些淋巴瘤中免疫球蛋白类别转换的缺失。
应采集所有疑似或确诊 PCNSL 患者的 CSF 样本进行诊断和分期(见下文“分期和风险评估”),但腰椎穿刺可能不安全,尤其是在并发脑肿块和/或广泛病灶周围水肿的患者中,其可导致颅内高压和疝形成风险增加;在这些患者中可能需要咨询神经肿瘤学和神经外科专家。CSF 检查包括理化参数(外观、颜色、葡萄糖浓度、蛋白浓度和核细胞计数)、常规细胞学和流式细胞术(BOX 3)。PCNSL患者的 CSF 多具有较高的白细胞计数、正常的葡萄糖浓度和高蛋白浓度,后者可反映 BBB 破坏。流式细胞术可检测 B 细胞克隆性,从而增加诊断敏感性。通过评估 MYD88L265P 突变等分子标志物和定量 CSF 中 IL-10 水平,可进一步提高诊断敏感性和特异性;这些生物标志物还可用于不适合活检的肿瘤(如脑干中的肿瘤)或CSF样本细胞构成较低/质量较差的患者,以诊断PCNSL。
玻璃体切除术是诊断 PVRL 的金标准。专业的眼科医生应确认眼内受累,并排除疑似PVRL患者和脑实质淋巴瘤患者的鉴别诊断。脉络膜视网膜活检的信息量远大于玻璃体切除术,但由于其与视觉后遗症高风险相关,因此在少数患者中进行。如果脑活检证实PCNSL 的诊断,则不强制进行玻璃体切除术和脉络膜视网膜活检来确认玻璃体视网膜浸润。通过检测玻璃体或房水样本中 MYD88L265P 突变及IL-10、IL-6水平等分子标志物,可提高玻璃体切除术的敏感性和特异性。MYD88 L265P突变的分子检测已在房水样本中进行;鉴于这些样本中几乎不存在细胞,这种方法似乎非常有前景,因为其比收集玻璃体的侵入性更小,并且可能对缓解评估和分期有价值。
分期和风险评估
推测或组织学确诊为 PCNSL 的患者应接受评估,以确定 CNS 内的疾病程度并排除系统性淋巴瘤。
钆增强脑部 MRI 扫描是检查脑、颅内脑膜和颅神经中 PCNSL 范围的最敏感影像学技术。由于可能发生与活检和疾病侵袭性相关的变化,应在手术活检后再次进行脑部MRI(理想情况下在治疗开始前14天内)作为基线评估。有脊髓受累症状或 CSF 阳性的患者应进行脊柱增强 MRI 检查。
所有确诊PCNSL患者必须进行 CSF 采样、细胞计数、蛋白质和葡萄糖水平检测以及细胞学检查,以检测柔脑膜病变(通常无症状)。通过将流式细胞术与常规细胞学检查相结合可提高诊断灵敏度。
PCNSL患者中仅10-20%报告视觉主诉为眼部受累体征,由于无症状的眼部受累很常见,因此每例 PCNSL 患者均应由眼科专家通过裂隙灯检查和视网膜血管造影或断层扫描进行评估。在脑活检诊断为 PCNSL 并疑似玻璃体视网膜受累的患者中,玻璃体切除术样本的确认是多余的。评估玻璃体和房水IL-6、IL-10和 MYD88L265P可在分期期间确认 VRL。
CNS 外淋巴瘤的检测很重要,因为原发性和继发性 CNS 淋巴瘤的预后和治疗均不同。18FDG-PET的常规分期优于对比增强 CT 扫描,在一项研究中,18FDG-PET在推断为 PCNSL 的患者中4-12%确定了隐匿性系统性淋巴瘤。此外,如果临床上可行,建议对 CNS 外的高摄取病灶进行组织病理学确认。仅当18FDG-PET 扫描不可用时,才应进行颈部、胸部、腹部和盆腔 CT 增强扫描。PET 扫描阳性或18FDG-PET 扫描不可用时,除骨髓活检和穿刺外,还应进行睾丸超声检查。此外,血细胞减少或自体干细胞移植 (ASCT) 适合性不明确的患者,应进行骨髓活检(后者为评估骨髓储备)。
开始治疗前应进行全面的医学(包括合并用药和皮质类固醇使用)和神经系统检查,以及心脏(超声心动图和心电图)、肝脏和肾脏功能的基线评估。应仅对已知患有肺部疾病的患者进行肺部评估(胸部 CT 扫描和肺功能检查,使用肺量计和 CO2 弥散量)。必须进行血液检查(全血细胞计数、肝肾功能指数、HIV、乙型肝炎和丙型肝炎病毒血清学检查以及妊娠试验),因为这些检查的结果可能影响治疗。肝病专家应仔细评估肝炎病毒感染患者,以解决抗病毒预防或治疗的适应症问题。
目前使用两种预后评分系统预测临床试验中的结局并对患者进行分层:国际结外淋巴瘤研究组 (IELSG) 评分和纪念斯隆-凯特琳癌症中心预后评分。前一个评分包括年龄、PS、LDH血清水平、CSF蛋白浓度和 CNS 深部区域受累,而后一个预后评分包括年龄和 PS。
治疗
PCNS 有多种化学免疫疗法组合以及不同的巩固和维持策略。前瞻性试验和回顾性研究纳入了不同的研究人群,但部分研究使用了不精确的标准(尤其是关于年龄和PS)。
改善患者管理的一般建议包括将疑似或确诊 PCNSL 患者转诊至专业中心,以避免诊断延迟和开始适当的治疗。适合患者还应收到前瞻性临床试验的信息,如果试验不可用,应根据多中心、随机试验的结果进行治疗。在后一种情况下为个体患者选择治疗时,应仔细审查并考虑试验的合格标准和研究人群以及评估治疗的毒性特征。
PCNSL可能治愈,但最大限度地减少治疗毒性极具挑战性,其中年龄和基线 PS 是结局的主要决定因素,均影响治疗决策。各前瞻性试验使用不同的年龄上限,多为粗略定义的“fitness”。在选择最佳治疗时不应仅使用年龄,因为80岁患者也可能耐受合理的强化治疗方案,因此决定治疗选择时应考虑其他重要因素,如器官功能、合并症、虚弱、神经毒性风险和患者优先级。PS 是另一个重要的预后因素和决定强度的问题。尤其是 PCNSL 和ECOG-PS > 2的患者,在强化治疗期间可能会出现重要并发症(即重度感染、深静脉血栓形成、血栓栓塞、糖尿病和其他代谢紊乱),而这些并发症多与长期卧床(即患者卧床数周或数月)和使用类固醇有关。
新诊断 PCNSL 患者可归类为适合强化治疗(特别是大剂量化疗 (HDC) 和ASCT)的fit患者、不适合 HDC-ASCT 的fit患者和不适合化疗的unfit患者(图6)。尤为重要的是在整个治疗过程中应动态评估巩固策略(如HDC-ASCT)的适合度。此外应始终与患者讨论治疗的潜在获益和风险。
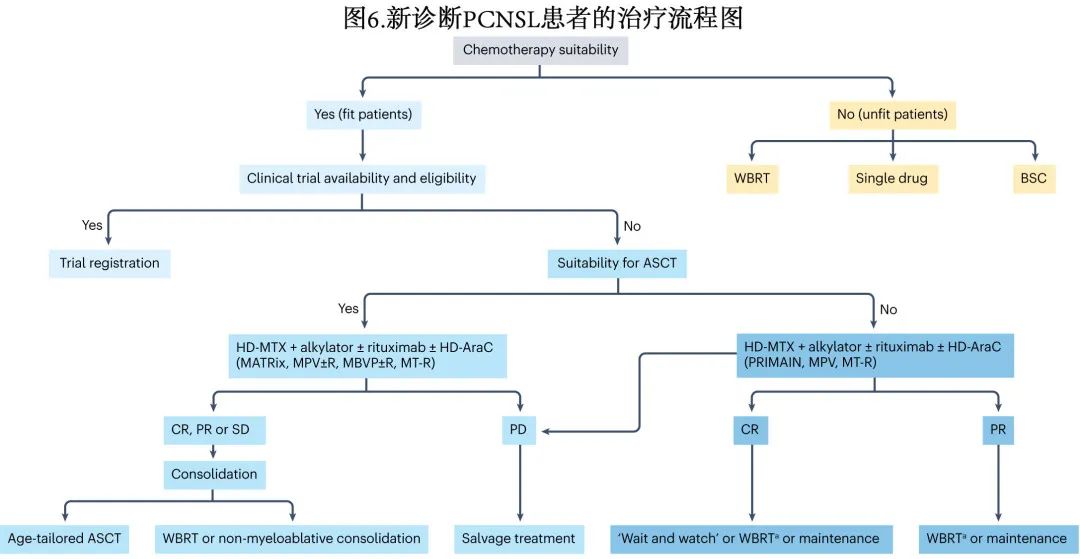
Fit患者
含大剂量甲氨蝶呤 (HD-MTX) 的多药化学免疫治疗方案强化诱导后,再给予巩固策略(HDC-ASCT、放疗和/或非清髓性化疗)治疗fit的 PCNSL 疗效最高,巩固策略旨在消除残留病灶、最大限度地延长缓解持续时间和改善生活质量。HDC-ASCT 越来越多地应用,两项国际随机试验的初步结果似乎证实了其相对于非清髓性化疗巩固的优越性。由于越来越多的神经毒性证据,常规剂量全脑放疗 (WBRT) 的使用频率低于前几年;此外正在探索降低剂量和靶向放疗手段。
诱导方案:HD-MTX 是 PCNSL 诱导方案中最重要的组成,包括AraC联合 HD-MTX、MTX-AraC、MTX-AraC+利妥昔单抗 (R-MTX-AraC)、HD-MTX–HD-AraC+利妥昔单抗+塞替派 (MATRix)、HD-MTX+利妥昔单抗+替莫唑胺(MT-R)、HD-MTX+利妥昔单抗+甲基苄肼和长春新碱(R-MPV)联合鞘内 MTX 治疗累及 CSF 的淋巴瘤患者,以及 HD-MTX +替尼泊苷+卡莫司汀+泼尼松龙(MBVP)等,但这些方案尚未在头对头研究中进行比较,因此尚未证实哪个联合方案具有优效性;其中MATRix 是唯一的例外,因为 IELSG32 随机试验证明,与HD-MTX–HD-AraC和HD-MTX–HD-AraC+利妥昔单抗联合治疗相比,加用利妥昔单抗和塞替派可显著改善结局。然而地区偏好会影响特定诱导治疗方案的选择,通常基于机构经验。
利妥昔单抗在 PCNSL 中的应用存在争议,但一项META分析证实加用利妥昔单抗可使 PFS 获益,此后许多诱导方案继续加入利妥昔单抗,因为增加的毒性极小。
在 CSF和眼内体液中达到治疗浓度方面静脉给药存在药代动力学局限性,一些权威机构建议在诱导治疗期间包括鞘内和/或玻璃体内化疗;但支持这些方法的证据仅来自非随机前瞻性和回顾性研究,且结果相互矛盾、有时甚至毒性显著。因此如果可以应用适当的系统化疗,则不应规推荐鞘内和玻璃体内化疗,但可以考虑分别将其用于对于基于HD-MTX方案反应不充分的持续性、孤立性、脑膜淋巴瘤或 VRL 患者。Fit的PVRL患者应接受基于 HD-MTX 的诱导化疗,使用与其他 PCNSL 患者相同的联合治疗。如果需要眼内疾病快速消退,可加用玻璃体内 MTX 注射。对基于 HD-MTX 的诱导治疗完全缓解 (CR) 或部分缓解的 PVRL 患者可接受低剂量双眼照射巩固治疗,而 ASCT 巩固治疗的风险和获益可与选定患者讨论。
巩固治疗:HDC-ASCT。PCNSL 中 HDC-ACST 的原理是递送能够以足够高的剂量穿过 BBB 的抗癌药物,从而在 CNS 中达到有效的治疗浓度并克服耐药性。通常用于治疗系统性淋巴瘤的预处理方案(即 BEAM 方案,包括卡莫司汀、依托泊苷、AraC和美法仑)在 PCNSL 中的结果令人失望,而含塞替派的方案具有良好的疗效。
总的来说,在年轻和fit的患者中,HCD-ASCT 具有非常好的长期结局,并且在这些患者中有很大一部分可以避免WBRT。然而这些结果来自前瞻性试验,因此不能扩展至 PCNSL 患者的总体人群。
巩固治疗:放疗。含 HD-MTX 诱导后WBRT 巩固是降低 PCNSL 复发风险的标准治疗,然而ASCT现在是基于 HD-MTX 化疗后fit患者的首选,对于自体干细胞采集不足、诱导化疗后出现显著毒性或拒绝 HDC-ASCT 的患者,WBRT仍然是巩固治疗的替代方法。巩固 WBRT 与迟发性神经毒性、记忆恶化、人格改变、步态障碍和尿失禁相关,尤其是在年龄>60岁的患者中,开始治疗前与临床肿瘤专家讨论潜在获益和毒性至关重要。
随机 RTOG1114 试验评估低剂量WBRT,发现与单独使用 R-MPV-AraC 相比,R-MPV-AraC后使用 WBRT 可改善PFS。在中位随访55个月后进行的意向治疗分析发现,放化疗组的2年 PFS 为78%,单纯化疗组为54%。但需要更长时间的随访来检测治疗组之间神经毒性的差异。
巩固治疗:非清髓性化疗。非清髓性化疗可能是 ASCT 或 WBRT 的有效替代方案。
未来的研究应优化诱导治疗以减少毒性,使得大多数患者接受有效的巩固策略。此外,应在前瞻性试验中探索靶向药物的作用。
老年或unfit患者
老年 PCNSL 患者是易感人群,结局普遍较差,对治疗相关毒性的易感性也更高。重要的是,如果症状和 PS 获益几乎无法实现时,特定的虚弱患者应首选最佳支持治疗(图6)。在大多数研究中,60-65岁通常是定义老年人群的阈值。由于美国、欧洲和亚洲 PCNSL 诊断时的中位年龄为67岁,约半数新诊断 PCNSL 病例发生于老年人。
年龄>70岁 PCNSL 患者的预后仍未得到实质性改善,可能是由于老年患者的 PS 相对较差,其合并症发生率较高,以及在该人群中使用侵入性较小且可能次优的治疗。在根据法国已发表指南接受治疗的确诊老年 PCNSL 患者的前瞻性队列中(>90%接受含 HD-MTX 治疗,未接受WBRT),年龄≥60岁患者的中位生存期为15.4个月,5年生存率为28%。
尽管在老年人中开展的前瞻性研究数量有限,但一致认为使用 MTX 联合其他化疗治疗新诊断老年 PCNSL 患者与年轻患者相似。可根据肾功能估计值调整 MTX 剂量;在采取适当支持措施、频繁监测血清 MTX 水平和尿清除率时,多数肾功能正常的老年患者(包括>80岁的患者)对≤3.5 g/m2 MTX耐受良好。肾功能正常的老年患者无需降低 MTX 剂量,因为剂量强度降低可能导致结局较差。
接受 HD-MTX 的老年患者 CR 率为17%~69%,中位 PFS 为6-16个月,中位 OS 为14-37个月,OS改善与基于 HD-MTX 的治疗相关。尽管利妥昔单抗可用于多种免疫化疗组合,但其对老年患者的获益仍存在争议。
由于临床神经毒性风险较高(BOX 4)及其对生活质量的负面影响(见下文“生活质量”),WBRT巩固治疗通常不用于老年 PCNSL 患者。在推荐减低剂量WBRT 用于老年 PCNSL 患者之前,还需要更多的研究结果。

已经研究了延长老年患者缓解持续时间的替代方法,例如调整 HDC-ASCT 很有前景。对于不适合 HDC-ASCT 巩固治疗的患者,其他策略包括MTX维持或使用在该年龄组中耐受性更好的药物治疗,包括口服烷化剂(替莫唑胺和甲基苄肼)、利妥昔单抗、来那度胺和伊布替尼。
口服烷化剂(替莫唑胺)和局部治疗(眼部照射或玻璃体内 MTX 注射)是unfit PVRL 患者或化疗禁忌PVRL患者可接受的一线治疗选择。
复发和挽救治疗
尽管 PCNSL 的治疗取得了治疗进展,但仍有患者对基于 HD-MTX 的化疗无应答 (15-25%) 或在初始应答后复发 (25-50%)。老年患者的复发率较高,但较差的预后与年龄无关,原发性难治性疾病的中位 OS 为2个月,初始治疗第一年内复发的患者的中位 OS 为3.7个月。复发主要发生在CNS,通常发生在与原发病变不同的部位,约四分之一接受监测 MRI 的患者诊断为复发。
复发性或难治性 (R/R) PCNSL 的治疗是重要的未满足的医疗需求,因为尚未确定标准治疗,临床试验入组应是这些患者的首选(如可用)。临床实践中的治疗选择应基于现有的已发表数据,考虑患者年龄、功能状态、器官功能、合并症和既往治疗。挽救性化疗策略可包括 HD-AraC 或 HD-异环磷酰胺联合依托泊苷和/或卡铂或顺铂,可联合利妥昔单抗,随后在既往未接受过移植的年轻健康患者中进行巩固性HDC-ASCT。HD-MTX 再激发对既往对该药物有长期反应的患者有效。WBRT 是一种替代挽救治疗选择,尽管缓解率相对较高 (74-79%),但中位 OS 较短(11-16个月),临床神经毒性风险为15-20%。
正在研究多种新型治疗药物用于治疗R/R PCNSL,基于疗效证据已将口服 BTK 抑制剂伊布替尼和口服免疫调节药物来那度胺纳入NCCN指南。这些药物的缓解率较高(高达50-60%),但两者的缓解持续时间相对较短(<6个月)。因此应在特定患者中谨慎使用,不应干扰更有希望的临床试验的入组。应强调伊布替尼危及生命的毒性风险,如侵袭性真菌感染,可通过艾沙康唑预防治疗消除。伊布替尼和来那度胺均已在联合治疗试验中进行了评价或正在进行研究, BTK 抑制剂与基于 HD-MTX 的方案联合治疗也正在探索作为一线治疗,来那度胺也被用作 MTX 或 WBRT 挽救治疗后 R/R PCNSL 的维持治疗策略,泊马度胺也有相关研究。
监测
PCNSL患者完成一线治疗后应定期进行临床和外周血检查、钆增强脑 MRI 和眼科访视,以确认缓解、发现复发和排除医源性后遗症。前3年应每3-4个月进行一次随访访视,第4年和第5年每6个月进行一次,然后每年进行一次。但在常规实践中评估神经认知功能的益处存在争议,它需要使用经验证的认知功能测试小组(如国际 PCNSL 协作组提出的)对治疗前功能进行完整评估,并定期重复相同的测试以检测早期认知功能下降,尤其是与自主性丧失和生活质量损害相关的事件。
生活质量
保留神经认知功能在 PCNSL 患者中具有重要意义。生活质量可能受到各种因素的显著影响,包括淋巴瘤的侵袭性和治疗选择(如 HDC-ASCT 或WBRT),因为此类治疗与神经系统并发症相关,并对生活质量产生负面影响。因此避免此类并发症和预防神经认知功能损害可能具有挑战性,尤其是在治疗前 PS 较低的老年和虚弱患者中。在该患者人群中使用侵袭性 HDC 或联合放化疗作为一线或巩固治疗的耐受性可能较差,但适当降低剂量和改善支持治疗使该方案变得越来越可行。
值得注意的是,50-70%的 PCNSL 患者在诊断时存在局灶性神经功能缺损和认知或行为异常。大多数对诱导和巩固治疗有反应的患者可表现出临床改善,部分患者的神经和认知功能可改善至 PCNSL 诊断前水平,然而认知功能进行性下降仍然是 PCNSL 患者强化和多模式治疗后的主要问题。WBRT 与较差的神经认知结果相关(BOX 3),尤其是剂量>40 Gy和老年患者;且联合放化疗治疗与致残性神经毒性相关,累积5年发生率为25-35%,相关死亡率为30%。长期存活者中治疗相关轻度认知功能障碍和晚期神经毒性的患病率可能被低估,因大多数前瞻性研究未进行正式的心理测量评价。
由于 PCNSL 治疗的毒性,新出现的治疗趋势支持基于非放疗的巩固策略(如非清髓性化疗或HDC-ASCT)或低剂量WBRT,以尽量减少认知功能障碍,但降低剂量WBRT 是否可降低长期神经毒性的风险尚不清楚。初步数据表明,与一般人群相比,接受 ASCT 或异基因干细胞移植治疗的血液恶性肿瘤长期生存者在认知功能和生活质量参数方面具有相似的结果,然而需要进一步的研究来更好地描述接受 ASCT 治疗的患者的长期认知功能(BOX 4)。
展望
提高诊断水平
由医生和研究人员组成的多学科团队参与的国际合作是推动 PCNSL 领域临床研究的必要全球战略,此外需要在前瞻性试验中评估具有普遍性和易于重现性的新诊断工具,肿瘤无细胞 DNA 或 CSF 和/或血浆中的生物标志物显示出作为神经影像学辅助工具的前景,但这些方法不能取代手术活检的组织病理学诊断,尽管人们对它们在有手术禁忌的患者中的应用越来越感兴趣。神经影像学的进展和新 PET 示踪剂的使用将允许更准确的放射学怀疑病变和更及时地诊断PCNSL,更广泛地采用2021年关于影像学评估、模式和技术的共识将是该领域向前迈出的重要一步。正在对不同 CNS 肿瘤的放射组学(从临床图像中提取和分析高维数据)进行评价,可改善诊断并更准确地定义治疗反应、复发和神经毒性。
新治疗手段
确定可能是新治疗靶点的、参与 PCNSL 病理生理学的分子和通路,是朝着开发更有效的治疗该疾病的重要一步。一些靶向药物已在 R/R PCNSL 患者中证实有效,但缓解持续时间较短,部分还具有潜在的剂量限制性毒性,这些药物与生物和/或化疗药物的联合治疗正在临床试验中进行评估。
R/R PCNSL 的方案之一是阻断PD1,但相关的II 期试验最终结果待定。R/R PCNSL 的另一种有前景的方法是 CAR T 细胞治疗,小型研究表明该策略在 R/R PCNSL 患者中是可行的,具有一些持久的缓解;PCNSL和继发性 CNS 淋巴瘤的病例报告也证实了 CAR T 细胞的安全性和疗效,值得在 PCNSL 中进一步探索。
系统性淋巴瘤的治疗选择越来越多,包括创新的药效学和新一代药物,具有更低的脱靶效应和更高的疗效,但这些疗法用于 PCNSL 受到 BBB 生物学和药理学作用的限制。然而一种新的策略(肿瘤坏死因子结合NGR)旨在透化肿瘤血管和增加化疗在 R/R PCNSL 肿瘤区域的渗透显示出希望。已经开发了其他方法来改善神经肿瘤学中抗癌药物的肿瘤内扩散。然而,通过直接瘤内给予抗肿瘤药物(如生物可降解晶片或对流增强递送)绕过 BBB 的方法似乎对多灶性疾病(如PCNSL)不太有效,而通过药理学方法增加 BBB 通透性的方法,聚焦超声或利用正常运输机制的方法似乎是基于更多的声音背景。纳米颗粒是促进药物转运进入大脑的一种令人兴奋的方法。利用内在转运机制克服这一屏障的几种方法,如吸附介导的转胞作用、溶质载体介导的转胞作用和受体介导的转胞作用,正在临床前和临床研究中进行探索。
动物模型的发展
已经开发了 PCNSL 的 Singenic 和原位异基因移植动物模型,并为 PCNSL 的发病机制提供了重要见解,特别是肿瘤和免疫细胞之间的相互作用、趋化因子、代谢组学分析、趋向性和细胞迁移。此外动物模型已用于研究新的治疗药物,如 BTK 抑制剂、免疫治疗和基于细胞的治疗。现有的 PCNSL 小鼠模型来自淋巴瘤细胞系的直接脑室内或脑内注射,这些模型的局限性之一是细胞系的生物学特征不同于患者的 PCNSL 肿瘤细胞,因此注射细胞和脑微环境之间的相互作用可能不同,且微环境的组成可能由于注射后炎症变化而改变。尽管存在这些局限性,动物模型仍是提高对 PCNSL 发病机制认识和确定新治疗策略的重要工具。
参考文献
Ferreri AJM,et al. Primary central nervous system lymphoma.Nat Rev Dis Primers . 2023 Jun 15;9(1):29. doi: 10.1038/s41572-023-00439-0.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言