Front.mol neurosci-神经发生和脑肿瘤发生的WNT信号传导
2022-11-16 brainnew神内神外 brainnew神内神外
神经发生是指从神经上皮细胞产生神经元,神经系统干细胞称为神经干细胞 (NSC)。NSC 具有典型的双极形状,其顶端质膜衬在神经管的管腔内,而基底质膜与基底层相邻。
神经发生是指从神经上皮细胞产生神经元,神经系统干细胞称为神经干细胞 (NSC)。NSC 具有典型的双极形状,其顶端质膜衬在神经管的管腔内,而基底质膜与基底层相邻。在神经发生之前,NSCs 通过对称的增殖分裂来扩大其种群。在神经发生开始时,NSC转化为顶端放射状胶质细胞 (aRG)。
aRG 细胞的一个子集切换到不对称的分化细胞分裂以直接或通过产生中间祖细胞 (IPC) 和基底放射状胶质细胞 (bRG) 来产生神经元。活跃的神经发生发生在两个主要区域,侧脑室的 SVZ 和海马齿状回的颗粒下区 (SGZ)。而神经细胞在脑实质中经历不受控制的细胞分裂时,就会发生原发性脑肿瘤。
神经发生和肿瘤发生共享参与细胞增殖、分化、迁移和死亡的信号分子/途径。神经干细胞的自我更新是一个严格调控的过程,可确保细胞分裂的准确性并消除发生有丝分裂错误的细胞。控制这一过程的分子机制异常会引发非整倍体和基因组不稳定,从而导致肿瘤转化。影响细胞粘附、极性或迁移的突变增强了侵袭潜力并有利于肿瘤的进展。来自卡塔尔基金会哈马德本哈利法大学的作者回顾了 WNT 通路参与神经发生和肿瘤发生的最新证据,并讨论了针对该通路成分的治疗机会的实验进展。 研究结果
研究结果
01WNT 信号通路在神经发生和脑肿瘤发生中的作用
WNT 配体(哺乳动物中有19个成员)是分泌蛋白,可激活不同的细胞内信号转导途径并调节组织生长和更新。经典途径,也称为 WNT/β-catenin 途径,高度保守可调节干细胞增殖,非经典 WNT 通路(定义为不依赖 β-连环蛋白)调节细胞极性、形状和迁移。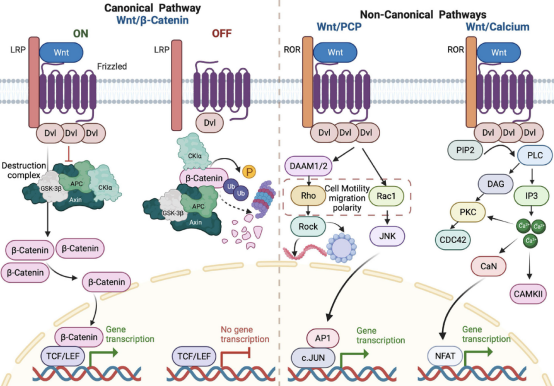 图1 WNT 信号通路概述
图1 WNT 信号通路概述
WNT/β-连环蛋白调节生发区增殖/对称和神经源/不对称分裂之间的平衡。然而,经典 WNT/β-连环蛋白信号在神经发生中的作用是复杂的。这取决于模型、目标成分和操纵通路的上位水平。β-连环蛋白的基因消融会触发细胞周期退出和神经元过早分化,相反,组成型活性β-连环蛋白的过表达或糖原合酶激酶 3 (GSK3) 的失活会以牺牲分化为代价促进顶端祖细胞的增殖,从而减少中间祖细胞的数量。
但是WNT 通路在神经发生中具有多种关键作用(图2),与神经干细胞在神经元发育过程中增殖或分化的决定有关的一些结论相互矛盾。 图2 WNT 成分在神经发生中的作用
图2 WNT 成分在神经发生中的作用
上皮间质转化 (EMT) 是一个在癌症侵袭过程中起关键作用的生物学过程。细胞通过失去粘附分子和顶端-基底外侧极性的表达以及获得干细胞的分子特征而采用迁移表型。胶质瘤细胞被认为通过降解细胞外基质并通过激活 WNT/β-catenin 促进肿瘤侵袭性来刺激相邻的星形胶质细胞进行EMT。WNT 信号抑制 GSK3β 以稳定 β-连环蛋白,后者易位至细胞核并促进基因转录以有利于EMT。在这个转变过程中,细胞使用金属蛋白酶降解基底膜,改变它们的极性,重新排列细胞骨架并迁移。
除了在胶质母细胞瘤(GBM)启动中的作用外,WNT 失调与 GBM 进展有关。这种失调可能是由于 FOXM1 和 PLAGL2 等转录因子的遗传改变,它们促进 β-连环蛋白的核转位并激活 GBM 中的经典 WNT 途径。WNT 信号可以被 WNTless (WLS/Gpr177) 等癌基因激活,其在GBM中高度表达并参与WNT配体的分泌。

图3 在胶质母细胞瘤治疗中靶向 WNT 信号
02WNT 信号作为治疗靶点
正如不同的基因组研究所表明的那样,胶质母细胞瘤肿瘤的特征在于遗传和分子肿瘤内异质性。WNT 信号通路中的多个基因是GBM间充质亚型特异性的预后因素之一,这反映了GBM异质性和WNT与其他GBM驱动因素之间的重要作用。
WNT通路是脑肿瘤中的多方面靶点,可以成为对抗肿瘤干性、侵袭性、血管生成和治疗耐药性的工具。靶向上游修饰剂、FZD 受体和 DVL 的抑制剂靶向经典和非经典途径,而下游抑制剂靶向与肿瘤发生相关的β-连环蛋白。临床上使用或开发的疗法分为三类之一:非甾体抗炎药、小分子化学抑制剂和靶向各种 WNT 通路成分的抗体。
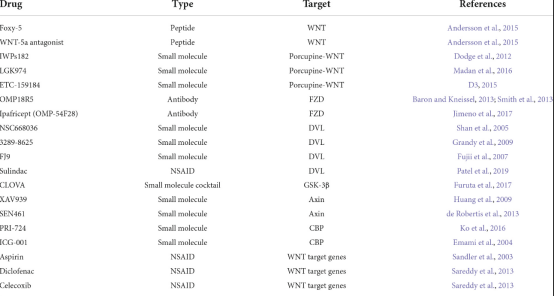 图3 针对 WNT 信号不同成分的药物
图3 针对 WNT 信号不同成分的药物
总结总而言之,靶向WNT信号通路开发药物有一个极大的挑战,确定有效的药物来纠正其不平衡的活动,同时保持组织稳态、干细胞更新和存活等生理功能,需要更多的研究和试验来确定。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言