Adv Mater:蔡林涛团队等开发“磁-声”序贯操控的CAR-T细胞机器人,用于肿瘤精准免疫治疗
2023-02-23 “生物世界”公众号 “生物世界”公众号 发表于上海
胞药物的主动递送一直是生物医药领域一个具有挑战性的难题,而外场驱动的生物微纳机器人有望通过自主和智能化特性穿越复杂生物屏障,为实现药物的定点递送和靶向治疗提供了可能。
癌症是严重威胁人类健康和生命的主要疾病之一,每年有数百万患者死于癌症。免疫疗法是以激活和增强免疫系统来杀伤肿瘤,已成为癌症治疗的一个重要研究方向。尤其是以嵌合抗原受体T (CAR-T)细胞为代表的免疫疗法在治疗恶性血液肿瘤方面取得了巨大成功,但由于严酷的肿瘤生理障碍和免疫抑制微环境严重抑制了CAR-T细胞的浸润与功能活性。
细胞药物的主动递送一直是生物医药领域一个具有挑战性的难题,而外场驱动的生物微纳机器人有望通过自主和智能化特性穿越复杂生物屏障,为实现药物的定点递送和靶向治疗提供了可能。
近日,中国科学院深圳先进技术研究院医药所蔡林涛团队与医工所马腾团队、集成所徐天添团队合作,在 Advanced Materials 期刊发表了题为:Magnetic–acoustic sequentially actuated CAR T cell microrobots for precision navigation and in situ antitumor immunoactivation 的研究论文。
该研究在细胞微纳机器人抗肿瘤免疫治疗肿瘤方面取得新突破,基于细胞代谢的点击化学技术首次实现对CAR-T细胞的表面智能纳米工程改造,获得一种具有“磁-声”双重驱动的细胞微纳机器人,成功克服了体内复杂环境与肿瘤生理屏障,并显着促进了效应T细胞的浸润与原位免疫激活,为CAR-T细胞抗肿瘤免疫治疗提供了一种全新策略。

该研究报道了一种基于代谢-点击化学偶联技术构建的免疫磁珠工程化CAR-T活细胞微纳机器人 (CAR-T cell Robots)。磁珠表面工程化的CAR-T细胞机器人展示了精准、可控的逆流和避障运动特性,并在磁场程序引导下保持特定路线。此外,磁珠与细胞形成的不对称结构使CAR-T细胞机器人表现出独特的声学操控特性,并在“磁-声”序贯驱动下主动迁移并浸润到人工肿瘤模型。
在动物模型中,序贯驱动的CAR-T细胞机器人在可编程磁场引导下实现了长距离肿瘤靶向;随后,通过超声驱动CAR-T细胞迁移到肿瘤深层组织,显着增强了外源CD8+ CAR-T细胞的肿瘤深度浸润与富积。同时,anti-CD3/CD28免疫磁珠能有效刺激瘤内浸润CAR-T细胞的原位增殖和活化,显着提高其抗肿瘤效应并成功抑制肿瘤的生长。
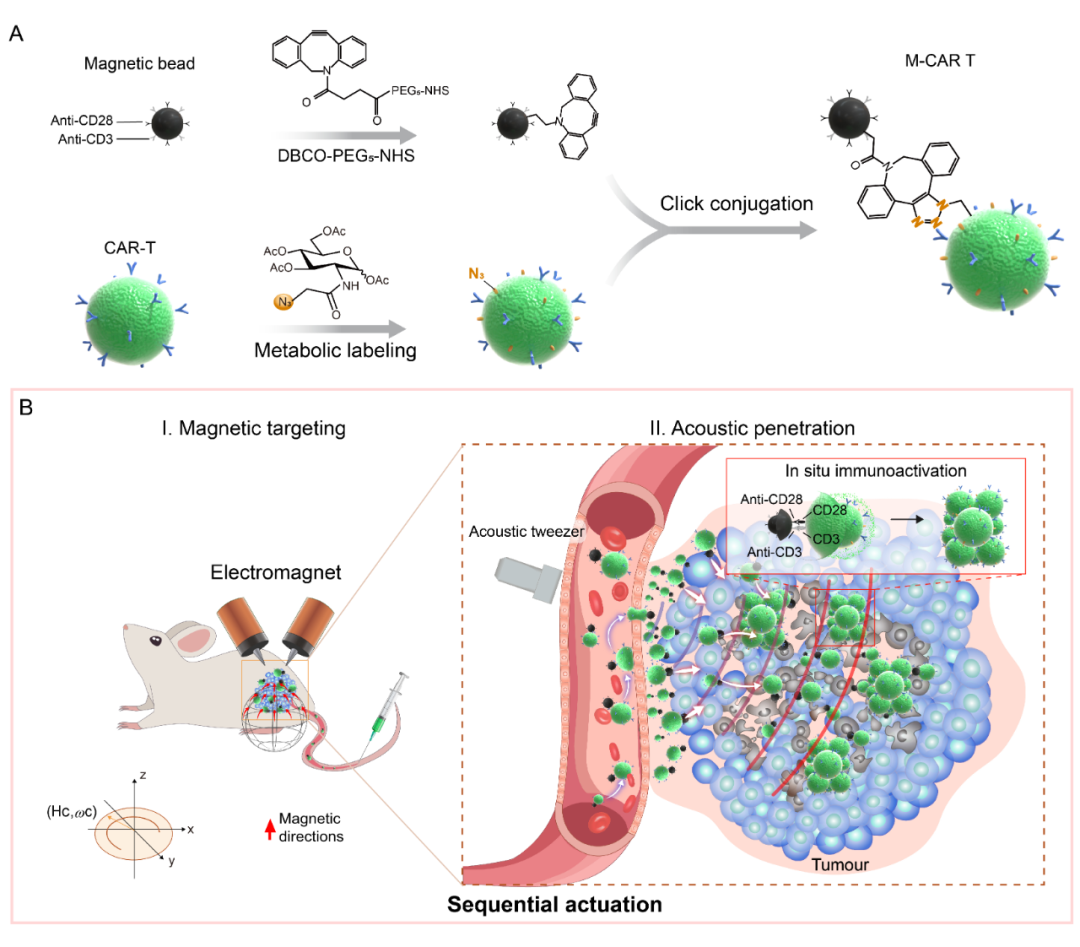
基于“磁-声”序贯操控的CAR-T细胞微纳机器人设计构建及工作原理示意图
该序贯驱动引导细胞微纳机器人结合了智能机器人自主导航、驱动的优势与天然活细胞药物的生物学特性,代表了一种全新的肿瘤精确定位和屏障穿透的多功能细胞治疗平台,这对抗肿瘤精准免疫治疗具有重要的科学意义。
中科院深圳先进院蔡林涛研究员、潘宏副研究员、马腾研究员和徐天添研究员为该论文的通讯作者,唐晓帆博士、杨烨博士、郑明彬教授以及尹婷副教授为论文的共同第一作者。该研究得到了科技部重点研发计划、国家自然科学基金、广东省重点领域研发计划、广东省自然科学基金、深圳市科技计划与中科院深圳先进院跨所联合攻关青年团队等项目的大力支持和帮助。
蔡林涛课题组长期招聘具有纳米医学、肿瘤免疫学、生物化学和细胞生物学等相关研究背景的博士后和联培学生,有意申请者请将个人简历以邮件方式发送至hong.pan@siat.ac.cn。
原始出处:
Xiaofan Tang, Ye Yang, Mingbin Zheng, et al. Magnetic-acoustic Sequentially Actuated CAR T cell Microrobots for Precision Navigation and in-situ Antitumour Immunoactivation. Advanced Materials, 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言